茶饼病病原菌与茶树互作机理研究进展
刘 辉,周玉锋*,周罗娜,赵兴丽,罗林丽,贺圣凌,张 欣
(1.贵州省农业科学院 生物技术研究所,贵州 贵阳 550006; 2.贵州省农业生物技术重点实验室,贵州 贵阳 550006)
0 引言
茶饼病是由坏损外担菌(ExobasidiumvexansMassee)侵染引起的一种茶树真菌病害,主要危害茶树嫩叶、新梢,不仅影响产量,而且用感病芽叶生产的茶叶易碎且味苦,茶叶品质显著下降,严重影响茶农经济效益[1]。1868年首次报道在印度阿萨姆地区发现该病菌,其于1908年成为当地茶园的地方病;1947年首次报道该病在斯里兰卡规模化发生,之后相继在印度、印度尼西亚、马来西亚及日本等国发现[2];我国(安徽)最早于1903年记载茶饼病的发生[3]。20世纪40年代末,各国学者展开了对茶饼病病原物生物学、流行和预测及防治技术等方面的研究[3-9]。茶饼病主要分布在南纬8°至北纬35°,东经75°~138°的区域,亚洲各产茶国及欧洲部分地区如意大利均有发生[4]。我国的产茶区,除江北茶区外,均有茶饼病的发生,尤以西南和中南产茶区的高山茶园发生较严重[5]。茶饼病属于低温高湿型病害,尤以湿度对茶饼病的影响最大[6]。当连续10~14 d保持11 h空气相对湿度均>80%时,坏损外担菌担孢子随风飘落至茶树嫩叶或新梢上的水滴中,在水环境中萌发侵入茶叶,后经3~18 d长出子实层,形成病斑。成熟担孢子可进行飞散传播,从而导致茶园大面积感染[7]。日照也是影响茶饼病流行的主要因子之一,在发病期晨照连续<4 h,可促进发病;若日照>4 h,则可抑止病害流行。发病适宜气温为15~20℃,若气温>31℃,则可抑止病害发生[8-9]。因此,茶树有大量嫩梢、嫩叶存在及温和湿润的气候条件是该病流行所需的两大重要条件[5]。我国茶区茶饼病的流行一般在3-4月,9-10月为流行盛期[9]。关于茶饼病的流行规律、病原菌分离及防治技术等已有大量研究报道,但鲜见关于病原菌与寄主互作机制的研究报道。为科学、高效、绿色地防控及进一步研究茶饼病提供理论依据,从茶饼病病原菌、病原菌与茶树互作机制等方面对2010年以来国内外相关研究进展进行综述。
1 病原菌
1.1 形态特征
茶饼病病原菌为坏损外担菌(ExobasidiumvexansMassee),属担子菌亚门外担菌目外担菌属真菌。病叶泡状区的横切面观察结果(图1)表明,坏损外担菌菌丝体生长在植物细胞间并形成手指状吸器结构侵入到叶片薄壁细胞中。菌丝体生长到一定时期,在感病叶底面的上表皮细胞中形成子实层。子实层密集地排列着无数棍棒型、单胞、无色的担子,形成栅栏结构。担子大小为(30~50)μm×(3~6)μm,顶生3~4个小梗,每个小梗上顶生1个担孢子。担孢子呈肾形或椭圆形,顶端略圆,基部稍尖,大小为(9~16)μm×(3.5~6)μm。感病茶树叶片上的白色粉末即为无数的担子和担孢子[4]。
1.2 培养条件
目前,关于茶饼病病原种类的报道不多,原因在于E.vexans曾被认为是绝对寄生的专性活体营养真菌,其生活史只能在茶树上完成[10]。而后续研究发现,E.vexans也能在maltsalep、马铃薯蔗糖琼脂培养基(PSA)和马铃薯葡萄糖琼脂培养基(PDA)等培养基上生长,但需要添加一些天然活性物质,如水溶性维生素B[11],菌落形成时间大致为20~30 d,而在茶树上完成一个世代的时间大致为11~28 d;在适宜条件下,病原可完成多个世代的繁殖[12]。尽管如此,仍未能形成稳定有效且可重复的培养基。为筛选稳定可靠的茶饼病病原菌体外培养基,CHALIHA等[13]采用响应面法优化适宜茶饼病病原孢子生长的培养基发现,最优查氏(Czapek dox)培养基配方为1 000 mL体系中添加6 g碳源、15%(W/V)茶叶提取物、0.4 g CaCO3,pH 6.5和25℃培养温度;最优PDA培养基为3 g碳源、30%(W/V)茶叶提取物、0.4 g CaCO3,pH 6.5和25℃培养温度;最优V8 Juice配方为0.35 g碳源、7.5%(W/V)茶叶提取物、0.6 g CaCO3,pH 5.75和27.5℃培养温度。在上述3种配方培养基上,E.vexans可获得最大量的可育菌丝,且可存活5周,为下一步研究茶饼病的发病机理、设计防治策略奠定关键基础。
1.3 生理小种
VENKATE等[14]报道,E.vexans可能存在多个生理小种。ABEYSINGHE等[15-16]研究证实,采自斯里兰卡不同地区的E.vexans具有不同长度和宽度的孢子形态,RAPD-PCR和ITS序列分析结果也表明其存在基因型变异和遗传多样性。最新研究结果表明,茶饼病是由多种病原菌共存和协同作用引起的茶树病害,导致茶饼病发病机制的研究变得异常复杂。BARMAN等[17]从多种茶树病叶中收集不同发病时期的茶饼病病斑,从中分离得到42种病菌,根据菌落、菌丝和孢子形态观察,以及ITS-RFLP鉴定和体外致病性测定发现,Pestalotiopsis和Nigrospora是茶饼病中协同存在的2种主要病菌,其可以在茶饼病发生期间诱发茶树并发症,并反过来促进茶饼病的流行。此研究有助于茶饼病的新型有效防控技术策略的研发,但由于田间环境的复杂性,此研究结果仍需进一步验证。
2 病原菌与茶树互作机制
2.1 病原菌的侵染过程
前人研究发现,可将茶饼病的发生时期分为7个阶段:第1阶段,从病原菌穿透角质层第3天开始,直至产生直径<0.5 mm的半透明斑点;随着斑点逐渐扩大,危害过渡到2~4阶段;第5阶段,病害损害开始膨胀,典型症状为叶正面凹陷平滑且发亮,叶背面凸出,暗色、灰色,呈粉末状增厚,最后变为纯白色天鹅绒状,此阶段E.vexans可扩展到海绵组织的细胞间;第6阶段,少量孢子形成;第7阶段,大量孢子形成[10,12]。赵晓珍等[12]通过过碘酸-希夫(氏)(PAS)、甲苯胺蓝(TBO)、台盼蓝(Trypan blue)和伊文思蓝(Evans blue)组织染色观察,将茶饼病在茶叶上的侵染过程分为4个阶段(图2):第1阶段,孢子侵染的0~24 h,担孢子利用芽管穿过叶片下表皮表皮细胞合缝处的角质层,也可通过气孔到达海绵组织的细胞间进行增殖。第2阶段,孢子侵染的1~7 d,孢子萌发阶段,在此期间茶叶组织仍保持较完整的细胞结构;但PAS染色结果表明,海绵组织细胞中红色颗粒堆积增多,边界明显。第3阶段,孢子侵染的7~14 d,吸器形成阶段,可观察到病害侵染的典型特征;伴随E.vexans对茶树叶片组织细胞营养物质的利用,茶树叶片细胞营养耗竭,而细胞和病原都趋向死亡。但同时也诱导了植物的防御机制,对病原的扩展起到抑制作用,可见着色的死亡担孢子和菌丝体。第4阶段,孢子侵染的14~20 d时,孢子形成以及进行2次侵染。

注:A、B,感病叶片的横切面;C,子实层中的棒状菌丝结构;D,担子和担孢子结构;E、F,含有明显分割层的成熟担孢子;G,萌发中的孢子结构(含顶端长有吸器结构的萌发管)。Note: A and B, transverse section of diseased leaves; C, club-shaped hyphae structure in the hymenial layer; D, basidium and basidiospore structures; E and F, mature basidiospores with clearly segmented layer; G, spore structure in germination(containing a germinating tube with a haustorium structure at the end).图1 茶饼病病原菌的形态特征Fig.1 Morphological characteristics of pathogen in tea blister blight
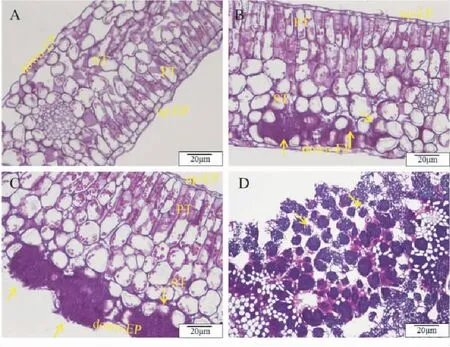
注:A,健康茶叶叶片;B~D,病原侵染茶树叶片1~3阶段。上表皮层,Up-epidermis (up-EP);栅栏组织,Palisade tissue(PT);海绵组织,Spongy tissue(ST);下表皮层,Down-epidermis(down-EP)。箭头所指为Exobasidium vexans的担孢子、担子及菌丝。Note: A, leaf of healthy tea; B-D, 1-3 stages of pathogen infected tea leaves. up-EP, Up-epidermis; PT, Palisade tissue; ST, Spongy tissue; down-EP, Down-epidermis. The arrows indicate the basidiospore, basidium and hyphae of Exobasidium vexans.图2 PAS染色观察E. vexans侵染茶树真叶的组织结构Fig.2 Tissue structure of E. vexans infected tea leaves by using PAS staining
2.2 茶饼病病原菌与茶树互作的生理和分子机制
2.2.1 分子机制 经长期进化,植物形成了一套复杂的免疫系统。植物自身可以通过模式识别受体(pattern recognition receptors,PRR)识别病原体相关分子模式(pathogen-associated molecular pattern,PAMP)并触发早期防御机制,包括活性氧爆发(ROS burst)、丝裂原活化蛋白激酶(smitogen-activated protein kinases,MAPK)激活、胼胝质沉积(callose deposition)及抗性蛋白和防御酶基因表达等,从而调控茶饼病响应过程中的各种生理和生化反应过程,也叫系统获得性抗性(systemic acquired resistance,SAS)。同时,病原菌可以向植物细胞递送效应物以抑制病原相关分子模式诱导的免疫系统(PAMP-triggered immunity,PTI),但是一些效应物可以被植物抗性蛋白识别并激活效应子诱导的免疫系统(effector-triggered immunity,ETI)。ETI是一种强烈的防御反应,引起细胞程序性死亡以及一些信号分子如水杨酸(SA)、茉莉酸(JA)及脱落酸(ABA)等的积累[18]。当前,只有少部分有关茶饼病抗性基因在茶树中被鉴定,通过细胞组学技术可以系统揭示茶树对茶饼病的响应机制。BHORALI等[19]利用cDNA-AFLF和抑制性消减杂交(SSH)技术,从E.vexans感染的茶树嫩叶中筛选鉴定得到部分防御相关的新基因;同时发现,茶树中能量代谢、运输、蛋白修饰、细胞壁防御、氧化胁迫响应及信号传导相关蛋白与抗茶饼病显著相关。利用RNA sequencing技术从茶树叶片中鉴定得到149个基因参与茶饼病免疫响应过程,包括30个防御相关酶,25个resistance genes(R基因),9个耐药转运蛋白,65个转录因子,9个逆转录转座子和其他防御相关基因,其中大部分基因上调表达;茶树可以通过核苷酸结合富亮氨酸重复序列(Nucleotide Binding Leucine Rich Repeat)介导ETI系统的激活、激活R基因介导SA信号通路以诱导次级代谢产物产生和细胞程序性死亡等以抵御茶饼病病原菌的侵染(图3)[20],这些基因也为茶树抗茶饼病基因的功能鉴定提供了候选基因。

图3 茶树对茶饼病的防御机制Fig.3 Defense mechanism in tea trees against blister blight
寄主植物在病原菌入侵过程中可识别某些病原菌中保守物质而激发植物的免疫机制,如真菌细胞壁中的几丁质和β-葡聚糖[21]。植物在响应病原菌侵染的过程中可诱发许多病程相关基因表达〔pathogenesis-related (PR) genes〕,此PR基因既可在病原感染处表达,亦可在非感染区域表达,在非感染区域表达的PR蛋白可诱发植物系统获得性抗性,对提升植物抵抗病原菌二次攻击的能力至关重要[22]。几丁质酶和β-1,3-葡聚糖酶是其中比较典型的具有水解能力的PR蛋白,其中几丁质酶可催化病原菌细胞壁中几丁质N-乙酰葡糖胺同聚体间的β-1,4-连接键水解,β-1,3-葡聚糖酶则可水解细胞壁上的多聚糖形成低聚糖,从而破坏病原菌细胞壁,使其失去侵染能力[23-24]。研究发现,通过农杆菌转马铃薯I型几丁质酶基因和内源1,3-β-D-葡聚糖酶基因能提高茶叶对E.vexans的抗性[25-26]。同时,转内源1,3-β-D-葡聚糖酶基因茶树植株中的I型几丁质酶和类甜蛋白基因表达水平显著上升,超敏反应增强,进一步证明几丁质酶和类甜蛋白在茶树抗茶饼病中的重要作用[25]。
植物病原菌和寄主植物中含有一些以蛋白质、糖蛋白及复杂的碳水复合物聚合体等为存在形式的特异抗原决定簇和识别因子[27]。大量研究证实,植物品种对病害的抗性与寄主植物和病原共有抗原水平有关,共有抗原水平越高的植物品种,其抗病性越差[28]。CHAKRABORTY等[28]研究发现,茶饼病病原菌E.vexans与不同茶树品种中可交叉反应的抗原水平越高,茶树抗茶饼病能力越弱,该抗原物质主要存在于茶树叶片细胞的叶绿体和细胞质中。因此,该抗原物质可以用于茶树抗茶饼病品种的鉴定,也可作为一些杀菌剂的靶标,还可作为抗茶饼病茶树品种分子标记育种的Marker[29]。KARUNARATHNA等[30-31]利用分子标记辅助育种和批量隔离分析技术,从茶树中成功鉴定得到 SSR DNA marker EST SSR 073,此分子标记与光系统I亚基D(PsaD I)相关,是一种E.vexans抗性蛋白,对提升茶树抗茶饼病能力和揭示其抗性机理至关重要。
茶树SAS的激活除了可以通过病原菌侵染诱导外,一些生物或化学诱抗剂也能激活茶树体内的SAS[32-33],如水杨酸、苯并噻二唑、CaCl2、壳聚糖及生防菌等可促进茶树体内防御酶(苯丙氨酸解氨酶、过氧化物酶、抗氧化酶、β-1,3-葡聚糖酶、几丁质酶和超氧化物歧化酶等)活性、提升木质素含量以增强细胞壁功能、促进一些抗菌物质(黄酮类、原花青素及多酚类等)的生物合成、通过NO通路调控下游功能基因表达等,这既为茶饼病的绿色高效防治提供了药剂选择,也为茶树抗茶饼病机理的揭示奠定关键基础[33-40]。
2.2.2 生理机制 病菌基因和蛋白对植物的危害以最终代谢产物的作用体现。植物中某些特定的黄酮类物质对植物真菌病有抑菌效果。研究发现,植物特定细胞液泡中的各种原花青素占叶肉细胞的30%~40%,其对植物各种病原菌具有显著的毒害作用,如,樟子松、番茄枝及桂皮中的原花青素对水稻纹枯病菌、葡萄灰霉病菌等具有显著抑菌效果,其主要作用靶标包括病原菌的蛋白激酶、对二苯代乙烯氧化酶、脂肪酸合成酶和脂氧合酶等[41]。植物中原花青素有2个合成途径:一是通过无色花色素还原酶将儿茶素还原成原花青素;一是在花色素还原酶的作用下,将表儿茶素转换成原花青素。在茶树叶片中检测到花色素还原酶活性,并利用cDNA文库法扩增得到2个花色素还原酶基因CsANR1和CsANR2,表明茶叶是通过表儿茶素途径合成原花青素[42-47]。PUNYASIRI等[42]研究发现,E.vexans侵染可促进易感茶树品种叶片中原花青素的2,3-反式结构异构化为顺式结构,并促进其没食子酸酯化,从而导致其易感茶饼病。
E.vexans入侵茶树叶片后,叶片中除原花青素对茶饼病能起到抑菌效果外,还发生一系列其他内在变化,包括一些抗菌代谢物含量的降低,如咖啡碱、多糖类物质、槲皮素、山奈酚糖苷、芹黄素、杨梅酮苷、单萜类和双萜类物质、倍半萜烯类物质等,同时干扰信号传导物质水杨酸和茉莉酸的合成,以方便E.vexans在茶树体内的定植和生长[45,48-49]。在生理水平方面,抗病和感病茶树品种对茶饼病的响应存在差异,感病叶片的光合速率、蒸腾速率、气孔导度及水分利用效率明显下降,同时,E.vexans入侵可导致叶片中总糖、氨基酸、蛋白质和多酚等物质的含量显著降低,且抗性品种的降低程度显著低于易感品种[50-51]。另外,E.vexans侵染可改变叶片代谢调控,导致γ-氨基丁酸、茶氨酸、赖氨酸、色氨酸及精氨酸等含量发生变化[52]。
3 结语
茶饼病感染初期可导致茶树叶片的光合作用和蒸腾作用效率下降,并显著影响茶树氨基酸代谢、蛋白质合成及糖代谢等生物学过程。随着病原菌的进一步侵染,病斑在扩大到一定程度时就受到限制。与病原菌诱导寄主产生系统获得性抗性(SAS)机制有关,其主要机制包括:防御酶(苯丙氨酸解氨酶、过氧化物酶、抗氧化酶、β-1,3-葡聚糖酶、几丁质酶及超氧化物歧化酶等)活性增强,提升木质素含量以增强细胞壁功能,促进一些抗菌物质(黄酮类、原花青素、多酚类及萜类物质等)的生物合成,通过NO、JA及SA信号通路调控下游功能基因表达等。由于相关功能基因的鉴定与验证工作仍较缺乏,今后还需加强茶树抗茶饼病病原相关基因的筛选、鉴定和功能验证研究,为茶树抗茶饼病品种的培育提供候选基因。

