茶轮斑病病原菌Pestalotiopsis trachicarpicola 的生物学特性
张 欣,卢声洁,程宇豪,刘思睿,王坤英,赵兴丽,罗林丽,周玉锋*
(1.贵州省农业科学院 生物技术研究所,贵州 贵阳 550006; 2.贵州大学 茶学院,贵州 贵阳 550025; 3.贵州省农业科学院 茶叶研究所,贵州 贵阳 550006)
0 引言
【研究意义】茶轮斑病是茶树的一种常见病害,致使茶叶品质和产量下降,限制茶产业的发展。该病曾造成印度南部茶产业损失约17%[1],日本茶叶减产10%~20%[2]。因此,探明茶轮斑病的病原及其防治方法具有重要意义。【前人研究进展】拟盘多毛孢属(Pestalotiopsis)是植物常见的病原菌,寄主范围广泛,可引起多种植物病害,如P.Neglecta可引起樟子松黑斑病[3];P.clavispora可引起蓝莓叶斑病[4];P.versicolor和P.microspora可引起杨梅轮斑病[5];P.theae可引起茶轮斑病[6]。MAHARACHCHIKUMBURA等[7]联合ITS、β-tubulin和tef1基因对拟盘多毛孢属的分类进行修订,从中划分出新拟盘多毛孢属(Neopestalotiopsis)和假拟盘多毛孢属(Pseudopestalotiopsis)。据统计,在拟盘多毛孢属、新拟盘多毛孢属和假拟盘多毛孢属内,可以引起茶轮斑病的病原菌多达23种[8]。【研究切入点】近年来,贵州省大力发展茶产业,种植面积位居全国第一[9]。然而,随着茶树种植面积的不断扩大,在高温高湿等气候的影响下,茶轮斑病容易大面积发生。【拟解决的关键问题】鉴于此,于2020年7月从贵州省铜仁市石阡县采集茶轮斑病标本,经分离鉴定确定该病由棕榈拟盘多毛孢(P.trachicarpicola)引起,在此基础上开展该病原菌生长的最适温度、pH、培养基和碳氮源等生物学特性研究,以期为茶轮斑病防治药剂的筛选和田间综合防治措施的制定提供理论基础。
1 材料与方法
1.1 材料
1.1.1 病原菌菌株 菌株SQ-20-1于2020年7月从贵州省铜仁市石阡采集,经形态学和系统发育分析鉴定,确定该菌株为Pestalotiopsistrachicarpicola,菌株保存于贵州省农业科学院生物技术研究所。
1.1.2 试剂 蔗糖、乳糖、木糖、葡萄糖、可溶性淀粉、果糖和麦芽糖,亚硝酸钠、L-丙氨酸、蛋白胨、硝酸钾、硫酸铵和甘氨酸,盐酸和氢氧化钠,市购。
1.1.3 培养基 参照方中达[10]的方法制备马铃薯琼脂培养基(PDA)、察氏培养基、燕麦琼脂培养基(OA)、麦芽浸膏琼脂培养基(MEA)、水琼脂培养基(WA)和合成低营养琼脂培养基(SNA),灭菌后备用。
1.2 方法
1.2.1 材料预处理 菌株SQ-20-1在PDA培养基上活化培养14 d后,于菌落边缘取直径6 mm的菌饼备用。
1.2.2 不同因素对菌丝生长的影响
1) 培养基。试验设5个处理,根据培养基类型依次为PDA、OA、MEA、SNA和WA,将菌饼分别接种至各培养基中央,每个处理3次重复,于25℃下培养。
2) 碳源。试验设8个处理,以亚硝酸钠为固定氮源,不同碳源用等量的木糖、乳糖、可溶性淀粉、葡萄糖、麦芽糖和果糖代替察氏培养基(基础培养基)中的蔗糖,以不含任何碳源的培养基作为空白对照(CK)。将菌饼分别接种至不同碳源培养基平板中央,每个处理3次重复,于25℃下培养。
3) 氮源。试验设7个处理,以蔗糖为固定碳源,不同氮源用等量的L-丙氨酸、蛋白胨、硝酸钾、硫酸铵和甘氨酸代替察氏培养基(基础培养基)中的亚硝酸钠,以不含任何氮源的培养基作为空白对照(CK)。将菌饼分别接种至含有不同氮源的培养基平板中央,每个处理3次重复,于25℃下培养。
4) pH。试验设6个处理,分别用1 mol/L盐酸溶液和1 mol/L氢氧化钠溶液调节 PDA培养基pH为6、7、8、9、10、11。将菌饼分别接种至相应pH的PDA培养基中,每个处理3次重复,于25℃下培养。
5) 温度。试验设5个处理,培养温度分别为19℃、22℃、25℃、28℃和31℃。将菌饼接种至PDA培养基上,分别置于相应温度的恒温培养箱中培养,每个处理3次重复。
1.2.3 指标测定 培养7 d后,观察各处理菌株SQ-20-1的生长情况,采用十字交叉法测量其菌落直径,3次重复。
1.3 数据统计与分析
采用SPSS 19.0进行数据统计分析,并应用Duncan新复极差法检验差异显著性。
2 结果与分析
2.1 不同培养基处理菌株SQ-20-1的菌落形态及直径
2.1.1 菌落形态 从图1看出,菌株SQ-20-1在PDA、OA、MEA、SNA和WA共5种培养基上均能生长。其中,菌株SQ-20-1在PAD培养基上菌落呈乳白色,绒状,气生菌丝发达,中央菌丝淡黄色,背面中央黄褐色向边缘白色过渡;在OA培养基上气生菌丝稀疏,埋生菌丝发达,菌落白色,中央产生黑色分生孢子盘;在MEA培养基上菌落呈白色,气生菌丝发达,絮状,菌落中央整齐,其背面中央黄色向白色过渡;在WA培养基中菌落生长缓慢,无气生菌丝,仅有一层稀疏的埋生菌丝;在SNA培养基上菌落呈白色,气生菌丝絮状,菌落生长整齐,背面白色。

注:a-b,PDA培养基(正面,反面);c-d,OA培养基(正面,反面);e-f,MEA培养基(正面,反面);g-h,WA培养基(正面,反面);i-j,SNA培养基(正面,反面)。Note: a-b, PDA medium(front side, reverse side); c-d, OA medium(front side, reverse side); e-f,MEA medium(front side, reverse side); g-h, WAmedium(front side, reverse side); i-j,SNA medium(front side, reverse side).图 1 不同培养基处理菌株 SQ-20-1的菌落形态 Fig.1 Colony morphology of strain SQ-20-1 treated with different media
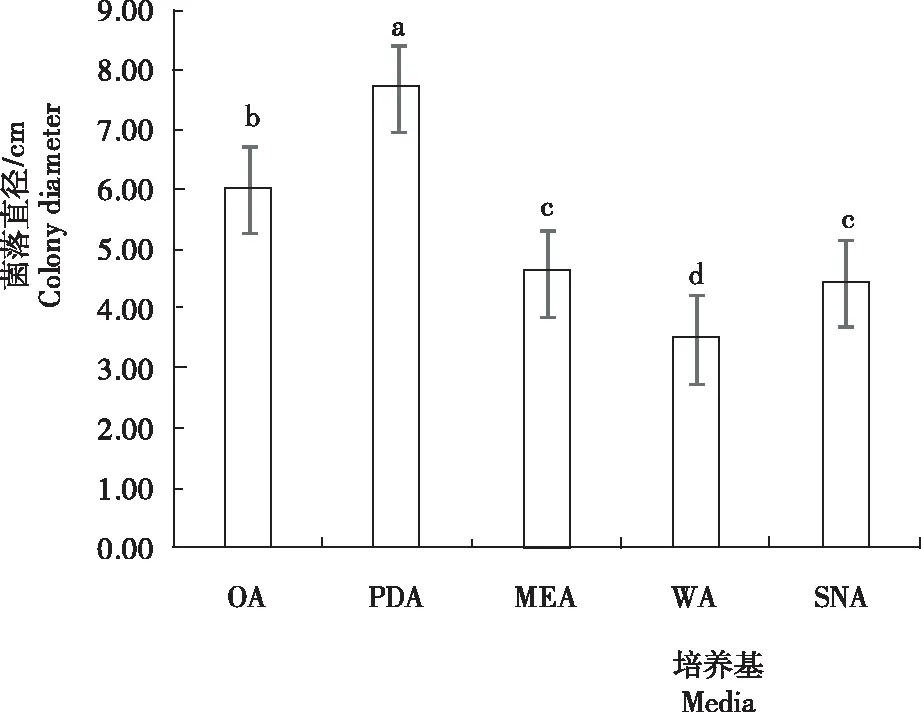
注:不同小写字母表示差异显著(P<0.05)。下同。Note: Different lowercase letters indicate significance of difference at P<0.05 level. The same below.图2 不同培养基处理菌株SQ-20-1的菌落直径Fig.2 Colony diameter of strain SQ-20-1 treated with different media
2.1.2 菌落直径 从图2看出,菌株SQ-20-1在各培养基上的菌落直径为PDA>OA>MEA>SNA>WA,其中,在PDA培养基中生长速度最快,培养7 d时菌落直径为7.70 cm,显著高于其余处理,为最适培养基;其次为OA处理,培养7 d,菌落直径为6.00 cm,与其余处理差异显著;MEA和SNA处理差异不显著,但均显著高于WA处理;WA处理相对较差,菌落直径为3.50 cm。
2.2 不同碳源处理菌株 SQ-20-1的菌落形态及生长状况
从图3和表1看出,菌株SQ-20-1在乳糖、木糖、葡萄糖、可溶性淀粉、果糖、蔗糖及麦芽糖等不同碳源培养基上均能生长,但菌落生长速度和菌丝丰度存在差异。

注:a,乳糖;b,木糖;c,葡萄糖;d,可溶性淀粉;e,果糖;f,蔗糖;g,麦芽糖; h,缺碳。Note: a, lactose; b, xylose; c, glucose; d, soluble starch; e, fructose; f, sucrose; g, maltose; h, lacking carbon.图3 不同碳源处理菌株 SQ-20-1的菌落形态Fig.3 Colony morphology of strain SQ-20-1 treated with different carbon sources
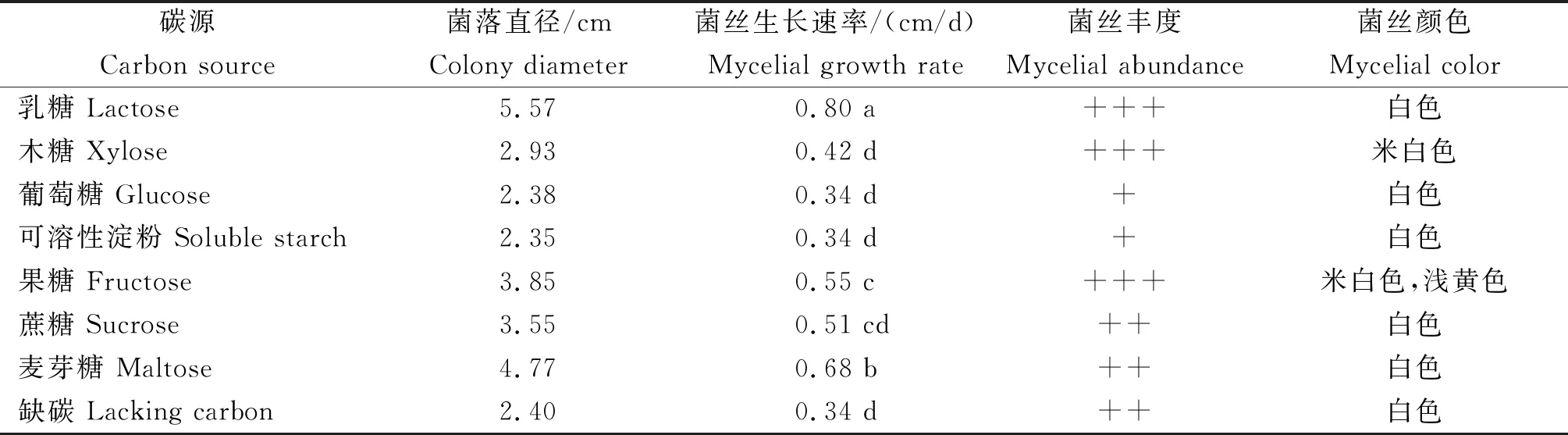
表1 不同碳源处理菌株 SQ-20-1的生长状况Table 1 Growth status of strain SQ-20-1 treated with different carbon sources
2.2.1 菌落形态 菌株SQ-20-1在果糖处理培养基上略呈浅黄色,其余处理培养基上的菌落多呈白色和米白色。果糖、木糖和乳糖处理的菌丝丰度较好。其中,果糖处理的菌落生长圆形,菌丝浓厚紧密,呈绒状;木糖处理的菌丝排列稀疏,絮状;乳糖处理的气生菌丝发达,菌落中央凹陷,边缘隆起,菌丝呈絮状。蔗糖和麦芽糖处理的菌丝丰度次之,二者菌落生长均不规则,菌丝稀疏,呈絮状。葡萄糖和可溶性淀粉处理的菌丝最为稀疏,仅有一层匍匐的气生菌丝。
2.2.2 菌株的生长 各处理菌株SQ-20-1的菌落直径和菌丝生长速率均为乳糖>麦芽糖>果糖>蔗糖>木糖>缺碳>葡萄糖>可溶性淀粉。其中,乳糖处理生长速度最快,培养7 d时菌落直径为5.57 cm,平均生长速率达0.80 cm/d,显著高于其余处理;麦芽糖、果糖和蔗糖处理生长速率次之,培养7 d时平均生长速率分别为0.68 cm/d、0.55 cm/d和0.51 cm/d,麦芽糖和果糖处理间的生长速率存在差异显著;葡萄糖和果糖处理对菌株SQ-20-1的生长影响不大,二者处理之间生长速率差异不显著。
2.3 不同氮源处理菌株 SQ-20-1的菌落形态及生长状况
从图4和表2看出,菌株SQ-20-1在以L-丙氨酸、蛋白胨、硝酸钾、硫酸铵、亚硝酸钠及甘氨酸等不同氮源培养基上生长情况存在差异。

表2 不同氮源处理菌株 SQ-20-1的生长状况 Table 2 Growth status of strain SQ-20-1 under different nitrogen sources
2.3.1 菌落形态 各处理菌株SQ-20-1的菌落均呈白色。蛋白胨和硫酸铵处理的菌丝丰度较好,呈絮状,其中,蛋白胨菌丝排列紧密,大于硫酸铵的菌丝丰度。硝酸钾、L-丙氨酸和甘氨酸处理的菌丝丰度次之,其中硝酸钾的菌丝丰度最好,菌落中央菌丝排列紧密,边缘稀疏,呈絮状。亚硝酸钠处理的菌丝丰度最差,菌落生长缓慢,仅在菌饼边缘有一层亚透明菌丝。

注:a,L-丙氨酸;b,蛋白胨;c,硝酸钾;d,硫酸铵;e,亚硝酸钠;f,甘氨酸;g,缺氮。Note: a, L-alanine; b, peptone; c, potassium nitrate; d, ammonium sulfate; e, sodium nitrite; f, glycine; g, lacking nitrogen.图4 不同氮源处理菌株 SQ-20-1的菌落形态Fig.4 Colony morphology of strain SQ-20-1 under different nitrogen sources
2.3.2 菌株的生长 各处理菌株SQ-20-1的菌落直径和生长速度均为L-丙氨酸>硫酸铵>硝酸钾>蛋白胨>甘氨酸>缺氮>亚硝酸钠。其中,菌株在L-丙氨酸为氮源的培养基上生长速度最快,培养7 d,菌落直径达7.85 cm,平均生长速度为1.12 cm/d,显著高于其他处理;其次为硝酸钾、硫酸铵、蛋白胨和甘氨酸,菌落直径分别为6.77 cm、6.82 cm、6.73 cm和6.45 cm,菌丝生长速率分别为0.97 cm/d、0.97 cm/d、0.96 cm/d和0.92 cm/d,各处理间的菌落直径和生长速率的差异不显著;菌株在以亚硝酸钠为氮源的培养基上的菌落直径和生长速度最小/慢,分别为1.73 cm和0.25 cm/d,几乎不能生长。
2.4 不同温度处理菌株 SQ-20-1的菌落直径
从图5看出,菌株SQ-20-1在19~28℃均能生长,各处理菌落直径为25℃>22℃>19℃>28℃>31℃,处理间存在明显差异。其中,最适生长温度为25℃,培养7 d菌落直径为8.5 cm,显著高于除22℃外的其余处理;其次是22℃,菌落直径为8.27 cm,与25℃差异不显著,但显著高于除19℃外的其余处理;19℃处理的菌落直径为7.87 cm,显著高于28℃和31℃。当温度>28℃时,菌丝生长明显受到抑制。

图5 不同温度处理菌株 SQ-20-1的菌落直径Fig.5 Colony diameter of strain SQ-20-1 treated with different temperatures
2.5 不同 pH处理菌株 SQ-20-1的菌落直径
从图6看出,菌株SQ-20-1在pH 6~11均能生长,各处理菌落直径随pH增大呈下降趋势,即pH 6>pH 7>pH 8>pH 9>pH 10>pH 11,处理间存在差异。其中,适宜生长的pH为6~7。pH 6时,菌落生长速度最快,培养7 d菌落直径为6.97 cm,显著高于除pH 8和pH 9外的其余处理;pH 7和pH 8时,菌落生长速度其次,菌落直径分别为6.88 cm和6.57 cm,二者显著高于pH 9~11;pH 9时,培养7 d菌落直径为6.4 cm,与pH 10、pH 11(菌落直径均为6.22 cm)差异不显著。当pH≥9时,随pH的增高,菌落直径趋于稳定。

图6 不同pH处理菌株 SQ-20-1的菌落直径Fig.6 Colony diameter of strain SQ-20-1 treated with different pH
3 讨论
棕榈拟盘多毛孢(P.trachicarpicola)寄主范围广泛,可引起多种植物病害,如蓝莓叶斑病[11]、黄精褐斑病[12]、松树枝枯病[13]和茶树轮斑病[14]。已有文献报道P.trachicarpicola的体外生物学特性,但是,P.trachicarpicola作为引起茶轮斑病的病原菌,其生物学特性的研究尚未见报道。刘思睿等[12]研究发现,棕榈拟盘多毛孢是引起贵州省黄精褐斑病的病原菌,其菌株HGUP17281在PDA培养基上菌丝生长速度最好,其生长最适温度为28℃,最适pH为5,在以葡萄糖为碳源、酵母浸膏为氮源的培养基中生长速度最快。
4 结论
研究结果表明,菌株SQ-20-1在温度为25℃,pH为6,以乳糖为碳源,L-丙氨酸为氮源的培养基中菌丝生长最佳。说明,从不同植物上分离得到的同一种菌株,其体外生物学特性也存在明显差异,此差异与植物寄主、温度和海拔有关。该研究从温度、pH、培养基和碳氮源营养元素等方面探讨茶轮斑病病原菌P.trachicarpicola的体外生物学特性,可为今后茶轮斑病防治药剂的筛选和田间防控措施的制定提供理论基础。

