miR-760靶向FOXC2抑制肝癌细胞HCC-9204迁移、侵袭和EMT的分子机制
李科 肖劲军 曹永清
(长沙市第一医院肿瘤科,湖南 长沙 410005)
肝癌具有恶性程度高、易转移等特点,肝癌转移是肝癌患者死亡的重要诱因〔1〕。肝癌细胞侵袭、迁移和上皮间质转化(EMT)是肝癌转移的关键,靶向抑制肝癌细胞转移潜能对于提高肝癌患者生活质量具有重要意义〔2〕。miRNA是目前研究较多的与正常生命活动和疾病发生有关的非编码RNA,其可以通过靶向调控下游靶基因的表达发挥生物学作用〔3〕。研究显示,肿瘤发生与肿瘤组织中miRNA异常表达有关,这些miRNA可以作为肿瘤分子标志物,通过干扰或重建肿瘤相关miRNA可能是肿瘤治疗的潜在途径〔4〕。miR-760是目前发现的与肿瘤有关的miRNA,miR-760异常表达下调与胃癌进展有关,miR-760可以体外抑制胃癌细胞侵袭能力,后续在乳腺癌等肿瘤中也发现miR-760表达缺失与肿瘤恶性转移有关〔5,6〕。研究表明,miR-760在肝癌中表达下调,并且miR-760表达水平的高低还与肝癌细胞阿霉素抵抗有关〔7〕。本实验旨在研究miR-760对肝癌细胞侵袭、迁移和EMT的影响和调控机制,为明确miR-760在肝癌转移中的作用提供参考,为靶向基因治疗肝癌提供新思路。
1 材料与方法
1.1材料 人肝癌细胞HCC-9204、SNU-449、HuH-7和人正常肝细胞HL-7702购自上海中科院细胞库;叉头框(FOX)C2抗体购自美国Santa Cruz Biotechnology;引物由南京金斯瑞生物科技有限公司合成;miR-760 mimics、mimics control均由上海吉玛制药技术有限公司合成;钙黏蛋白E(E-cadherin)抗体购自美国Abcam;突变型(WT)和野生型(MUT)荧光素酶报告载体由汉恒生物科技(上海)有限公司构建;波形蛋白(vimentin)抗体购自美国Cell Signaling Technology。
1.2qRT-PCR测定miR-760在肝癌细胞中的表达 收集人肝癌细胞HCC-9204、SNU-449、HuH-7和人正常肝细胞HL-7702,在细胞培养瓶中加Trizol,每105个细胞中添加1 ml的Trizol,提取细胞总RNA。以特异性的颈环引物进行逆转录反应,逆转录反应在冰上进行,逆转录反应体系为:2 μl的5×PrimeScript缓冲液、0.5 μl的RNA、0.5 μl的PrimeScript Buffer、0.5 μl的微小RNA引物(miRNA primer),添加无RNA酶的蒸馏水(RNAse Free dH2O)至10 μl,逆转录条件为:42℃孵育15 min;85℃孵育5 min,4℃保存。qRT-PCR引物序列如下:内参U6-正义链5′-CTCGCTTCGGCACATA-3′,U6-反义链5′-CGAATTTGCGTGTCATCCT-3′;miR-760-正义链5′-GTCGAGCGGCTCTGGGTCTGTG-3′,miR-760-反义链5′-TCCAGTGGAGGGTCCGGAGGT-3′。qRT-PCR体系为:10 μl的SYBR Premix Ex Taq、0.8 μl的上下游引物、0.4 μl的ROX Reference、2.0 μl的cDNA,添加dH2O至20 μl。qRT-PCR条件为:95℃变性5 s;60℃退火30 s;72℃延伸30 s,共40个循环。根据PCR产生的Ct值,采用2-△△Ct法计算miR-760表达水平。
1.3细胞转染 将miR-760模拟物(mimics)、mimics control分别转染至人肝癌细胞HCC-9204中,记为miR-760、miR-NC组,将没有转染的人肝癌细胞HCC-9204记为Control组,细胞转染操作完全按照Lipofectamine 2000转染试剂说明进行。细胞转染后24 h,按照1.2中qRT-PCR方法测定上调效果。
1.3.1MTT测定细胞增殖 将人肝癌细胞HCC-9204按照Control、miR-NC、miR-760分组方法种植到96孔板,每个孔中接种4×103个细胞,放在37℃的培养箱中培养24 h以后,将培养板取出,然后在每个孔中添加15 μl的MTT工作液,继续培养4 h。把孔中的液体吸除,分别添加150 μl的二甲基亚砜(DMSO)溶液,孵育反应10 min。将酶标仪波长调整到570 nm,检测每个孔的OD值。
1.3.2Transwell小室测定侵袭和迁移 细胞迁移实验:将人肝癌细胞HCC-9204按照Control、miR-NC、miR-760分组方法悬浮在不含血清的细胞培养液中,吸取200 μl添加到Transwell小室的上室中,在下室中添加600 μl的含血清细胞培养液,放在培养箱中培养24 h以后,取出小室,以70%的乙醇固定,0.1%的结晶紫染色以后,磷酸盐缓冲液(PBS)洗涤3次,在光学显微镜下观察细胞迁移数目。细胞侵袭实验前在小室中添加基质胶湿化,其余步骤同上。
1.3.3Western印迹检测E-cadherin、vimentin蛋白表达 取Control、miR-NC、miR-760细胞,添加RIPA蛋白抽提试剂,放在冰上裂解30 min,收集裂解液,在4℃高速离心。将蛋白上清分装并保存在-80℃。把电泳槽清洗干净,配制十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)凝胶。把蛋白样品与5×上样缓冲液(Loading Buffer)混合煮沸5 min,然后放在-80℃保存。每孔上样孔内加入30 μg蛋白,电泳电压设置为100 V,等到溴酚蓝进入到凝胶的底部以后,停止电泳。将聚偏氟乙烯(PVDF)膜裁剪成凝胶大小,以200 mA恒流转膜,转膜操作在冰上进行。把PVDF膜放在封闭液中将非特异性结合位点封闭以后,再依次放在一抗、二抗反应液中,在室温条件下结合1.5 h。一抗和二抗均用封闭液稀释,一抗稀释倍数为1∶800,二抗稀释倍数为1∶2 000。电化学发光(ECL)显色。内参为β-actin。分析条带的灰度值,计算蛋白表达水平。
1.4miR-760靶基因预测和鉴定 在线靶基因预测软件targetscan发现miR-760与FOXC2的3′UTR端有互补结合位点,用荧光素酶报告系统鉴定靶向关系。分别将FOXC2 WT和MUT荧光素酶报告载体同miR-760 mimics、mimics control共转染到肝癌细胞中,培养24 h以后,用荧光素酶活性测定试剂盒检测细胞荧光素酶活性。用Western印迹法检测Control、miR-NC、miR-760组细胞中FOXC2蛋白表达水平,步骤同上。
1.5pcDNA3.1-FOXC2对上调miR-760影响肝癌细胞增殖、侵袭、迁移和EMT的作用 人肝癌细胞HCC-9204中分别共转染miR-760 mimics、pcDNA3.1和miR-760 mimics、pcDNA3.1-FOXC2,记为miR-760+pcDNA3.1、miR-760+pcDNA3.1-FOXC2组,转染后24 h,MTT检测细胞增殖,Transwell小室测定细胞侵袭和迁移,Western印迹检测E-cadherin、vimentin蛋白表达,步骤同上。
1.6统计学分析 采用SPSS21.0软件进行t检验、单因素方差、SNK-q检验。
2 结 果
2.1miR-760在肝癌细胞中表达下调 人肝癌细胞HCC-9204(0.28±0.04)、SNU-449(0.65±0.08)、HuH-7(0.45±0.05)中miR-760表达水平明显低于人正常肝细胞HL-7702(1.00±0.12;F=46.153,P=0.000)。miR-760在肝癌细胞中表达下调。人肝癌细胞HCC-9204中miR-760表达水平最低,选择人肝癌细胞HCC-9204做后续研究。
2.2miR-760 mimics对肝癌细胞增殖、侵袭、迁移和EMT影响 肝癌细胞转染miR-760 mimics后,细胞中miR-760表达水平升高,细胞OD值降低,细胞迁移及侵袭数目下降,vimentin表达水平降低,E-cadherin表达水平升高,差异均有统计学意义(P<0.05)(图1和表1)。miR-760 mimics抑制肝癌细胞增殖、侵袭、迁移和EMT。

图1 Western印迹检测miR-760 mimics转染后肝癌细胞中E-cadherin、vimentin蛋白表达
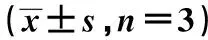
表1 miR-760 mimics转染后肝癌细胞中miR-760水平、OD值、迁移数目、侵袭数目及E-cadherin、vimentin、FOXC2蛋白水平比较
2.3miR-760靶向调控FOXC2 在线靶基因预测软件发现 miR-760与FOXC2的3′UTR端有互补结合位点,荧光素酶报告系统鉴定结果发现miR-760靶向调控FOXC2表达。见图2和表2。

图2 miR-760与FOXC2的3′UTR端结合位点
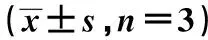
表2 荧光素酶活性
2.4上调miR-760对肝癌细胞中FOXC2表达影响 肝癌细胞转染miR-760 mimics后,细胞中FOXC2蛋白表达水平下降(表1和图3)。上调miR-760抑制肝癌细胞中FOXC2蛋白表达。
2.5pcDNA3.1-FOXC2逆转上调miR-760对肝癌细胞增殖、侵袭、迁移和EMT影响 肝癌细胞共转染miR-760 mimics和pcDNA3.1-FOXC2后,细胞OD值升高,迁移、侵袭数目增加,E-cadherin蛋白表达减少,vimentin蛋白表达增多(图4和表3)。pcDNA3.1-FOXC2逆转上调miR-760对肝癌细胞增殖、侵袭、迁移和EMT影响。

图3 Western印迹检测miR-760 mimics转染后肝癌细胞中FOXC2蛋白表达

图4 Western印迹检测miR-760 mimics和pcDNA3.1-FOXC2转染后肝癌细胞中FOXC2、E-cadherin、vimentin蛋白表达变化
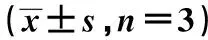
表3 miR-760 mimics转染后肝癌细胞OD值、迁移数目、侵袭数目及FOXC2、E-cadherin、vimentin蛋白水平
3 讨 论
本实验发现,miR-760在肝癌细胞中的表达水平低于正常肝细胞,并且上调miR-760可以降低肝癌细胞增殖和侵袭迁移能力,提示miR-760在肝癌恶性进展和转移中可能发挥抑制作用。miRNA是在人体组织中广泛存在的非编码RNA,其没有编码蛋白质的功能,可以通过与靶基因结合影响蛋白表达,从而发挥多种生物学作用〔8〕。miRNA不仅参与能量代谢、细胞生长、组织修复等生理过程,还与人类的多种疾病如动脉粥样硬化、脑损伤有关〔9,10〕。研究显示,miRNA与肿瘤关系密切,miRNA异常表达和调控功能可能是肿瘤转移和恶性进展的基础〔11〕。miR-760是一个肿瘤调控因子,其表达水平的高低与肿瘤的预后、转移等有关〔12〕。在结直肠癌、肺癌、乳腺癌等肿瘤中的研究显示,miR-760发挥类似抑癌基因的作用,其可以抑制肿瘤细胞恶性生长和侵袭〔6,13,14〕。报道显示,miR-760在肝癌中表达下调,miR-760可以促进阿霉素诱导的肝癌细胞凋亡〔7〕。本实验结果与上述研究相一致,证明miR-760在肿瘤中可能发挥抑癌基因的作用,并进一步证实miR-760具有体外抑制肝癌细胞转移潜能的作用。
肿瘤细胞侵袭、迁移及恶性增殖是肿瘤转移的重要原因,而肿瘤细胞EMT是肿瘤转移的早期标志〔15〕。EMT是上皮特征逐渐消失并逐渐表现出间质特征的过程,其在胚胎发育、组织修复过程中发挥重要作用〔16〕。E-cadherin是上皮细胞标志蛋白,vimentin是间质细胞标志蛋白,E-cadherin、vimentin表达改变是细胞EMT发生的标志〔17〕。本研究表明,上调miR-760后的肝癌细胞中E-cadherin表达水平升高而vimentin表达水平降低,提示上调miR-760可以抑制肝癌细胞EMT,这与细胞侵袭和迁移检测结果一致,说明上调miR-760可以抑制肝癌细胞转移潜能。
本实验还发现,miR-760靶向负调控肝癌细胞中FOXC2表达,miR-760作用机制可能与FOXC2有关。FOXC2又名MHF1,其是在人体组织中广泛表达的转录因子,FOXC2与脂肪代谢、胰岛素抵抗有关,参与肥胖、糖尿病等疾病发生〔18,19〕。FOXC2还是一个与肿瘤有关的重要调控因子,参与肿瘤血管形成、恶性生长和转移〔20〕。过表达FOXC2诱导肿瘤细胞EMT和侵袭,靶向下调FOXC2抑制肿瘤细胞恶性生物学行为〔21,22〕。本研究结果显示,上调FOXC2可以逆转miR-760对肝癌细胞增殖、侵袭、迁移和EMT的抑制作用,这充分证实miR-760参与肝癌进展与靶向调控FOXC2有关。
综上,miR-760在肝癌转移和恶性进程中发挥类似抑癌基因的作用,miR-760在肝癌细胞中表达下调,miR-760具有抑制肝癌细胞增殖、侵袭、迁移和EMT的作用,作用机制与靶向负调控FOXC2有关。在以后的实验中会继续在多株肝癌细胞和体内进行验证。本实验结果为阐明miR-760在肿瘤进展中的作用机制提供了基础,为寻找有效的肿瘤分子标记物提供了新方向。

