大鼠死后肌肉总腺苷酸及腺苷酸能荷的时序性变化
朱伟豪,郑哲,孙凯,杨梦姿,钱茂升,莫耀南
1.河南科技大学法医学院,河南 洛阳471003;2.重庆医科大学基础医学院法医学系,重庆400016
死亡时间(postmortem interval,PMI)研究已有几百年的历史,但PMI 推断的准确性并没有显著提高,实践中仍缺乏一种简便、客观、准确的推断方法[1-2]。此外,随着晚期PMI 区间的增大,推断误差也随之增大,造成晚期PMI 推断更加困难[3]。近年来,利用动物或人体尸体腐败过程中产生的代谢产物含量变化来推断PMI 成为法医学中的新兴领域,这种死后生物化学变化具有明显时序性规律[3-4]。
机体生前通过腺苷酸[三磷酸腺苷(adenosine triphosphate,ATP),二磷酸腺苷(adenosine diphosphate,ADP),一磷酸腺苷(adenosine monophosphate,AMP)]激酶反应(2ADP↔ATP+AMP),保持着细胞内总腺苷酸(total adenine nucleotide,TAN)(由ATP、ADP、AMP组成)处于相对稳定平衡的状态。死后组织间供氧停止,伴随糖原酵解的停止及磷酸肌酸的耗尽,TAN 的相对稳定平衡状态也被打破。同一时间内,ATP 在三磷酸腺苷酶的作用下逐渐降解为ADP,在肌激酶的作用下,进一步分解成AMP。AMP 又在腺苷酸脱氨酶、磷酸单酯酶及核苷水解酶等酶的作用下逐渐降解为肌苷、次黄嘌呤及核糖等物质[5-6],该过程中各代谢物含量呈现出明显的时序性变化规律[7-10]。同时,前期研究结果[7-8,11-12]也证明,死后血液组织内ATP、ADP 或AMP 含量变化规律可用于PMI 推断,但这些研究仅单一阐述不同时间内(多局限于72 h 内)各嘌呤腺苷酸的含量变化,并未对整体嘌呤腺苷酸系统的含量和能量状态进行探究。腺苷酸能荷(adenylic-acid energy charge,AEC)是细胞中能量合成反应和利用反应的重要调节因素,代表腺苷酸系统的能量状态,在死后一段时间内,呈现出规律性变化[13]。因此,本研究旨在进一步探究大鼠死亡晚期后腿肌肉TAN 和AEC 的时序性变化,从而为法医学PMI推断提供一定的研究基础。
1 材料与方法
1.1 主要仪器与试剂
Agilent 1100 高效液相色谱仪(美国Agilent 公司);ZORBAX SB-Aq 色谱柱(美国Agilent 公司);紫外检测器(美国Agilent 公司);TDZ5-WS 台式低速自动平衡离心机(湖南湘仪实验室仪器开发有限公司);JJ-2 组织捣碎机(江苏省金坛市宏华仪器厂);FE28-Bio pH 计[梅特勒-托利多仪器(上海)有限公司];GE2005-5 电子天平(上海佑科仪器仪表有限公司);Milli-Q 超纯水机(美国Millipore 公司);5-腺苷三磷酸二钠盐标准品(5’-ATP-Na2)、5-腺苷二磷酸二钠盐标准品(5’-ADP-Na2)、5-腺苷一磷酸二钠盐标准品(5’-AMP-Na2)(高效液相色谱级≥98%,上海源叶生物科技有限公司);甲醇(色谱纯);磷酸二氢钠、磷酸氢二钠、高氯酸、氢氧化钠(国产分析纯)。
1.2 动物分组、处理与保存
健康SD 雄性大鼠40 只(由河南科技大学动物实验中心提供并通过动物伦理委员会批准),体质量(250±20)g,随机分成8 组,每组5 只,在同一时间采用颈椎脱臼处死,保存在20 ℃恒温环境中。分别于死后0、24、48、72、96、120、144、168 h 提取1 组大鼠双后肢肌肉用于制备上样液。
1.3 加标回收率的验证
取死后48 h 大鼠骨骼肌上样液4 份,每份50 μL,分别加入超纯水,ATP、ADP 和AMP 标准液(3 种物质质量浓度均为100 μg/mL)各50 μL。对溶液进行液相色谱分析,每份样品平行测定5 次。以加超纯水组内3 种物质浓度为加标前的浓度,依据加标前后3 种物质浓度变化与加标量的百分比,计算加标回收率。
1.4 双后肢肌肉上样液制备与测定
参照王述柏[14]的ATP 相关代谢产物的测定方法。准确称量大鼠双后肢肌肉5 g 移入组织匀浆机内,加入预冷的5%高氯酸溶液25 mL,高速(10 000 r/min)匀浆3 min,pH 值调为7.0 左右,加预冷的去离子水定容至50 mL 后,经3 层纱布过滤,滤液以离心半径6 cm,4 500 r/min,离心10 min,上清液再经孔径为0.22 μm的针式滤膜滤过后,完成上样液的制备,待高效液相色谱仪(high performance liquid chromatography,HPLC)测定。
色谱条件:ZORBAX SB-Aq 色谱柱(4.6 mm×150 mm,5 μm),柱温35 ℃,流速0.8 mL/min,进样体积8 μL。紫外检测器,波长为254 nm,流动相为0.05 mol/L 磷酸缓冲液(V磷酸氢二钠∶V磷酸二氢钠=49∶51)和甲醇以95∶5(体积比)混合,等度洗脱。
1.5 数据处理及分析
TAN 和AEC 的计算遵循以下公式[13]:
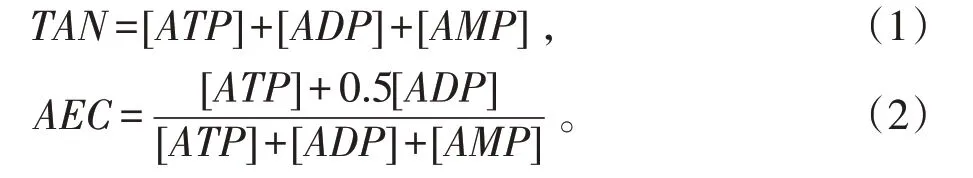
数据经OriginPro 2019b 软件(美国OriginLab 公司)整理分析,结果以表示。以PMI 为自变量,分别以ATP、ADP、AMP、TAN 和AEC 为因变量进行单因素ANOVA 分析和重复测量方差分析,检验水准α=0.05。再以PMI 为因变量(y),ATP、ADP、AMP、TAN和AEC 为自变量(x),分别建立一次、二次、三次回归方程,以决定系数R2值最高者为最佳拟合方程,拟合关系评价标准以R2≥0.8 为佳,R2<0.8 为不佳。
2 结 果
2.1 大鼠双后肢肌肉的加标回收率
大鼠双后肢肌肉中ATP、ADP 和AMP 的加标回收率分别为92.596%、96.872%、91.661%。
2.2 大鼠死后双后肢肌肉中ATP、ADP、AMP、TAN、AEC与PMI的关系
大鼠死后双后肢肌肉中ATP、ADP、AMP、TAN 和AEC 的变化结果如表1 所示,大鼠死后168 h 内,双后肢肌肉内ATP、ADP、AMP、TAN 和AEC 随PMI 的变化各不相同。在死后不同时间内,ATP、ADP 含量差异均无统计学意义(P>0.05),AMP、TAN 和AEC 差异均有统计学意义(P<0.05)。重复测量方差分析结果(表1)显示,AMP 的72、96 h 组和AEC 的48、72、96、120 h 组与其上组数据比较,差异有统计学意义(P<0.05)。
从拟合的回归方程(表2)可见,大鼠死后双后肢肌肉内ATP、ADP、AMP、TAN 与PMI 拟合关系不佳(R2为0.198~0.754);AEC 随PMI 呈现出逐渐下降的变化规律,R2为0.903,曲线拟合关系较好。
表1 大鼠死后双后肢肌肉中ATP、ADP、AMP、TAN及AEC变化Tab. 1 Changes of ATP,ADP,AMP,TAN,and AEC in the both hind limbs muscles of rats after death(n=5,)
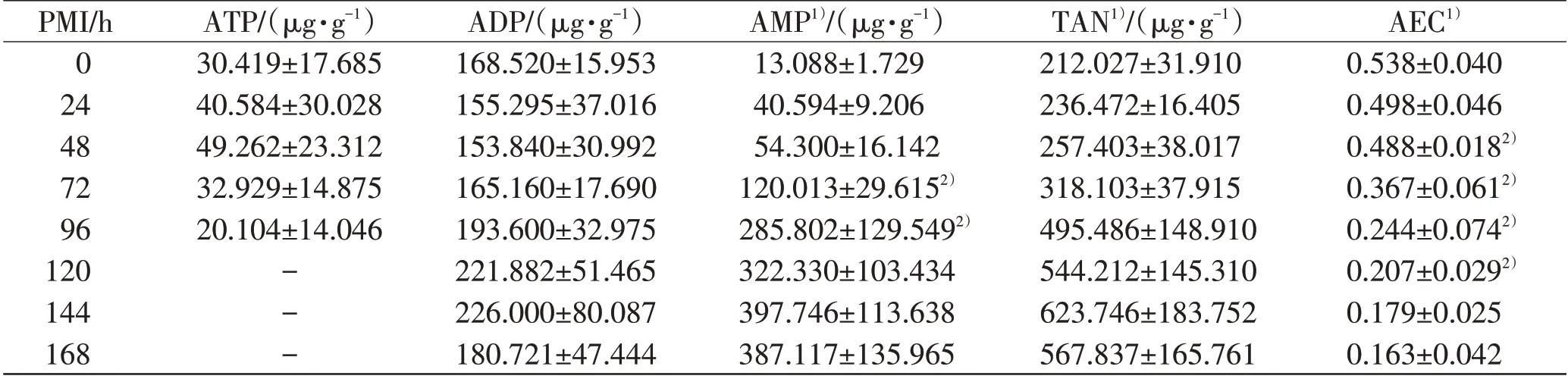
表1 大鼠死后双后肢肌肉中ATP、ADP、AMP、TAN及AEC变化Tab. 1 Changes of ATP,ADP,AMP,TAN,and AEC in the both hind limbs muscles of rats after death(n=5,)
注:1)单因素ANOVA分析,P<0.05;2)与相邻上组相比,P<0.05。“-”表示该物质含量低于检测范围。PMI表示死亡时间;ATP表示三磷酸腺苷;ADP表示二磷酸腺苷;AMP表示一磷酸腺苷;TAN表示总腺苷酸;AEC表示腺苷酸能荷。
PMI/h 0 24 48 72 96 120 144 168 ATP/(μg·g-1)30.419±17.685 40.584±30.028 49.262±23.312 32.929±14.875 20.104±14.046---ADP/(μg·g-1)168.520±15.953 155.295±37.016 153.840±30.992 165.160±17.690 193.600±32.975 221.882±51.465 226.000±80.087 180.721±47.444 AMP1)/(μg·g-1)13.088±1.729 40.594±9.206 54.300±16.142 120.013±29.6152)285.802±129.5492)322.330±103.434 397.746±113.638 387.117±135.965 TAN1)/(μg·g-1)212.027±31.910 236.472±16.405 257.403±38.017 318.103±37.915 495.486±148.910 544.212±145.310 623.746±183.752 567.837±165.761 AEC1)0.538±0.040 0.498±0.046 0.488±0.0182)0.367±0.0612)0.244±0.0742)0.207±0.0292)0.179±0.025 0.163±0.042

表2 大鼠双后肢肌肉中ATP、ADP、AMP、TAN、AEC与PMI拟合方程Tab. 2 Fitting equations of ATP,ADP,AMP,TAN,AEC and PMI in the both hind limbs muscles of rats
3 讨 论
1968 年,ATKINSON 教授首次提出“腺苷酸能荷”的概念,用于代表嘌呤腺苷酸系统的能量状态。理论上AEC 值在0~1,如细胞内嘌呤腺苷酸组成均为ATP,则能荷为1;均是ADP,能荷为0.5;均是AMP,则能荷为0。机体一般通过正负反馈调节,使活细胞的AEC稳定在0.75~0.95[13]。本研究以TAN 和AEC 为指标,探索大鼠死后双后肢肌肉内TAN 和能量状态的时序性变化规律。结果显示,死后48 h 内,ATP 和AMP 与ADP呈现出相反的变化趋势。大鼠死后组织内残余酶持续催化嘌呤腺苷酸激酶反应,通过调节,保持细胞内TAN 相对稳定平衡,这与相关文献的研究结果[6,15]一致。48~96h内,AMP含量增加,可能是由于随着TAN平衡状态的打破,ATP 的降解速率增快,在三磷酸腺苷酶的作用下逐渐降解为ADP,由于底物ADP 的增加,进一步促进了AMP 的增加[6]。96 h 后,ATP 消耗殆尽,ADP 的合成速率减慢,并于144 h 后开始减少。由于ADP 含量较高,AMP 含量持续增加,导致大鼠死后168 h 内,AEC 数值持续逐渐减小。结果表明,大鼠死后双后肢肌肉的嘌呤腺苷酸系统能量状态逐渐下降。大鼠死后双后肢肌肉内TAN 变化趋势与AMP 相似,死后144 h 内持续增加,可能因为前期不断有外源性核苷酸补充嘌呤腺苷酸系统[16]。144 h 后,外源性核苷酸补充停止,TAN 降解速率增快,导致其含量开始下降。单因素ANOVA 分析发现,大鼠在不同PMI 内,ATP、ADP 含量差异均无统计学意义,但AMP、TAN 和AEC 差异有统计学意义。拟合方程显示,大鼠死后双后肢肌肉内ATP、ADP、AMP、TAN 与PMI 拟合关系不佳(R2为0.198~0.754);AEC 随PMI 变化规律明显,决定系数较高(R2为0.903),曲线拟合关系较好。
本研究初步探究了大鼠死后双后肢肌肉内ATP、ADP、AMP、TAN 和AEC 随PMI 的变化规律,为法医学PMI 的推断提供了新的研究思路。另外,随着电化学生物传感器技术的不断发展,无需再使用HPLC 等大型实验室仪器分离,即可轻松测定各类嘌呤腺苷酸[17-19],使TAN 及AEC 测定更适用于法医学实践。由于死后腐败过程受各类因素的影响,联合多因素推断PMI,以及开发简便高效测定嘌呤腺苷酸含量及能荷的电化学生物传感器是下一步的研究方向。

