原发于结肠的梭形细胞瘤病理及基因突变特点(附1例分析)
刘芮菡,赵娜 ,薛金慧,王宁,赵志华,张全武
1 郑州大学附属郑州中心医院,河南郑州450007;2 郑州大学第一附属医院
梭形细胞肿瘤发病率较低,主要是以梭形细胞为主的一种肿瘤,可发生在人体软组织、骨及空腔脏器[1-2]。人体各类肿瘤均可以表现为梭形细胞的形态,如低分化的上皮源性肿瘤、胃肠道间质瘤、间叶源性肿瘤、神经源性肿瘤。以梭形细胞为特征的肿瘤可以发生在人体任何部位,目前临床对于梭形细胞瘤的分类尚不明确。共表达S-100 及CD34 的梭形细胞肿瘤是一种罕见的梭形细胞瘤,目前WHO并未把共表达S-100 及CD34 的梭形细胞肿瘤纳入,该类肿瘤的治疗方法及预后均有待于进一步深入研究。TRK 融合的各种恶性肿瘤对高选择性小分子TRK 抑制剂Larotrectinib 敏感,因此对于无法切除、或复发和/或转移性疾病的病例可能受益于神经营养性酪氨酸受体激酶(NTRK)靶向药物的治疗。目前我国尚无在结肠发生的共表达CD34 及S-100 的梭形细胞肿瘤相关报告。2020年7月,我们收治了1例原发于结肠的梭型细胞肿瘤患者,现总结原发结肠的瘤梭形细胞肿瘤的病理特点、基因突变情况。
1 资料与方法
1.1 临床资料 患者,女,年龄 17 岁,2020 年 4 月因“无明显诱因突发出现腹部疼痛不适2 h”于郑州市中心医院就诊,查体可见全腹软,无反跳痛及肌紧张,左下腹可触及大小约6 cm×5 cm 包块,质韧,活动度可,压痛。腹部增强CT 显示:结肠远端见团片状明显强化影,最大截面约55 mm×34 mm。临床诊断为结肠占位。行“腹腔镜辅助下根治性横结肠肿瘤切除术+阑尾切除术+小肠减压术”,术中见肿物位于横结肠近脾区,未侵及外膜,与周围组织界限不清,灰白色,质地中韧,切除肿瘤最大径8 cm。术后至今随访近5个月未见复发。
1.2 病理及免疫组化观察 术中取肿瘤组织,标本采用4%中性甲醛固定24-48h,固定充分组织行常规脱水及石蜡包埋,4 μm 连续切片,常规HE染色及免疫组织化染色,免疫组化抗体购自福州迈新公司,操作程序均按其说明书进行。HE及免疫组化染色均由3名主治以上病理医生镜下观察瘤组织病理变化。
1.3 基因检测方法 取瘤组织进行NTRK 基因双侧分离探针荧光原位杂交(FISH)检测基因突变,所有操作均按说明书进行。判读结果在荧光显微镜下进行观察,在每个检测样品与每个探针都要采集20个不同区域。每个区域中的细胞不少于100 个,然后再进行平均,获得出检测探针对于待检测样品的杂交结果。荧光显微镜下观察显示,荧光显微镜下观察到红、绿分离信号(黄色为融合信号),并且这种细胞核所占比例超过20%,提示NTRK基因重排呈阳性。
2 结果
2.1 瘤组织病理特点 组织学低倍镜下可见肿瘤细胞侵及黏膜至浆膜层,无包膜,界不清(见图1AB),呈片状或束状排列(图1D),血管壁及间质可见玻璃样变性(图1ACD),瘤细胞有疏松区及致密区,局部水肿(图1CD);高倍镜下可见瘤细胞呈短梭形或卵圆形,胞质丰富弱嗜碱性,细胞核呈多边形或椭圆形,可见核仁及核异型性(图1GH)。可见组织坏死及钙化灶,偶见细胞核分裂。
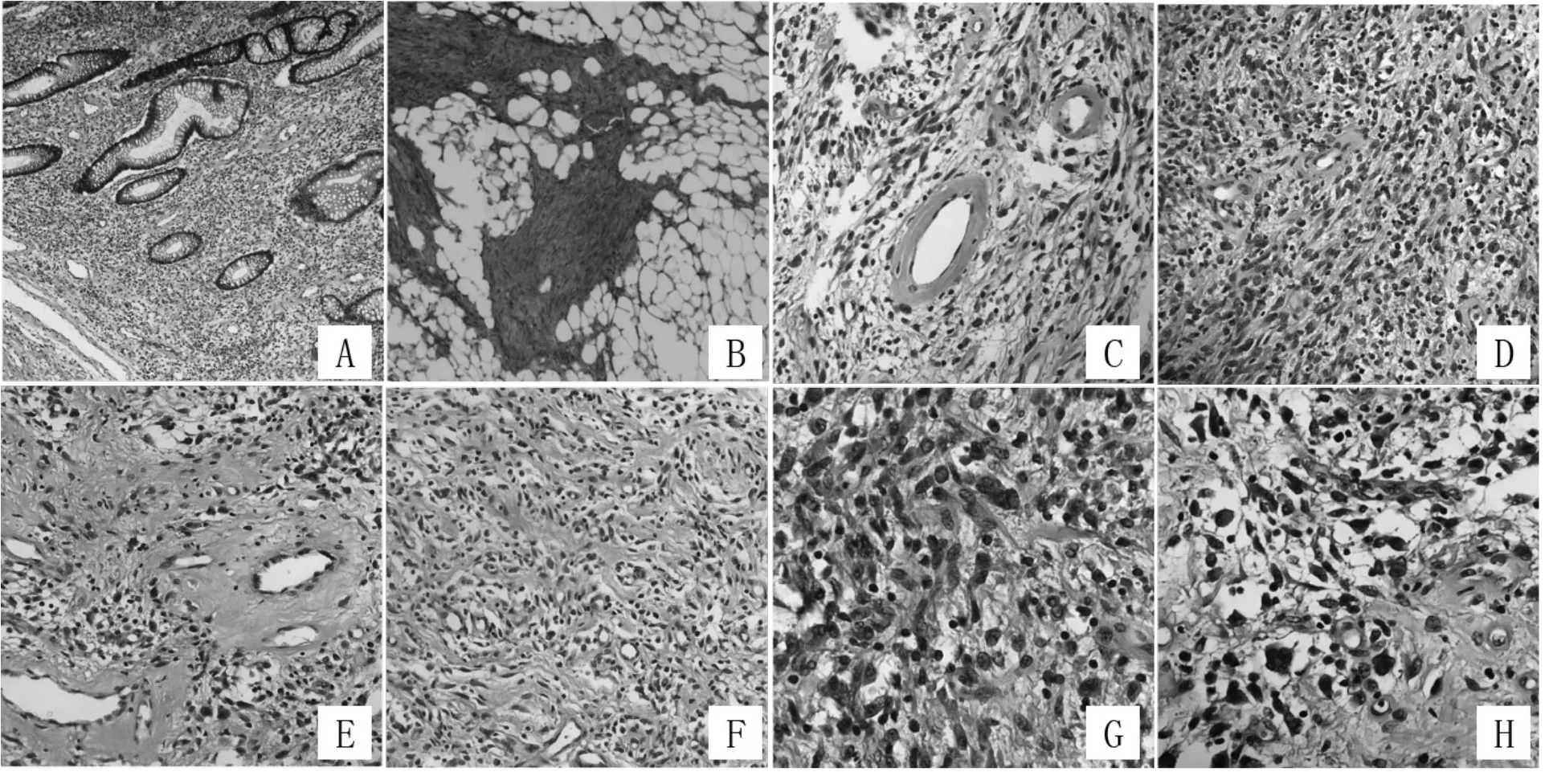
图1 梭形细胞瘤的组织学和免疫组织化学图像
另取肿瘤组织蜡块常规切片,检测S-100、CD34、Vimentin、AE1/AE3、SMA、Desmin、Caldesmon、SOX-10、CD117、Dog-1、BCL-2、CD99、STAT6、CR、D2-40、HMB45、CD56、SYN、CGA、ALK 和 Ki-67(MIB1)免疫组织化学标记。实验所用抗体均购自福州迈新生物技术开发有限公司,二抗购自Roche公司,免疫组化染色采用Roche Benchmark XT 全自动免疫组化染色仪进行,所有操作严格遵照说明书及仪器操作规程进行,设置阴阳性对照。瘤组织Vimentin、S-100、CD34 表达阳性(图 2AB),SOX-10 表达阴性(图2C),Ki-67 表达低(约5%),AE1/AE3、SMA、Desmin、Caldesmon、CD117、Dog-1、BCL-2、CD99、STAT6、CR、D2-40、HMB45、CD56、SYN、CGA、ALK表达均为阴性。
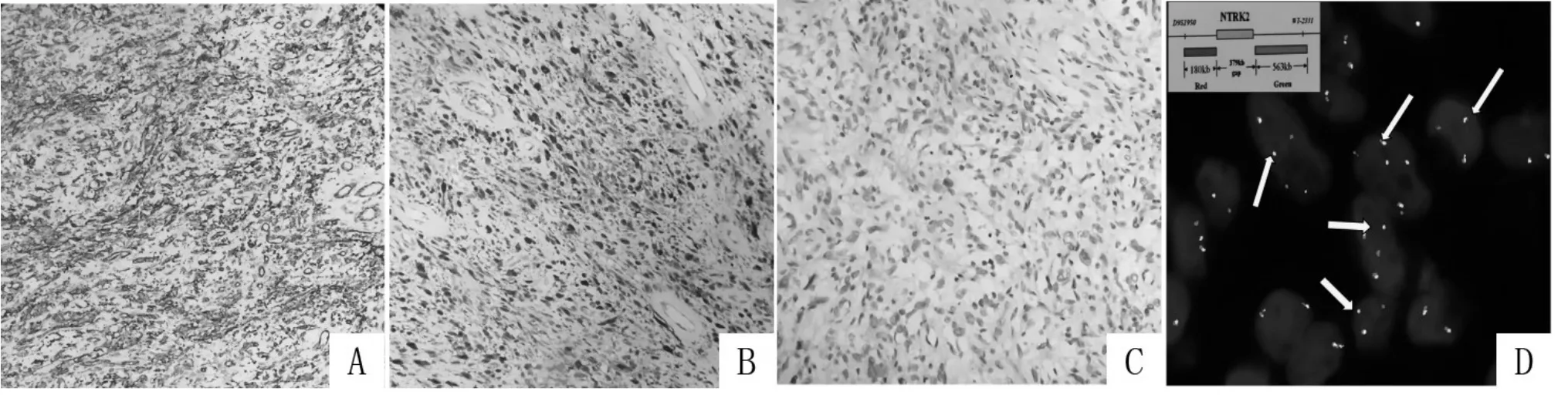
图2 梭形细胞瘤的主要免疫组化特征图像
2.2 瘤细胞基因突变结果 瘤细胞存在NTRK2基因重排。
3 讨论
分子病理的发展不仅在疾病的诊断和鉴别诊断中起到重要作用,另一方面,基于分子异常的新病种报道也在不断出现,肿瘤分类的基础正在从形态学分类转向分子分类。目前,仍有部分软组织肿瘤病变仍未被分类,如SOX10不表达,但具有NTRK 融合且共表达S-100蛋白和CD34的梭形细胞肿瘤。
Suurmeijer 等[1]对25例(包括15例成人、10例儿童)共表达S-100 和CD34(不表达SOX10)伴有血管壁和基质玻璃样变的梭形细胞肿瘤的临床病理学特征及相关分子进行了归纳总结。Michal 等[2]报道了1 例发生于35 岁男性前臂的梭形细胞肿瘤,其形态学特点及免疫组化表达与Suurmeijer 等[1]报道病例一致,进一步荧光原位杂交检测发现,瘤组织存在NCOA4-RET融合。目前文献报道,伴有血管壁和基质玻璃样变的梭形细胞肿瘤中男女比例为13:13;发病年龄2~77 岁(16 例成人和10 例儿童);发病部位较广泛(上肢5/26、下肢8/26、头颈2/26、躯干下肢8/26、腹膜后1/26、直肠1/26、胃1/26);主要治疗方法以手术切除为主,偶见肿瘤复发和转移,出现转移者可辅助放疗治疗。
共表达S-100 及CD34 且伴血管壁及基质玻璃样变的梭形细胞肿瘤的发病年龄范围广,可发生在骨骼、软组织及内脏等解剖位置,病程长短不一。临床随访虽然有限,但多数患者肿瘤细胞为惰性的,需强调肿瘤具有恶性表型(以细胞密度增多和核分裂增加为特征),具有远处扩散的倾向和侵袭性,本研究结合文献纳入的27例患者中3例出现肿瘤转移,1例死亡。
光学显微镜低倍镜下观察,可见肿瘤组织呈无模式结构的单一形态的梭形细胞增生,血管穿插在瘤细胞间,基质及血管壁玻璃样变性,可有坏死、钙化,肿瘤细胞疏密不等,多数细胞密度低;可见脂肪纤维瘤病样肿瘤成分;高倍镜下细胞核呈卵圆形、短梭形、细长形,核染色质分散,核仁不明显,胞质弱嗜碱性。核分裂少见,细胞核可有轻到中度的核不典型。偶有散在的多核细胞。但也有部分病例表现出细胞密度高、呈束状生长及核分裂增加等明显恶性特征。
瘤细胞局灶性到弥漫性强阳性表达S-100 和CD34,不表达SOX-10。本组病例瘤组织Vimentin、S-100、CD34 表达阳性,SOX-10 表达阴性,Ki-67 表达低(约 5%),不表达 AE1/AE3、SMA、Desmin、Caldesmon、CD117、Dog-1、BCL-2、CD99、STAT6、CR、D2-40、HMB45、CD56、SYN、CGA、ALK。未见其它相关文献对该病进行详细免疫组化报道。
27例纳入者细胞遗传分子检测结果为8例存在RAF1 基因重排、2 例存在 BRAF 基因重排、14 例存在NTRK1基因重排、1例存在NTRK2基因重排、1例存在 RET 基因重排[1-2]。本病例检测到 NTRK2 基因重排。Suurmeijer等[1]的研究是关于RAF1基因融合在软组织肿瘤中的首次报道。RAF1 是RAS 下游信号激酶RAF 家族的成员,它激活MEK-ERK 通路,促进细胞增殖和存活。在前列腺、乳腺、甲状腺和胰腺、儿童低度胶质瘤,均有关于RAF1 融合的病例报道[3-4]。BRAF 基因融合现象在甲状腺癌和黑色素瘤中可见[5-6]。此外,BRAF 基因重排最近在梭形细胞肉瘤亚群中被发现,其形态类似于婴儿纤维肉瘤[7]。
NTRK 家族包括 TRKA、TRKB 和 TRKC 三种蛋白,分别由 NTRK1、NTRK2 和 NTRK3 基因编码[8],通常表达在神经组织中。TRK 融合蛋白将处于持续活跃状态,引发永久性的信号级联反应,驱动TRK 融合肿瘤的扩散和生长。NTRK 基因融合虽然比较罕见,但在很多肿瘤中都有发现,包括乳腺癌[9]、结直肠癌[10]、非小细胞肺癌[11]、肾癌[12]、婴幼儿纤维肉瘤[13]、胰腺癌、神经内分泌瘤、黑色素瘤、甲状腺癌[14]、胶质瘤、宫颈癌、鼻腔癌[15]、胆管癌[16]等。
在婴儿纤维肉瘤(IFS)组织中存在ETV6-NTRK3 融合,这种肉瘤通常在出生时或出生后2 年内发病[17]。在脂肪纤维瘤样神经肿瘤中也发现了NTRK1 融合[18]。 Haller 等[19]报道了 4 例包括 LMNA、TPM3 基因伴侣在内的NTRK1 相关融合的以显著的肌包膜/血管包膜模式为特征的肿瘤,CD34 仅有1 例肿瘤免疫阳性,而S-100 蛋白未见报道。此外,在1 例小儿软组织肉瘤患者存在STRN-NTRK2融合变异[20],但其确切的形态学特征尚不清楚。
Michal 等[2]的首次报道了 1 例存在 NCOA4-RET基因融合的间叶肿瘤RET 是原癌基因编码一种细胞膜受体酪氨酸激酶,该激酶激活后可导致RASRAF-MAPK 激活,促进细胞的存活时间及增殖。RET 基因融合在软组织肿瘤中极为罕见。NCOA4-RET 融合在甲状腺癌中最常见[21],在乳腺[22]、结肠[23]、肺[24]或唾液腺肿瘤[25]中偶见报道。
共表达S-100 及CD34 且伴血管壁及基质玻璃样变的梭形细胞肿瘤需要与胃肠道间质瘤(GIST)、胃肠道透明细胞肉瘤样肿瘤(CCSLGT)、孤立性纤维性肿瘤(SFT)、低级别恶性外周神经鞘肿瘤(MPNST)、IMT/炎性肌纤维母细胞瘤、脂肪纤维瘤病样神经肿瘤(LPF-NT)等相鉴别。GIST 常见的发生部位是胃、空回肠,细胞可呈梭形、上皮样形或多形形,表达CD117、DOG1、CD34 部分病例可表达S-100,但其SOX10 不表达。CCSLGT 多发生于小肠壁,可累及黏膜下或浆膜层,瘤细胞可呈卵圆形、多边形至上皮样细胞。瘤细胞弥漫表达S-100,可表达SOX10,不表达CD34。SFT 可表现无结构模式的生长,基质和血管壁也可有透明变性,但它是一种界限清楚的包膜性肿瘤,大多数情况下CD34 呈阳性,但不表达S-100。几乎所有的SFT 都有NAB2-STAT6融合[26],STAT6 是 SFT 一种高度敏感和特异的标记。约一半MPNST 病例发生在神经纤维瘤病(NF1)患者或有放射史患者,S-100 可阳性表达或局灶阳性,偶见S-100 弥漫阳性表达,但SOX-10 弥漫表达,CD34 不表达,约一半的病例存在H3K27 三甲基缺失。LPF-NT是一种罕见的浅表软组织肿瘤[27],具有局部侵袭性,手术切除不完整时可导致肿瘤复,具有局部侵袭性。镜下由条束状增生的梭形细胞组成,浸润皮下脂肪组织,少数病例中的梭形细胞浸润骨骼肌,类似脂肪纤维瘤病,免疫组化S-100 和CD34双阳性,部分病例灶状表达α-SMA,不表达HMB45、desmin、SOX10 和 GFAP[28]。 H3K27me3 表 达 无 丢失。NTRK1基因重排,多形成LMNA-NTRK1融合基因,少数病例涉及TRP- NTRK1 融合基因和TPM3-NTRK1 基因融合。但其不具有本研究中出现的独特的血管壁及间质玻璃样变等特征。IMT/炎性肌纤维母细胞瘤常位于肠系膜,大量的肌纤维母细胞病变,炎症细胞以淋巴细胞为主,无明显血管结构,肿瘤组织ALK 表达阳性、CD34 表达阴性。具有间质和血管壁玻璃样变及弥漫性CD34 表达的成纤维细胞梭形细胞瘤还包括细胞性血管纤维瘤、乳腺型肌纤维母细胞瘤和梭形细胞脂肪瘤,这三个肿瘤的遗传学相关,均在13q14 发生异常,导致Rb1 丢失,但均S-100阴性表达。
手术切除是目前临床的主要治疗方法,随访的16 例患者中2 例局部复发,3 例发生转移(肺、腹腔、肝)、1例死亡。目前有报道[29-30],TRK 融合的各种恶性肿瘤对高选择性小分子TRK 抑制剂Larotrectinib敏感,对于无法切除、或复发和/或转移性疾病的病例可能受益于NTRK靶向药物的治疗。
综上所述,瘤组织共表达S-100、CD34伴血管壁及基质玻璃样变的梭形细胞肿瘤细胞为无模式生长结构,伴间质和血管壁玻璃样变性,瘤组织S-100 和CD34 共表达(SOX-10 不表达),细胞存在NTRK2 基因重排。其肿瘤细胞临床生物学行为表现为惰性。

