LIR 损伤过程中腹腔给予氢气的兔血清TRAIL、Omi/HtrA2及骨骼肌组织Omi/HtrA2表达观察
刘丹丹,李林 ,董云,崔昌盛,庄宝祥,田华,王岱君
1 潍坊医学院人体解剖学教研室,山东潍坊261053;2 滨州市人民医院;3 潍坊医学院形态学实验室;4 潍坊医学院校医院
日本学者Ohsawa 等[1]根据吸入氢气可以改善脑梗死引起的脑缺血-再灌注(ischemia/reperfusion,IR)损伤,首次提出氢气可选择性中和活性氧簇(ROS)和羟自由基(-OH)。近年来,氢气在抗氧化、抗炎、抗细胞凋亡、保护线粒体、保护内质网及调节细胞内信号通路等方面的作用相关研究取得较多进展。细胞凋亡是IR 损伤的重要病理生理机制。研究[2]发现,富氢生理盐水可降低肾IR 损伤中肿瘤坏死因子-α(Tumor necrosis factor α,TNF-α)及白细胞介素-6(Interleukin-6,IL-6)的表达水平,提高B 淋巴细胞瘤-2 基因(B cell lymphoma-2,Bcl-2)与凋亡前体蛋白Bax 比值,抑制肾细胞凋亡。与TNF-α 一样,肿瘤坏死因子-相关凋亡诱导配体(Tumor necrosis factor-associated apoptosis induced ligand,TRAIL)也是TNF 超家族(TNFSF)中的一员,可诱导肿瘤细胞的凋亡,参与IR 损伤,其配体/受体复合物可激活天冬氨酸特异性半胱氨酸蛋白酶(cysteine-containing aspartate-specific proteases,caspase)调控的线粒体凋亡途径。当线粒体凋亡途径被触发时,线粒体膜的完整性破坏,线粒体膜的通透性发生改变,促进凋亡分子释放。线粒体丝氨酸蛋白酶高温需求因子A(High temperature requirement factor A2,HtrA2)又称Omi,已被证明在肝、肾等器官组织的细胞凋亡中起调节作用。我们的前期研究发现,调节TNFSF 成员中的 TNF-α 及核转录因子 κB(nuclear factorkappa B,NF-κB)水平可降低肢体缺血-再灌注(LIR)短期损伤,但氢气是否可以调节TNFSF 成员中的TRAIL 及促凋亡蛋白Omi/HtrA2 来降低兔LIR 的的长期损伤,仍待进一步探讨。我们于2019 年9 月-2020年7月间,我们观察了腹腔给予氢气的LIR兔血清TRAIL、Omi/HtrA2 及骨骼肌组织匀浆上清Omi/HtrA2表达,并探讨氢气在其中的可能作用机制。
1 材料与方法
1.1 动物、试剂及仪器 健康成年雄性新西兰大耳白兔,兔龄70~80 d,体质量(2.16 ± 0.25)kg,购于青岛康大生物科技有限公司,实验动物生产许可证号:SCXK(鲁)20160002;按SPF 级动物饲养要求喂养一周,饲养环境设置为湿度(50± 10)%,温度(23± 2)℃,普通饲料喂养,自由饮水。氢气浓度99.999%,购于安丘市恒安气体厂;TRAIL ELISA 测定试剂盒,Omi/HtrA2 ELISA 测定试剂盒均购于上海将来实业股份有限公司江莱生物;TDZ4-WS 低速离心机为长沙湘仪离心机仪器有限公司生产;DNM-9602酶标仪为北京普朗新技术有限公司生产。
1.2 LIR 兔模型建立及氢气腹腔注射方法 取45只兔,采用随机数字表法分为LIR+氢气组(H 组)、LIR 组(I 组)及对照组(C 组)。H、I 组采用袖带压力阻断血流方法进行LIR:左侧耳缘静脉注射200 g/L乌拉坦,5mL/kg给药剂量麻醉兔,固定于兔台上,使用特制的袖带(长18 cm,宽3 cm),其橡皮囊的两管分别与台式水银血压计的球囊和检压计相连,将袖带平整地绑缚于兔右后肢根部股动脉搏动处,测量血压,以超过收缩压20~30 mmHg 压力作为完全阻断血流的压力,随时补气保持压力下降不超过10 mmHg,束缚4 h打开球囊开关,放气,形成LIR 兔模型。C 组动物仅使用相同特制袖带缠缚相同部位,不充气加压。H 组于再灌注前5 min 腹腔注射5 mL/kg氢气,C、I组同时刻腹腔注射等体积空气。
1.3 血清TRAIL、Omi/HtrA2 及骨骼肌组织Omi/HtrA2 检测 分别于再灌注 24、72、168 h 时取各组大耳白兔,耳缘静脉取血1 mL,静置10 min,2 500 r/min 离心 10 min,取上清,ELISA 法检测血清TRAIL 及Omi/HtrA2。①剪去兔右后肢胫骨前区毛发并消毒,沿胫骨纵行切开皮肤,分离肌肉组织,注意不伤及血管与神经,切取0.7 cm×0.3 cm×0.2 cm大小的胫骨前肌组织块,PBS 冲洗所取组织、称重、冰上研磨、制备匀浆、离心、取上清,ELISA 法检测骨骼肌组织匀浆上清Omi/HtrA2 每次取材后,及时止血缝合包扎伤口,饲养条件同前。取材后每2 天更换一次敷料,若有感染及时处理。各指标检测操作严格按试剂盒说明书要求进行。
1.4 统计学方法 采用SPSS 26 统计软件对实验数据进行处理。计量资料以表示。本研究各组各时间点数据存在一定的相关性,使用重复测量方差分析。进行重复测量方差分析前,需检验资料的正态性、方差齐性及协方差矩阵的球形性(sphericity)。Mauchly 法检验球对称性,如数据不符合球对称假设,则采用Greenhous-Geisser(G-G)法对自由度进行校正。组内两两比较用数据拆分后行估算边际均值法(Bonferroni 法),组间两两比较用多变量方差分析法。P<0.05差异具有统计学意义。
2 结果
2.1 再灌注 24、72、168 h 时三组兔血清 TRAIL 表达比较 再灌注24、72、168 h 时三组兔血清TRAIL表达比较见表1。
表1 再灌注24、72、168 h时三组兔血清TRAIL表达比较(pg/mL,)

表1 再灌注24、72、168 h时三组兔血清TRAIL表达比较(pg/mL,)
注:与再灌注72 h 比较,*P<0.01;与C 组比较,△P<0.01;与I 组比较,#P<0.01。
再灌注168 h 97.854 ± 4.003*△#88.309±4.809 132.466±7.920*△组别H组C组I组TRAIL再灌注24 h 96.249 ± 4.839*△#88.419±4.876 110.363 ± 8.258*△再灌注72 h 94.083±5.599#88.929±4.980 103.231±9.087△
2.2 再灌注24、72、168 h 时三组兔血清Omi/HtrA2表达比较 再灌注24、72、168 h时三组兔血清Omi/HtrA2表达比较见表2。
表2 再灌注24、72、168 h时三组兔血清Omi/HtrA2表达比较(pg/mL,)
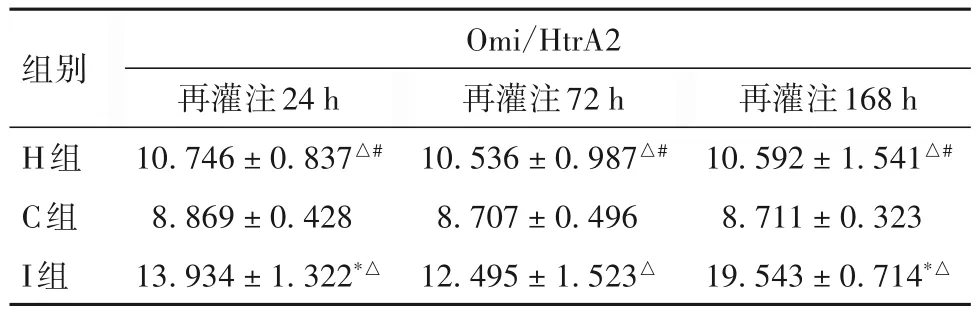
表2 再灌注24、72、168 h时三组兔血清Omi/HtrA2表达比较(pg/mL,)
注:与再灌注72 h 比较,*P<0.01;与C 组比较,△P<0.01;与I 组比较,#P<0.01。
再灌注168 h 10.592± 1.541△#8.711±0.323 19.543±0.714*△组别H组C组I组Omi/HtrA2再灌注24 h 10.746± 0.837△#8.869±0.428 13.934±1.322*△再灌注72 h 10.536± 0.987△#8.707±0.496 12.495±1.523△
2.3 再灌注24、72、168 h时三组兔骨骼肌组织匀浆上清Omi/HtrA2表达比较 再灌注24、72、168 h时三组兔骨骼肌组织匀浆上清Omi/HtrA2表达比较见表3。
3 讨论
LIR 损伤在临床上较为常见,严重挤压伤、断肢再植、血管夹闭等均可导致LIR,可造成严重组织损伤甚至导致组织坏死。缺血组织在恢复血供时,会出现组织内大量Ca2+内流、氧自由基生成、组织细胞凋亡等病理生理现象。我们前期研究[3]表明,抑制TNF-α 与 NF-κB 的相互激活过程减轻 LIR 损伤引起的炎症反应,提示通过阻碍TNFSF 成员与其他炎症或凋亡因子的相互作用能够减轻LIR 损伤。TRAIL又称为凋亡素 2(Apo2 Ligand,Apo2L),是一个与TNFSF 成员序列有同源性的蛋白分子[4]。TRAIL 具有可特异性诱导肿瘤细胞凋亡,且对正常细胞无明显影响的特性[5],所以TRAIL 在肿瘤免疫、炎症反应和细胞凋亡方面一直是目前肿瘤学的研究热点。当组织器官发生IR 损伤时,TRAIL 活化并与细胞膜上的死亡受体结合,经过一系列反应,形成死亡诱导信号复合物(death inducing signaling complex,DISC),DISC促使caspase-8活化,之后会通过两条信号途径传递凋亡信号,激活细胞凋亡信号途径。其中一条是线粒体依赖型途径,活化的caspase-8催化Bcl-2家族蛋白导致Bid裂解产生截短Bid(t Bid),t Bid激活多域蛋白Bax和Bak,线粒体膜的完整性被破坏,凋亡蛋白如细胞色素C(Cytochrome C,Cyt C)和Omi/HtrA2 等一起从线粒体释放到细胞质中,降解诱导X染色体连锁的凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP),触发caspase凋亡级联,细胞凋亡加速,组织细胞水肿和损伤加重。研究显示,氢气可在心、脑、肝、肾、大肠、肢体[6-11]等 IR 损伤中发挥保护作用。TRAIL在IR中的研究多集中在心、脑、肾等[12-14]方面,在LIR方面的研究较少。Omi/HtrA2参与IR损伤、癌症、阿兹海默症[15-17]等疾病,被认为是促进IR 细胞凋亡的关键细胞内分子,在心、肠 IR 损伤[18-20]中研究较多。目前,氢气影响LIR 损伤细胞凋亡的研究不多,机制尚不十分清楚,故本研究选择了在LIR损伤中研究较少的TRAIL及Omi/HtrA2作为检测指标。
表3 再灌注24、72、168 h时三组兔骨骼肌组织匀浆上清中Omi/HtrA2表达比较(pg/mL,)
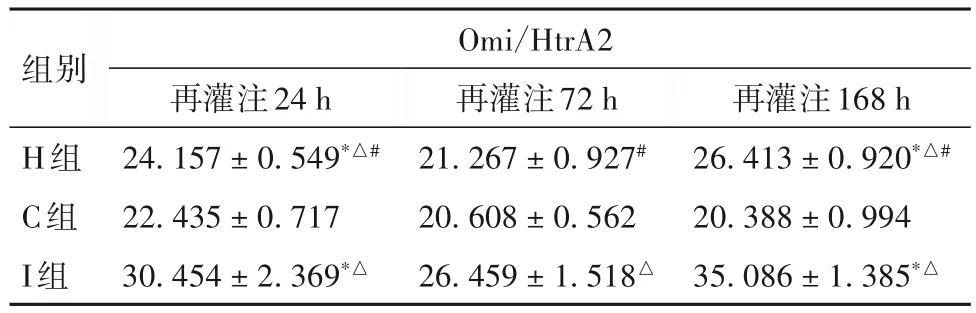
表3 再灌注24、72、168 h时三组兔骨骼肌组织匀浆上清中Omi/HtrA2表达比较(pg/mL,)
注:与再灌注72 h 比较,*P<0.01;与C 组比较,△P<0.01;与I 组比较,#P<0.01。
再灌注168 h 26.413 ± 0.920*△#20.388±0.994 35.086±1.385*△组别H组C组I组Omi/HtrA2再灌注24 h 24.157 ± 0.549*△#22.435±0.717 30.454±2.369*△再灌注72 h 21.267±0.927#20.608±0.562 26.459±1.518△
本实验结果显示,LIR 后再灌注 24~72 h,I 组血清中TRAIL 及Omi/HtrA2 的浓度呈下降趋势,这可能与缺血肢体在再灌注后不同时间点,缺血骨骼肌组织细胞凋亡程度受到机体全身免疫反应的调控有关,体内多种免疫因子活性增高,TRAIL活性被抑制,进而Omi/HtrA2 释放减少。再灌注72~168 h,TRAIL 及Omi/HtrA2 的浓度呈快速增长趋势,在7d时达到峰值,这一现象可能是因为,再灌注72 h后骨骼肌组织的细胞凋亡不断累积,机体全身免疫反应的调控到达一定程度,TRAIL活化不再被抑制,同时Omi/HtrA2 释放增多。再灌注不同时间,H 组血清中TRAIL及Omi/HtrA2的浓度及骨骼肌组织匀浆上清中Omi/HtrA2 的浓度均低于I 组,再灌注168 h 时降低最为明显,说明腹腔注射氢气可以降低LIR 损伤产生的TRAIL及Omi/HtrA2的浓度。此外我们还发现,凋亡蛋白Omi/HtrA2 不仅可以在兔骨骼肌组织匀浆上清中检测到,在血清中也可以检测到,血清与骨骼肌组织匀浆上清中Omi/HtrA2的浓度变化趋势相同,并且匀浆上清中Omi/HtrA2 的浓度高于血清中Omi/HtrA2 的浓度,这可能与细胞凋亡后细胞质膜破裂,导致包括细胞内Omi/HtrA2 在内的所有细胞内容物进入细胞外间隙有关[21]。
综上所述,腹腔注射氢气的LIR 兔血清TRAIL、Omi/HtrA2 及骨骼肌组组织匀浆上清Omi/HtrA2 表达均降低。TRAIL 及促凋亡因子Omi/HtrA2 参与了LIR 骨骼肌细胞的凋亡。腹腔注射氢气可抑制TRAIL 的活化及Omi/HtrA2 的释放,发挥其抗细胞凋亡的作用。其机制可能是氢分子通过细胞膜进入细胞内,抑制TRAIL 与诱导凋亡受体的结合,维持线粒体稳态,释放到细胞质中的Omi/HtrA2减少,抑制凋亡级联反应。后续我们将从基因水平上进行验证对比,并延长再灌注时间点的选取,进一步探讨氢气对 LIR 中 TRAIL 及 Omi/HtrA2 的影响,为研究细胞凋亡与LIR的关系提供更有价值的实验资料。

