类伸展蛋白OsPEX1对水稻花粉育性的影响
代航,李延,刘树春,林磊,吴娟燕,张志杰,彭崎春,李楠,张向前
研究报告
类伸展蛋白OsPEX1对水稻花粉育性的影响
代航,李延,刘树春,林磊,吴娟燕,张志杰,彭崎春,李楠,张向前
华南农业大学林学与风景园林学院,广州 510642
类伸展蛋白(Leucine-Rich Repeats Extensins, LRX)是一类细胞壁嵌合蛋白,其N端包含一个LRR (leucine-rich repeats)结构域,C端含Extensins结构域。研究表明,LRX基因家族在拟南芥()花粉萌发和花粉管生长过程中具有重要作用,而水稻(L.) LRX基因家族是否在调控花粉发育方面具有保守的生物学功能尚不清楚。本研究首先进行了生物信息学分析,结果显示,水稻LRX基因家族包括8个成员,、、位于水稻第1号染色体;和分别位于第2、第5、第6、第11和第12号染色体,其中OsPE基因在花粉中高表达,暗示可能参与了花粉发育调控。为此,本研究采用RNAi技术进一步研究了基因对花粉发育的影响。结果表明,基因的RNAi转基因植株花粉败育,结实率仅为10%-30%。qRT-PCR分析显示,这些RNAi转基因植株基因表达量显著低于野生型,而且其表达量越低花粉育性亦随之降低。上述研究结果表明,水稻基因是水稻花粉发育的重要基因,该基因的克隆和功能分析有助于进一步阐明水稻花粉发育调控的分子遗传学机制。
水稻;类伸展蛋白;花粉育性
类伸展蛋白基因家族因其编码的蛋白含有1个富含亮氨酸的重复序列(leucine-rich repeats, LRR)和1个伸展蛋白结构域,该家族又称为LRX家族(leucine-rich repeats extensins)[1,2]。LRX蛋白在植物生长发育中具有重要作用,根据系统发生关系和表达模式可以将基因分为2类:主要在营养组织中表达的基因,通常用表示;主要在繁殖器官中高表达的基因,通常用()表示[3]。
LRX蛋白的功能众多,除了促进细胞生长外,还影响营养生长、形态发生、授粉受精[4,5]等,随细胞基质不同具有不同的功能,并表现出高度的组织、器官和细胞特异性[6]。通过对拟南芥()的研究,发现直接参与了细胞壁的形成[2];在玉米(L.)花粉中Zmpexl蛋白也可能作为与雌蕊结合子相互作用的识别因子[1]。近来研究表明,拟南芥类伸展蛋白LRX3/4/5能够与植物多肽类激素(rapid alkalinization factor, RALF) RALF22/23互作,而RALF与质膜定位的受体FER互作调控盐胁迫[7]。此外,花粉表达的ANX1/2和BUPS1/2与AtRALF4/19互作,而AtRALF4/19能与AtLRX8/9互作调控拟南芥花粉管伸长[8,9]。拟南芥LRX4的LRR功能域能够与CrRLK1L (receptor-like kinase)家族成员FERONIA (FER)直接互作,表明类伸展蛋白与CrRLK1L家族成员可能存在直接联系[10]。考虑到CrRLK1L受体类激酶亚家族成员例如FER、ANXURs (ANX1/ANX2) 和BUDDHA'S PAPER SEAL1, 2 (BUPS1/BUPS2)可能是潜在的细胞壁感应器[11],这些CrRLK1L蛋白跨细胞质膜定位能够连接质外体和细胞质,在各种细胞过程有多重功能[12]。上述研究表明,类伸展蛋白可能参与了细胞壁与细胞表面信号的传导过程[13]。
水稻(L.)是世界上最重要的粮食作物之一,是单子叶植物基因组研究的模式植物。目前,类伸展蛋白在水稻发育调控功能方面的研究还比较薄弱,尚无LRX类伸展蛋白调控水稻育性方面的相关报道。本研究在生物信息学分析的基础上通过RNAi方法对水稻基因(LOC_Os11g43640)进行了育性相关研究,发现水稻类伸展蛋白基因在水稻花粉发育方面具有重要的调控作用。
1 材料与方法
1.1 材料
本研究转化所用的水稻材料是粳稻品种中花11,其种子来自于广东省植物分子育种重点实验室。
1.2 生物信息学分析
以拟南芥中已知的LRX基因(,)序列检索水稻基因组注释数据库MSU rice genome annotation release 7(http://rice.plantbiology.msu.edu/),搜索水稻的同源基因,并分析水稻中LRX类基因在染色体上的位置。根据数据库中的注释信息,绘制水稻LRX基因家族各基因结构图,利用TBtools[14]绘制LRX基因的表达分析谱。
1.3 RNAi载体的构建
按照TransZolTMUp试剂盒说明书提取水稻组织总RNA,并将检测合格的RNA反转录合成第一链cDNA。以反转录的水稻叶片单链cDNA为模板,设计并合成特异性引物(p1390-KD-PEX-F:5′-ACGCGTGGATCCAGGAGTCACCTGAGGAACCA-3′;p1390-KD-PEX1-R:5′-CTGCAGAAGCTTATTCTTCTGGAGTCGGTGGA-3′),扩增目的片段,回收之后将目的基因片段反向连接到植物表达载体pCAMBIA1390-Ubi,构建RNAi表达载体p1390-KD- PEX1。将连接产物转化到大肠杆菌DH5α感受态细胞,涂板过夜培养后挑选单菌落进行测序,挑选测序正确的质粒转化到农杆菌EHA105,用于遗传转化。
1.4 农杆菌介导的遗传转化
参照王玉珍等[15]介绍的方法,用含有目的质粒的农杆菌菌液侵染中花11种子诱导的愈伤组织,之后对侵染的愈伤组织进行抗性筛选以及抗性愈伤组织的分化生根,最后对幼苗进行炼苗和移栽。
1.5 转基因植株检测
对遗传转化得到的转基因植株,按照张向前等[16]介绍的方法进行DNA的快速提取,通过潮霉素抗性基因PCR扩增检测是否为转基因阳性植株。
1.6 转基因植株基因表达分析
水稻花粉总RNA的提取利用TransZolTMUp试剂盒(北京全式金生物技术有限公司)进行,采用Primer 5.0设计qRT-PCR引物(RT-OsPEX1-F:5′- GAGATGGGCTACCTGCAGAACA-3′;RT-OsPEX1- R:5′-GTAGGCGAAGCTGAAGTTGACG-3′),以(Actin-F:5′-GATCACTGCCTTGGCTCCTA-3′;Actin- R:5′-GTACTCAGCCTTGGCAATCC-3′)作为内参,分析野生型和RNAi转基因植株基因在花粉中的相对表达量。采用TaKaRa SYBR Primer Ex(Perfect Real Time)试剂盒进行Real-time PCR扩增。在冰上配制Real-time PCR反应体系,重复3次。反应体系如下:2×SYBR Premix Ex Taq10μL,引物F (10 μmol/L) 0.8 μL,引物R (10 μmol/L) 0.8 μL;cDNA模板10 ng,ddH2O补足20 μL。
1.7 转基因植株表型观测
收集T0代转基因植株的种子,连续自交种植两季之后观测T2代表型。RNAi转基因植株结实率统计:转基因水稻T2代成熟后,统计每株各个稻穗的谷粒总数及实粒数。每穗结实率=实粒数/谷粒总数。单株结实率为每穗结实率的平均值。
花粉染色:RNAi转基因植株和野生型抽穗后,取主穗中上部花药长度超过谷壳长度2/3的成熟顶端颖花4-5朵,置于FAA (70%乙醇∶冰乙酸∶甲醛= 89∶6∶5)固定液中固定保存。碘-碘化钾(I2-KI)溶液染色后在普通光学显微镜下进行观察。根据花粉粒的形状、大小和着色情况将花粉分为可育花粉和败育花粉两种类型,可育花粉呈圆球形,积累淀粉较多,通常被I2-KI染成深蓝色。而败育花粉常表现出畸形,往往不含淀粉或积累淀粉较少,被I2-KI染成黄褐色。每朵颖花取3个视野,每株观察3朵颖花,共9个视野,观察花粉染色情况。
2 结果与分析
2.1 水稻LRX基因家族在染色体上的分布
本研究以拟南芥中已知的基因(、At1g12040)蛋白序列为模板搜索水稻的同源基因。在水稻基因组注释数据库MSU rice genome annotation release 7(http://rice.plantbiology.msu.edu/)中,共找到8个LRX类基因,分布于第1、2、5、6、11、12号染色体上,其中第1号染色体上最多,有3个成员,分别是、和;其他5条染色体上各有1个成员,分别是位于2号染色体上的,位于5号染色体上的,位于6号染色体上的,位于11号染色体上的和位于12号染色体上的(图1)。
2.2 水稻LRX基因家族生物信息学分析
根据上述水稻基因组注释数据库上的注释信息,得到水稻8个LRX类基因的′到′的序列信息。这8个基因的基因结构如图2所示。其中和的编码区只包含一个外显子,不存在内含子序列;而基因的编码序列包含两个外显子和一个内含子。编码蛋白质长度在455 aa~1399 aa之间,其中编码的蛋白最长(1399 aa)。
根据其表达模式(图3),水稻中的8个基因可以分为两组:、、和主要在生殖器官中表达(尤其在花药中),在营养器官中表达量较低或者不表达;、、和在生长的各个时期均有表达,其中在营养器官及生殖器官中均有表达但是表达量较低。这也暗示着两组基因可能在不同的生长时期,参与水稻生长发育的调节。
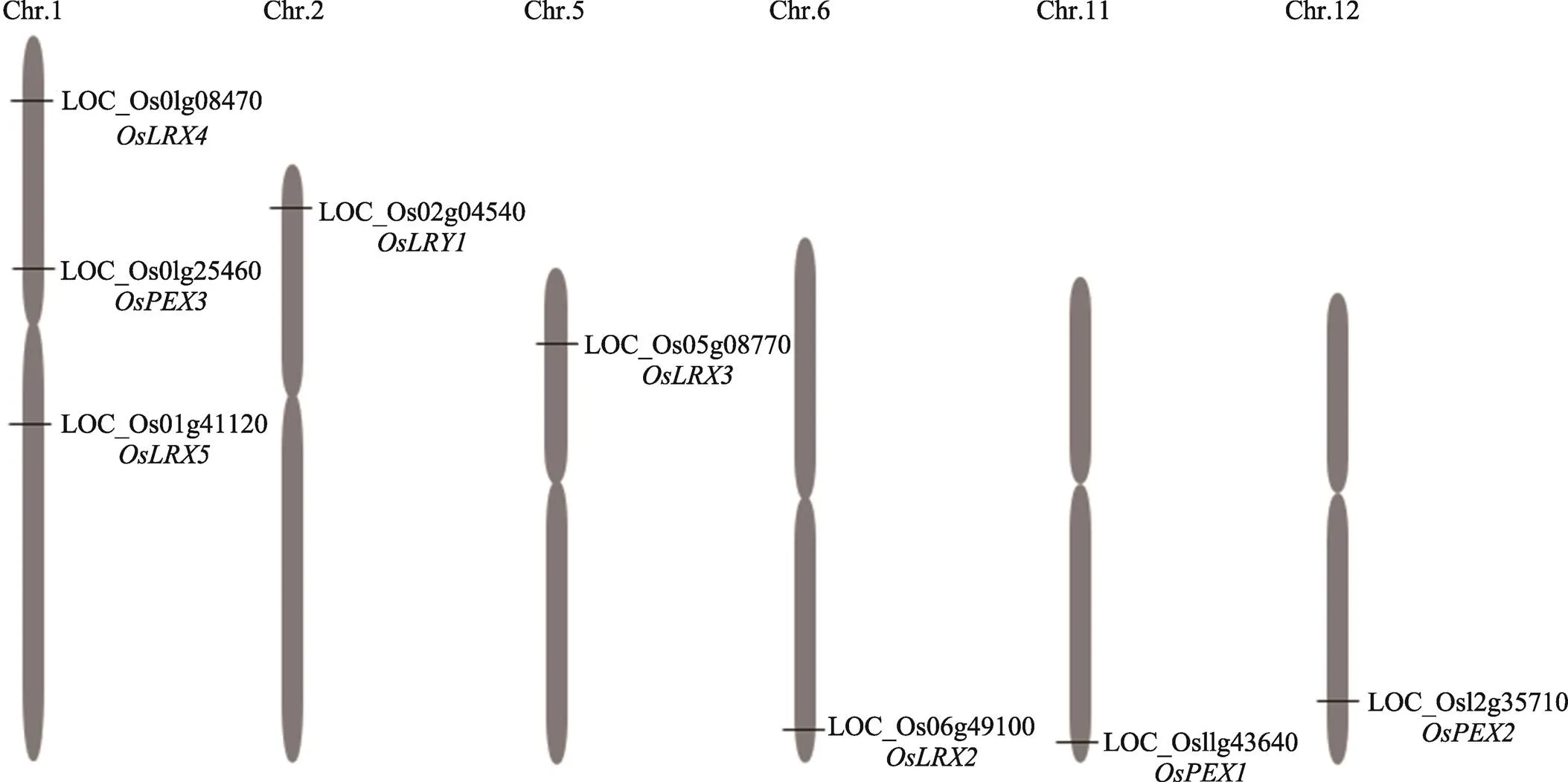
图1 水稻类伸展蛋白基因在染色体位置示意图

图2 水稻类伸展蛋白基因结构
黑色区域:外显子;黑色线:内含子;灰色区域:非编码区。
2.3 水稻OsPEX1基因RNAi转基因植株的获得
表达谱分析表明,水稻中PEX类基因在花药中高表达,这说明此类基因可能与花药的形成与发育相关。为了探究PEX类基因与花药发育的关系,本研究利用RNAi方法对基因进行了功能研究。
本研究通过构建基因的RNAi表达载体,利用农杆菌介导转化的方法转化粳稻品种中花11,获得RNAi转基因植株。转基因T0代共获得40株,用潮霉素基因特异引物进行PCR扩增,检测T0代植株(图4),共获得25株转基因阳性株。
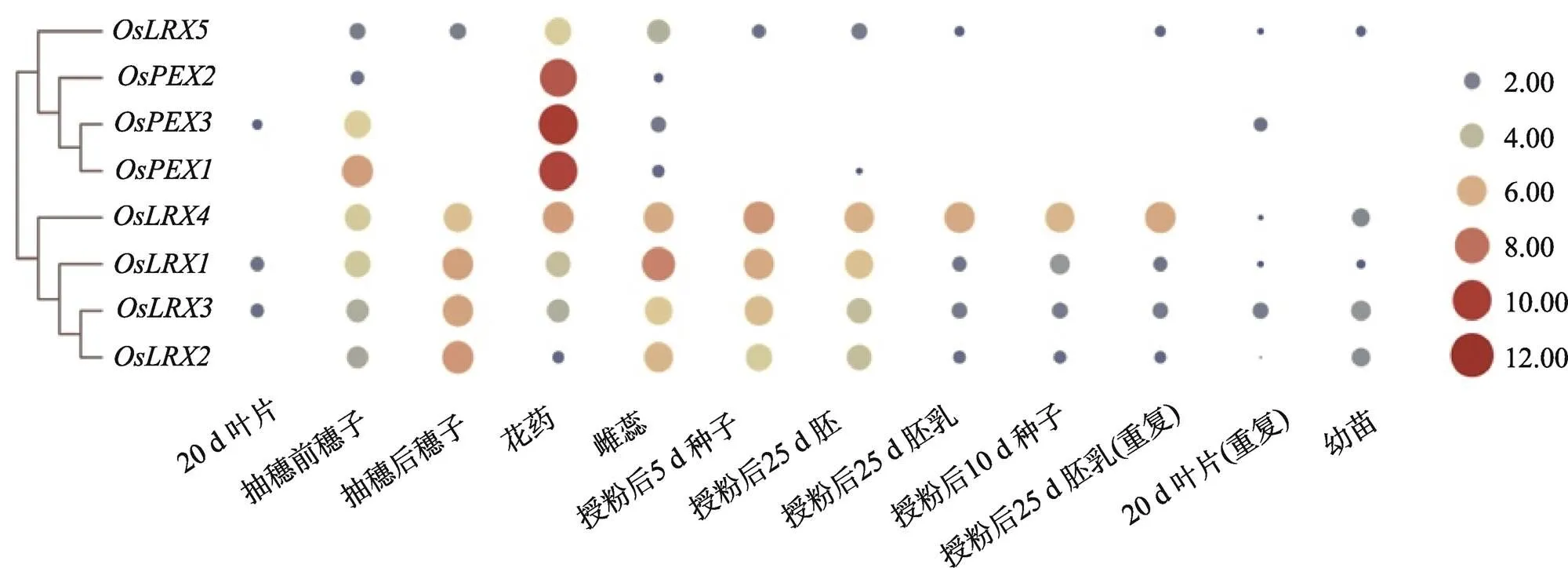
图3 水稻类伸展蛋白基因表达模式
2.4 水稻OsPEX1基因RNAi转基因植株表型特征
对水稻基因RNAi转基因植株表型进行分析,结果显示,与野生型中花11相比,所有转基因植株的结实率显著降低,结实率在10%~30%之间,个别植株甚至完全不育(图5,A和B)。基因表达分析结果显示,转基因植株的育性与基因的表达量呈现出正相关性,即的表达量越低,其对应植株的结实率越低(图5,B和C)。
为了进一步阐释影响水稻结实率的原因,本研究对转基因T2代植株的花粉育性进行统计观察。与野生型可育花粉相比,转基因阳性植株的花粉育性显著降低(图6)。转基因阳性植株的花粉形态不规则,不能被I2-KI着色,呈现出雄性不育特征(图6)。综上所述,可能在水稻花药、花粉发育中起到了至关重要的作用,降低的表达,会影响花粉的正常发育,进而导致结实率降低。
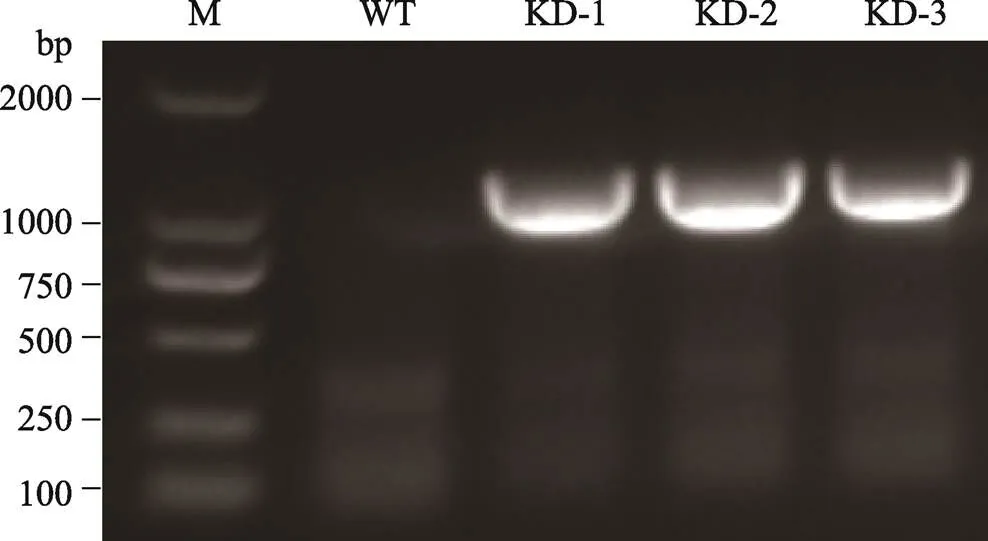
图4 转基因植株PCR检测
M:DL2000 Marker;WT:野生型植株;KD:RNAi转基因植株。
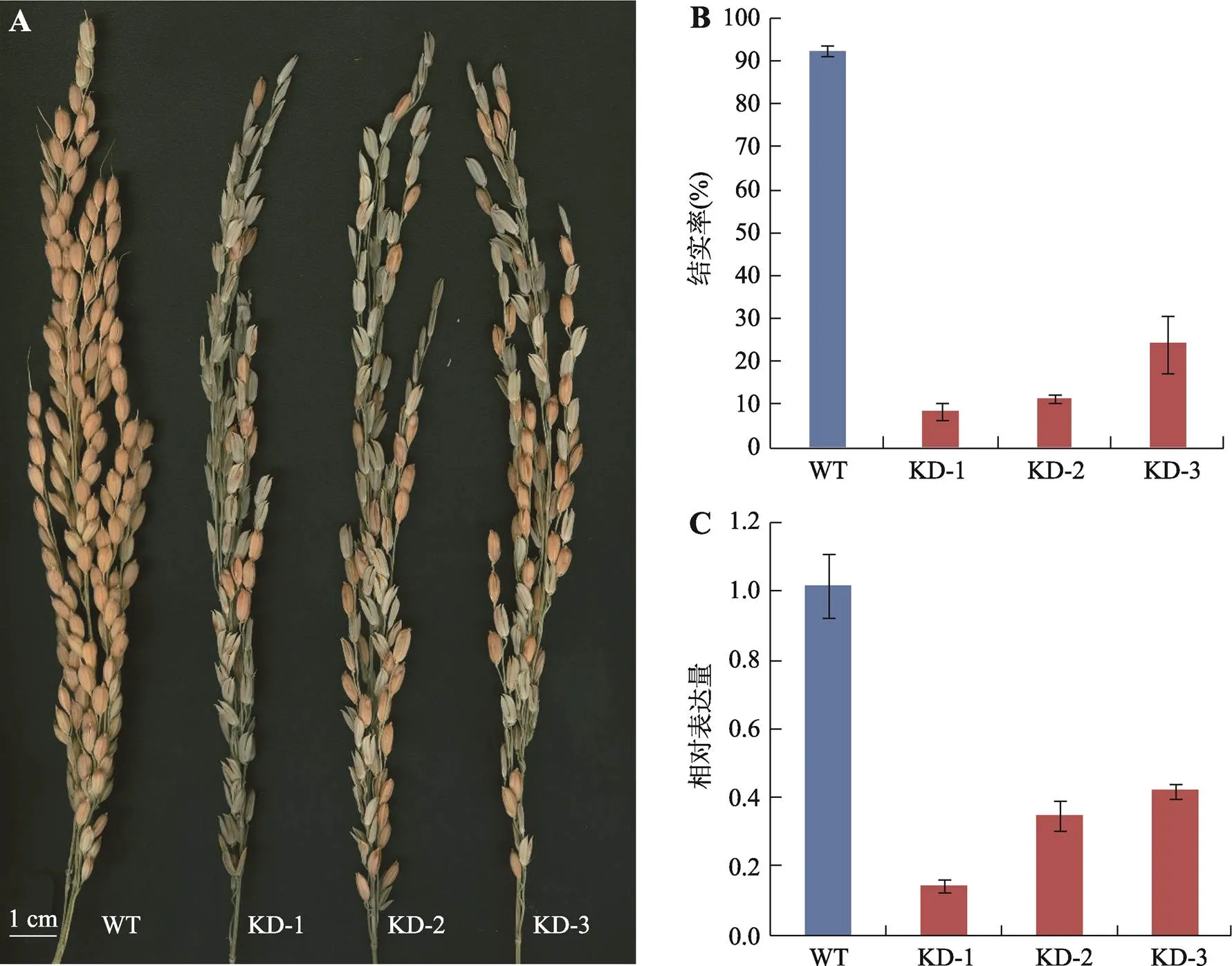
图5 水稻野生型和OsPEX1基因RNAi转基因植株表型及其表达分析
A:野生型和转基因RNAi植株的主穗;B:野生型和转基因RNAi植株的单穗结实率;C:野生型和转基因RNAi植株中基因的相对表达量。WT:野生型植株;KD:RNAi转基因植株。
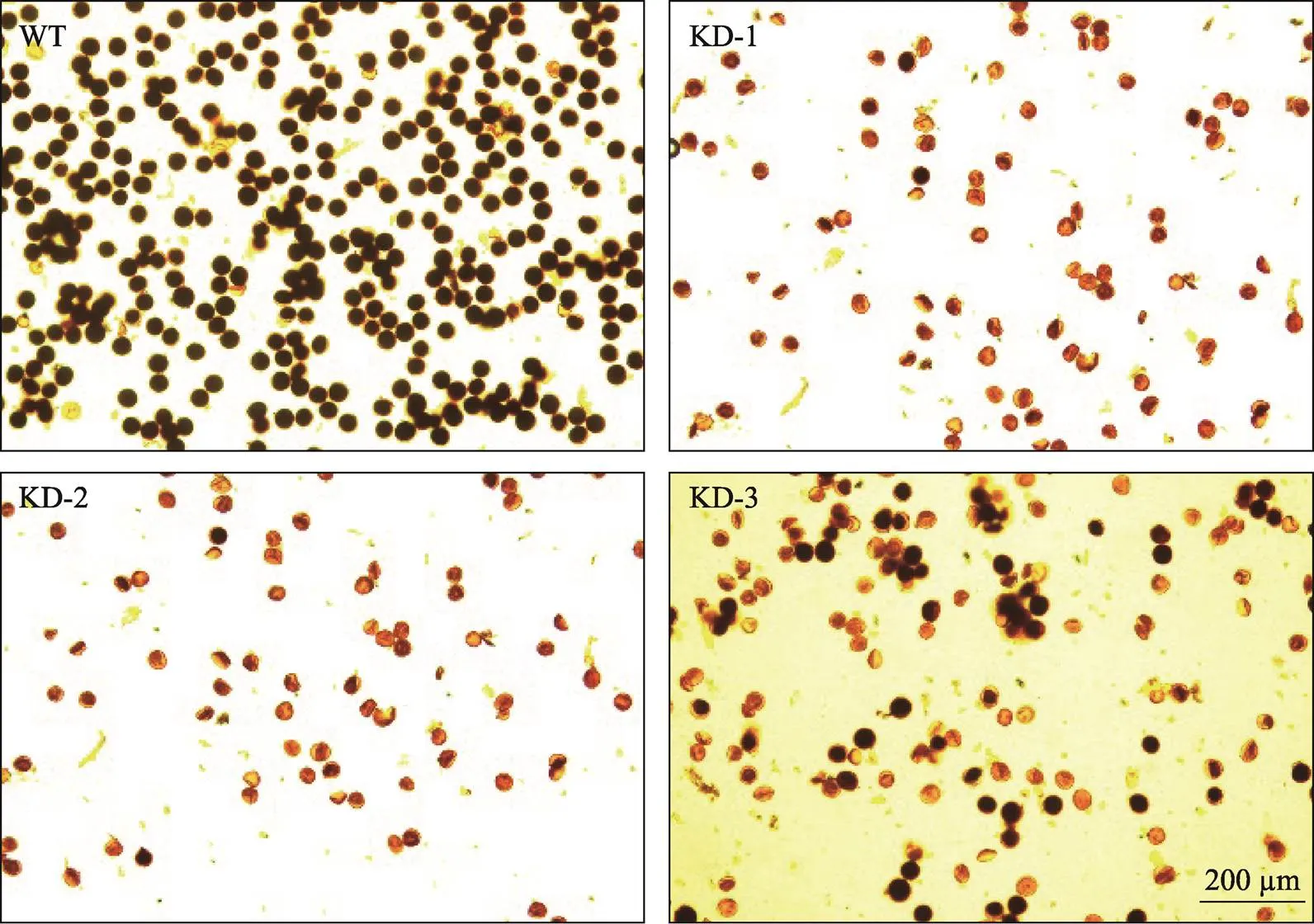
图6 水稻野生型和OsPEX1基因RNAi转基因T2代植株花粉I2-KI染色
WT:野生型植株;KD:RNAi转基因植株。
3 讨论
在开花植物中,花粉发育是一个非常复杂的生物学过程[17]。小孢子母细胞在花粉囊中减数分裂产生小孢子,进一步发育成花粉粒,花粉粒成熟后从花药中释放出来[18]。高等植物小孢子所处的花粉囊被来源于体细胞绒毡层中的糖类和脂类所填充,进而提供了花药早期发育所需的营养物质[19]。目前,关于花粉育性基因相关调控机制的研究主要涉及花粉败育和花粉缺失相关基因[20~24]。其中,花粉败育是指,花粉受内外环境因素影响而不能正常发育,主要原因是花粉母细胞不能正常减数分裂和绒毡层细胞异常[25]。在雄性不育系小麦S-1376中,不育系花药绒毡层细胞提前至四分体时期降解,并在各发育时期伴随着多糖、脂类和蛋白质等物质异常分布和积累,致使小孢子在由单核晚期向二核期发育的过程中物质供应不足,使得小孢子细胞核分裂异常,最终表现为花粉败育[26]。在()突变体中,在花药的外层不存在表皮蜡状晶体,并且由于突变体花粉中花粉外壁形成的缺陷,小孢子的发育被严重阻碍并最终被破坏从而导致花粉败育[27]。对于水稻花粉半不育性突变体(),由于编码的蛋白缺失,使得花粉减数分裂减弱,花粉生活力降低,表现出半不育性[22]。突变体()的绒毡层不能分化和液泡化,并且小孢子母细胞不能分裂成小孢子,中间层细胞不退化,因而花粉囊不能产生正常花粉[28]。最新研究表明,拟南芥()突变体通过促进细胞周期关键蛋白KRP1的降解,在花粉发育中发挥重要作用[29]。通过对一个水稻雄性不育突变体()的研究发现,该突变体在减数分裂过程中出现胼胝质沉积缺陷,而胼胝质的异常沉积会导致小孢子败育[30]。这些基因的发现以及功能研究,使人们对花粉育性相关的调控机制有了更深的认识。
花粉成熟后,花药破裂,花粉释放,经过风力或昆虫的作用落到同一朵花或另一朵花雌蕊柱头上,引发一系列复杂的细胞形态变化和生理生化变化,其中花粉萌发、花粉管生长对于双受精的完成至关重要[31]。对拟南芥AtLRX8-11的研究表明,LRX蛋白参与了花粉管的生长以及花粉管细胞壁完整性的维持。通过分析、、和这4个基因的三突变体和四突变体在花粉以及花粉管中的表达,发现这些LRX蛋白与花粉的萌发以及花粉管的生长密切相关。突变体的花粉管细胞壁组装受到严重影响,胼胝质和果胶过度积累,导致花粉管异常膨大和破裂等[32~34]。花粉管细胞壁成分的变化可能与囊泡运输有关,而花粉管的破裂可能与Ca2+的含量有关[33]。
LRX蛋白同源比对表明,水稻类伸展蛋白有8个,第1染色体有3个,第2、5、6、11、12染色体各有1个。目前,水稻类伸展蛋白调控植物生长发育的机理研究还比较薄弱,尚无水稻LRX类伸展蛋白调控花粉发育的相关报导。植物除了具有复杂完善的膜信号系统,还拥有细胞壁信号传导途径,使其能够感知、传导细胞壁状态以及细胞壁组份变化,以便更好的协调植物生长发育和提高植物适应环境变化的能力[35]。近来研究表明,拟南芥花粉表达的LRX蛋白AtLRX8/9能够与植物快速碱化因子AtRALF4/19互作,而AtRALF4/19进一步通过与CrRLK1L受体类激酶互作共同调控拟南芥花粉管萌发和伸长[9,32~34]。这些研究表明,细胞壁LRX蛋白可能通过LRX-RALF-CrRLK1L途径参与了植物细胞信号转导过程。水稻基因组有16个CrRLK1L受体类激酶家族成员,而RALF家族成员超过40个(http://rice.plantbiology.msu.edu/)。鉴于植物LRX、CrRLK1L以及RALF蛋白家族的保守性,水稻类伸展蛋白OsPEX1应该也有类似的分子调控模式,但有待于进一步证明。
本研究的RNAi转基因植株花粉败育,结实率显著降低,有别于目前已报道的花粉不育变异材料。水稻(LOC_Os11g43640)是1个类伸展蛋白编码基因,不同于已克隆的花粉发育相关基因。综上分析可知,本研究所关注的水稻基因是调控水稻花粉发育的新基因,该基因的克隆和功能分析有助于进一步理解水稻花粉发育调控的分子遗传学机制。
[1] Rubinstein AL, Broadwater AH, Lowrey KB. Bedinger PA. Pex1, a pollen-specfic gene with an extensin-like domain., 1995,92(8): 3086–3090
[2] Baumberger N, Ringli C, Keller B. The chimeric leucine- rich repeat/extensin cell wall protein LRX1 is required for root hair morphogenesis in., 2001, 15(9): 1128–1139.
[3] Baumberger N, Doesseger B, Guyot R, Diet A, Parsons RL, Clark MA, Simmons, MP, Bedinger P, Goff SA, Ringli C, Keller B Whole-genome comparison of leucine-rich repeat extensins inand rice. A conserved family of cell wall proteins form a vegetative and a reproductive clad.,2003, 131(3): 1313–1326.
[4] Wang XX. Functional characterization ofpollen-specific expressed LRXs in pollen germination and pollen tube growth[Dissertation]., 2017. 王笑笑. 拟南芥花粉特异表达的LRXs蛋白在花粉萌发和花粉管生长过程中的功能研究[学位论文]. 河北师范大学, 2017.
[5] Lu ZX, Su L, Shan L, Bi YP. Research advances in LRR-Extensin family of., 2006, 34(23): 6148–6150.鲁朝霞,苏磊,单雷,毕玉平. 拟南芥LRR-Extensin蛋白家族的研究. 安徽农业科学, 2006, 34(23): 6148– 6150.
[6] Campbell L, Turner, SR. A Comprehensive analysis of RALF proteins in green plants suggests there are two distinct functional groups., 2017, 8: 37.
[7] Zhao CZ, Zayed O, Yu ZP, Jiang W, Zhu PP, Hsu Chuan-Chih, Zhang LR, Tao WA, Lozano-Durán R, Zhu Jian-Kang. Leucine-rich repeat extensin proteins regulate plant salt tolerance in., 2018, 115(51): 13123–13128.
[8] Ge Z, Bergonci T, Zhao Y, Zou Y, Du S, Liu MC, Luo X, Ruan H, Garcia-Valencia LE, Zhong S, Hou S, Huang Q, Lai L, Moura DS, Gu H, Dong J, Wu HM, Dresselhaus T, Xiao J, Cheung, AY, Qu LJ.pollen tube integrity and sperm release are regulated by RALF-mediated signaling., 2017, 358(6370): 1596–1600.
[9] Mecchia MA, Santos-Fernandez G, Duss NN, Somoza SC, Boisson-Dernier A, Gagliardini V, Martinez-Bernardini A, Fabrice TN, Ringli C, Muschietti JP, Grossniklaus U. RALF4/19 peptides interact with LRX proteins to control pollen tube growth in., 2017, 358(6370): 1600–1603.
[10] Herger A, Gupta S, Kadler G, Franck CM, Boisson- Dernier A, Ringli C. Overlapping functions and protein- protein interactions of LRR-extensins in., 2020, 16(6): e1008847.
[11] Marzol E, Borassi C, Bringas M, Sede A, Rodríguez Garcia DR, Capece L, Estevez JM. Filling the gaps to solve the extensin puzzle., 2018, 11(5): 645– 658.
[12] Nguyen QN, Lee YS, Cho LH, Jeong HJ, An G, Jung KH. Genome-wide identification and analysis of Catharanthus roseus RLK1-like kinases in rice., 2015, 241(3): 603–613.
[13] Nissen KS, Willats WGT, Malinovsky FG. Understanding CrRLK1L function: cell walls and growth control., 2016, 21(6): 516–527.
[14] Chen CJ, Chen H, Zhang Y, Thomas HR, Frank MH, He Y, Xia R. TBtools: An integrative toolkit developed for interactive analyses of big biological data., 2020, 13(8): 1194–1202.
[15] Wang YZ, Luo JL, Xu J, Liu XL. Agrobacterium-mediated genetic transformation and plant regeneration in rice., 2005, 20(1): 8–11.王玉珍, 罗景兰, 徐进, 刘香玲. 农杆菌介导的水稻遗传转化与植株再生. 华北农学报, 2005, 20(1): 8–11
[16] Zhang XQ,Zhou JS,Zhu HT,Li X Y,Zeng R Z.Genetic analysis and gene mapping of an early flowering and multi-ovary mutant in rice (L.)., 2008, 30(10): 1349–1355. 张向前,邹金松,朱海涛,李晓燕,曾瑞珍. 水稻早熟多子房突变体的遗传分析和基因定位. 遗传, 2008, 30(10): 1349–1355.
[17] Xie YY, Tang JT, Yang BW, Hu J, Liu YG, Chen LT.Current advance on molecular genetic regulation of rice fertility., 2019, 41(8): 703–715 谢勇尧, 汤金涛, 杨博文, 胡骏, 刘耀光, 陈乐天. 水稻育性调控的分子遗传研究进展. 遗传, 2019, 41(8): 703–715.
[18] Ma H. Molecular genetic analyses of microsporogenesis and microgametogenesis in flowering plants., 2005, 56: 393–434.
[19] Pacini E, Guarnieri M, Nepi M. Pollen carbohydrates and water content during development, presentation, and dispersal: a short review., 2006, 228(1–3): 73–77.
[20] Yamagata Y, Yamamoto E, Aya K, Win K T, Doi K, Sobrizal, Ito T, Kanamori H, Wu J, Matsumoto T, Matsuoka M, Yoshimura A. Mitochondrial gene in the nuclear genome induces reproductive barrier in rice., 2010, 107(4): 1494–1499.
[21] Ueda K, Yoshimura F, Miyao A, Hirochika H, Nonomura K, Wabiko H.gene encoding the arabinokinase-like protein is involved in pollen development in rice., 2013, 162(2): 858– 871.
[22] Zhou SR, Wang Y, Li WC, Zhao ZG, Ren YL, Wang Y, Gu SH, Lin QB, Wang D, Jiang L, Su N, Zhang X, Liu LL, Cheng ZJ, Lei CL, Wang JL, Guo XP, Wu FQ, Ikehashi H, Wang HY, Wan JM . Pollen semi-sterility1 encodes a kinesin-1-like protein important for male meiosis, anther dehiscence, and fertility in rice., 2011, 23(1): 111–129.
[23] Wu LN, Guan YS, Wu ZG, Yang K, Lv J, Converse R, Huang YX, Mao JX, Zhao Y, Wang ZW, Min HQ, Kan DY, Zhang Y.encodes a membrane protein that plays an important role in anther cuticle and pollen exine formation in rice., 2014, 33(11): 1881–1899.
[24] Tang JY, Chu CC. MicroRNAs in crop improvement: fine-tuners for complex traits., 2017, 3(7): 17077
[25] Glover J, Grelon M, Craig S,Chaudhury A, Dennis E. Cloning and characterization offrom: a gene critical in male meiosis., 1998, 15(3): 345–356.
[26] Zhang PF, Song YL, Zhang GS, Zhao XL, Ba QS, Liu HZ, Zhu WW, Li ZK, Wang JW, Niu N.Relationship between abnormal metabolism of tapetum and microspore abortion in male sterile line of wheat.. 2014, 47(09): 1670–1680. 张鹏飞, 宋瑜龙, 张改生, 赵新亮, 巴青松, 刘红占, 祝万万, 李志宽, 王军卫, 牛娜. 小麦雄性不育系绒毡层异常代谢与小孢子败育的关系. 中国农业科学, 2014, 47(09): 1670–1680.
[27] Jung KH, Han MJ, Lee DY, Lee YS, Schreiber L, Franke R, Faust A, Yephremov A, Saedler H, Kim YW, Hwang I, An G. Wax-deficient anther1 is involved in cuticle and wax production in rice anther walls and is required for pollen development., 2006, 18(11): 3015–3032.
[28] Li N, Zhang DS, Liu HS, Yin CS, Li XX, Liang WQ, Yuan Z, Xu B, Chu HW, Wang J, Wen TQ, Huang H, Luo D, Ma H, Zhang DB. The rice tapetum degeneration retardation gene is required for tapetum degradation and anther development., 2006, 18(11): 2999–3014.
[29] Li L, Li B, Xie C, Zhang T, Borassi C, Estevez JM, Li XS, Liu X.RAD23B regulates pollen development by mediating degradation of KRP1., 2020, 71(14): 4010–4019.
[30] Wang B, Fang RQ, Zhang J, Han JL, Chen FM, He FR, Liu YG, Chen LT. Rice LecRK5 phosphorylates a UGPase to regulate callose biosynthesis during pollen development., 2020, 71(14): 4033–4041.
[31] Ma L, Xu W, Dou LL, Ke XN, Liu MY, Geng YF, Huang X, Jia YF, Liu QP.Research progress on pollen fertility- related genes in rice (L.),2019, 47(10): 42–47. 马龙, 徐薇, 窦玲玲, 柯笑楠, 刘明月, 耿艳飞, 黄霞, 贾玉芳, 刘庆坡. 水稻花粉育性相关基因研究进展. 江苏农业科学,2019, 47(10): 42–47.
[32] Sede AR, Borassi C, Wengier DL, Mecchia MA, Estevez JM, Muschietti JP.pollen extensins LRX are required for cell wall integrity during pollen tube growth., 2018, 592(2): 233–243.
[33] Fabrice TN, Vogler H, Draeger C, Munglani G, Gupta S, Herger AG, Knox P, Grossniklaus U, Ringl, C. LRX proteins play a crucial role in pollen grain and pollen tube cell wall development., 2018, 176(3): 1981– 1992.
[34] Wang XX, Wang KY, Yin GM, Liu XY, Liu M, Cao NN, Duan YZ, Gao H, Wang WL, Ge WN, Wang J, Li R, Guo Y. Pollen-expressed leucine-rich repeat extensins are essential for pollen germination and growth., 2018, 176(3): 1993–2006
[35] Borassi C, Sede AR, Mecchia MA, Salgado Salter JD, Marzol E, Muschietti JP, Estevez JM. An update on cell surface proteins containing extensin-motifs., 2016, 67(2): 477–448.
Effect of extensin-like OsPEX1 on pollen fertility in rice
Hang Dai, Yan Li, Shunchun Liu, Lei Lin, Juanyan Wu, Zhijie Zhang, Qichun Peng, Nan Li, Xiangqian Zhang
LRXs (leucine-rich repeat extensins) are chimeric cell wall proteins containing an N-terminal leucine-rich repeat (LRR) and a C-terminal extensin domain. Increasing evidences suggest that LRXs family genes play important roles in pollen germination and pollen tube growth in. However, the functions of rice (L.) LRX genes in pollen development remain poorly understood. Bioinformatics analysis showed that the rice LRX gene family consist of eight members, namely,andlocated on chromosome 1,, O,andlocated on chromosome 2, 5, 6, 11 and 12, respectively. Thegene is preferentially expressed in rice anther, suggesting that itmay be involved in the regulation of pollen development. Next, we further investigated the role of thegene in rice by knockdown of its expression using an RNAi approach. TheRNAi transgenic lines showed a significant decrease in seed setting rate (10%~30%) due to pollen sterility. Further quantitative RT-PCR analysis indicated that thegene was significantly down-regulated in the RNAi transgenic lines. The results indicate that theplays an important role in the regulation of rice pollen development. Further studies on this gene could provide insights on the molecular and genetic mechanisms in this developmental process.
rice; leucine-rich repeats extensins; pollen fertility
2020-09-17;
2020-12-15
国家自然科学基金面上项目(编号:31671594)资助[Supported by the National Natural Science Foundation of China (No. 31671594)]
代航,在读硕士研究生,专业方向:农艺与种业。E-mail: 398035743@qq.com
张向前,博士,教授,研究方向:植物分子育种。E-mail: aacrav@163.com
10.16288/j.yczz.20-296
2021/3/2 17:09:27
URI: https://kns.cnki.net/kcms/detail/11.1913.r.20210302.1123.001.html
(责任编委: 储成才)

