编辑MSTN半胱氨酸节基元促进两广小花猪肌肉生长
彭定威,李瑞强,曾武,王敏,石翾,曾检华,刘小红,陈瑶生,何祖勇
研究报告
编辑MSTN半胱氨酸节基元促进两广小花猪肌肉生长
彭定威1,李瑞强1,曾武1,王敏1,石翾1,曾检华2,刘小红1,陈瑶生1,何祖勇1
1. 中山大学生命科学学院,有害生物控制与资源利用国家重点实验室,广州 510006 2. 广东壹号食品股份有限公司,广州 510620
肌生长抑制素(myostatin, MSTN)是转化生长因子β (transforming growth factor-β, TGF-β)家族成员之一,是一种肌肉生长抑制因子。解除MSTN的生长抑制功能是提高畜禽肌肉产量的一种有效途径。TGF-β的半胱氨酸节结构基元(cystine knot motif) 能够稳定MSTN蛋白结构,对MSTN生物学功能的发挥具有重要调控作用。本研究应用CRISRP/Cas9基因编辑技术在两广小花猪肾细胞(Liang Guang small spotted pig kidney cells, LPKCs)中对基因外显子3进行编辑,破坏了其半胱氨酸节基元,以解除MSTN对靶基因的抑制功能。将流式分选获得的混合阳性MSTN编辑LPKCs作为供体细胞进行核移植和胚胎移植,获得8头基因编辑两广小花猪仔猪,其中2头存活至10日龄,经鉴定这2头均为基因编辑杂合子,它们在构成MSNT蛋白半胱氨酸节基元的两个半胱氨残基C106和C108编码序列附近分别发生碱基的缺失与替换,导致移码突变,使C106和C108突变为其他氨基酸。基因编辑两广小花猪杂合子肩部和臀部肌肉较为发达。H&E切片分析显示,基因编辑猪肌纤维横截面积显著减少,肌纤维数量显著增多。Western Blot分析结果显示,C106和C108缺失对MSTN蛋白表达无显著性影响,但显著促进其靶基因和等成肌相关因子的表达。本研究获得的基因编辑猪模型没有造成MSTN表达完全缺失,可保留MSTN其他生物学功能,在促进两广小花猪肌肉生长的同时还消除了MSTN完全缺失可能对小花猪造成的潜在影响。
;CRISPR/Cas9;两广小花猪;基因编辑
肌肉生长抑制素(myostatin, MSTN),又称生长与分化因子8 (growth and differentiation factors 8, GDF8),属于转化生长因子β超家族(transforming growth factor-β, TGF-β)成员,是肌肉生长发育的负调控因子[1]。敲除基因的小鼠()体重显著增加,肌肉肥大,肌纤维数量显著增多[2]。研究表明,在人()、绵羊()、牛()和狗()等多个物种中发生删除或点突变,均可表现出骨骼肌显著增加的表型[3~6]。基因由3个外显子和2个内含子组成[7]。猪()基因定位于15号染色体上,全长6.7 kb,cDNA 序列长度为1756 bp,表达的MSTN蛋白前体由375个氨基酸组成[8]。与转化生长因子TGF-β超家族其他成员相似,MSTN首先由内质网核糖体合成出一条52 kDa的无活性前体肽,含有起分泌作用的信号肽、N端前导肽(26 kDa)和C端成熟肽(12.5 kDa)[9]。MSTN前体肽需经过一系列水解加工后才能形成具有生物学活性的成熟蛋白:首先由信号肽酶切除由24个氨基酸组成的信号肽;然后由弗林转化酶在N端前导肽和C端成熟肽之间的精氨酸–丝氨酸–精氨酸–精氨酸位点切割,产生N端前导肽和C端成熟肽,但两者仍然以非共价键结合,形成无活性的潜伏型蛋白[10];最后,无活性的潜伏型蛋白的N端前导肽在胞外经金属蛋白酶BMP1/Tolloid的剪切激活,释放出有活性的C端成熟肽[11]。C端成熟肽通过二硫键形成二聚体,成熟肽中的9个半胱氨酸残基形成TGFβ超家族特有的半胱氨酸节基元(cystine knot motif),是MSTN与受体结合所必需的一种结构,它能够通过影响MSTN的稳定性和共价二聚性来抑制其作为肌肉生长分化负调控因子的作用[12]。皮埃蒙特牛(Piedmontese cattle)MSTN蛋白313位的半胱氨酸突变会产生双肌表型,与野生型MSTN蛋白相比,C313Y突变的MSTN蛋白的共价二聚化显著降低,同时结构稳定性下降,对其他半胱氨突变体C313A和C374A的生化分析表明,完整的半胱氨酸结基序是MSTN稳定性和共价二聚的主要决定因素[13]。
利用CRISPR/Cas9 (clustered regularly interspaced short palindromic repeats/CRISPR associated proteins 9)敲除可显著提高中国地方猪种的产肉量[14],但表达缺失使其丧失其他重要的生物学功能,可能会对基因敲除猪健康造成潜在的不利影响。因此,利用CRISPR/Cas9对中国地方猪种MSTN的半胱氨酸节基元进行修饰是否能够获得类似皮埃蒙特牛基因C313Y突变所产生的促进肌肉生长的效果,值得进行研究。两广小花猪属于我国华南型地方猪种,具有肉质鲜美、肉色鲜红、肌内脂肪含量高、系水力强和肌纤维直径小等优点,但也存在生长速度缓慢和产肉量偏低的缺点[15]。因此,本研究利用CRISPR/Cas9对MSTN的半胱氨酸节基元进行编辑,分析其对两广小花猪肌肉生长的影响,以期为今后培育高产肉量的两广小花猪新品种提供研究基础。
1 材料与方法
1.1 材料
两广小花猪肾细胞系(Liang Guang Small Spotted pig kidney cells, LPKCs)由本实验室建立保存,CRISPR/Cas9表达质粒pSpCas9(BB)-2A-GFP (pX458) (Plasmid #48138)购自美国Addgene组织。
1.2 靶向MSTN基因外显子3的CRISPR/Cas9表达载体构建与活性验证
靶向基因外显子3的sgRNA3-3设计及其在两广小花猪胎儿成纤维细胞(porcine embryonic fibroblast, PEF)中的活性验证参考本团队前期的报道[14]。sgRNA3-3的靶位点具体序列见图1。
1.3 两广小花猪肾细胞(LPKCs)培养
从液氮罐中取出需要复苏的LPKCs,根据“缓冻速融”原则,将取出的细胞迅速置于预热好的37℃水浴锅,2~3 min后待冻存液完全融化,将冻存管内的细胞转移至1.5 mL离心管内,并加入1 mL的DMEM稀释冻存液中的DMSO浓度,降低对复苏后细胞的伤害。1000×离心去除上清液后加入含有10%胎牛血清的DMEM培养液,混匀后接种到培养瓶中进行培养,复苏约24 h 后更换新鲜培养液。待细胞密度为80%~90%左右进行传代培养。
1.4 质粒载体转染
准备好待转染质粒pX458-gRNA3-3后,选取生长状态良好的10代以内的LPKCs,确定细胞数量(每100 μL体系需要细胞数目为100万个左右)。电转染参数设置为1400 V、10 ms、3次脉冲进行电转染。将电转后的LPKCS接种至6孔板中,轻轻混匀,放入37℃细胞培养箱中培养,24 h后荧光显微镜下观察拍照,48 h后待状态良好时进行流式分选。
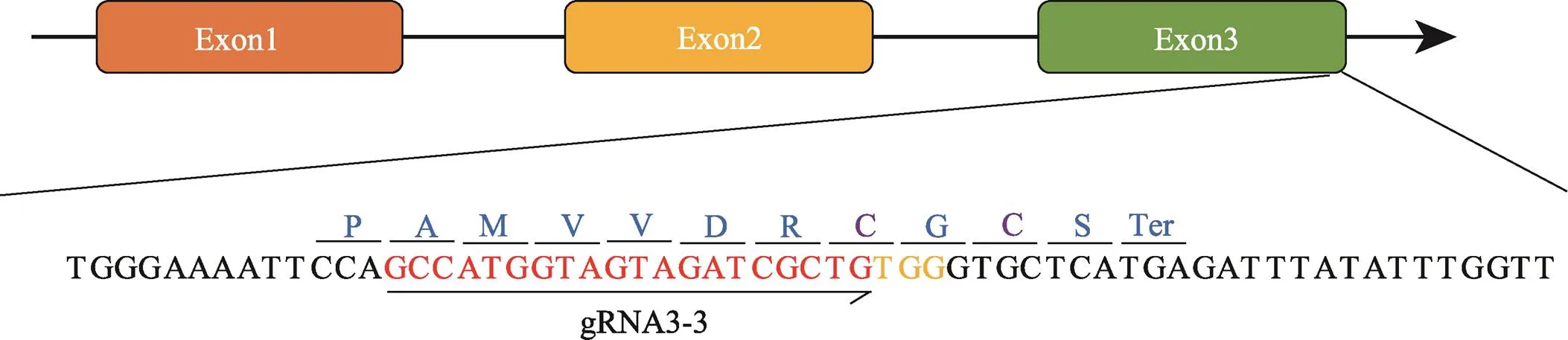
图1 MSTN基因结构和gRNA序列
红色DNA序列为设计的gRNA序列,黄色字体表示PAM位点;紫色氨基酸为参与形成半胱氨酸结节结构基元的半胱氨酸残基。
1.5 流式分选获得增强型绿色荧光蛋白(enhanced green fluorescent protein, EGFP)阳性细胞
准备好待分选的转染后的LPKCs和未转染的阴性对照LPKCs。用阴性对照LPKCs对流式细胞仪进行校准,设置分选参数,将转染后的细胞中EGFP阳性细胞分选出来,收集到预先加入培养基的6孔板中,放入37℃细胞培养箱中培养;24 h后换液,此后按细胞培养的方法进行培养传代。流式分选后,扩大培养分选出的细胞,待细胞长至足够量时,分离一部分提取基因组,进行T7E1实验和TA克隆实验。
1.6 T7E1实验验证打靶效率
设计引物-E3 (F: 5′-AGGGTAGGAAAGTGATTCAGGATC-3′;R: 5′-GTAGCATACTCCAGGCATGTAGC-3′)扩增打靶位点,经过琼脂糖凝胶电泳鉴定扩增片段大小,通过胶回收得到纯化的PCR产物,将其置于95℃变性10 min,然后按–5℃/1 min的降温速度下降至25℃,完成程序性退火,接着在反应体系中加入0.5 μL T7E1酶,置于37℃水浴30 min。酶切产物在10% PAGE胶中经120 V恒压电泳90 min。电泳结束后小心取出PAGE胶,经EB溶液染色15 min后,使用蒸馏水漂洗3次,置于凝胶成像仪中拍照;Image J软件扫描电泳条带灰度值,根据公式
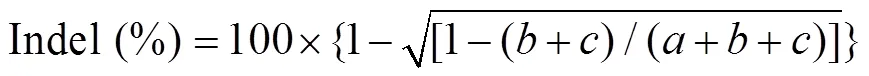
计算打靶效率,其中、为切割峰面积,为主峰面积[16]。
1.7 TA克隆验证编辑效率
将得到的纯化PCR产物经TA克隆连接到pMD-18T载体上。将连接产物转化进大肠杆菌DH5α中,LB摇菌1 h,涂板37℃培养过夜,挑取单克隆摇菌送测,测定20个单克隆。将测序结果与野生型猪基因组进行比对,确定CRISPR/Cas9在基因中诱导产生的突变位置和突变类型。计算发生编辑的克隆占总测序克隆数的百分比,得出基因编辑效率。
1.8 MSTN基因编辑克隆猪的生产
从屠宰场采集母猪卵巢,用37℃的生理盐水清洗,从卵巢中分离出卵母细胞进行体外成熟培养,然后选择成熟的卵母细胞进行体细胞核移植。将编辑型的LPKCs放入含有透明质酸酶和细胞松弛素的核移植操作液内,卵母细胞则放入另一邻近的含7.5 μmol/mL细胞松弛素B (cytochalasin B, CCB)的操作液滴内,并用矿物油覆盖操作液滴,以防止水分蒸发。在显微注射仪下,吸除卵母细胞的细胞核及第一极体,并用注射针在去核的位置向卵母细胞的卵周隙注入状态良好的单个LPKCs。然后用融合仪以1.2 kV/cm的单个直流电脉冲电击30 ms,使卵质与供体细胞融合并激活胚胎发育。融合后,转移到PZM-5培养液中继续培养。待发育到2-细胞期后,挑选发育状态较好的胚胎,进行胚胎移植。选取经产的待孕大白母猪,通过手术法将2-细胞期克隆胚胎植入输卵管中,30 d后经B超检查胚胎发育情况,怀孕约114 d后接产。
1.9 新生仔猪基因型鉴定
剪取刚出生的基因编辑克隆猪耳样组织并进行标记编号如3-1等。取5 mg耳样组织按Omega组织DNA提取试剂盒(美国Omega Bio-tek公司)说明书操作步骤提取组织DNA。利用-E3引物对扩增打靶位点序列,通过琼脂糖凝胶电泳检测扩增产物,并通过TA克隆测序鉴定基因编辑克隆猪基因型。
1.10 基因编辑克隆猪背最长肌H&E染色
选取10日龄基因编辑猪和野生型猪各一头,屠宰后取背最长肌组织,在4%多聚甲醛中4℃固定24 h,然后转移至70%的酒精中,并放入4℃冰箱进行长期保存。利用自动脱水机对固定的肌肉组织进行脱水,并使用石蜡包埋机进行包埋,包埋好的石蜡块用切片机进行切片。在进行H&E染色前需进行脱蜡复水处理,即先将切片置于烘箱中65℃烘烤30 min,随后将切片分两次浸泡于两缸二甲苯中脱蜡,每次10 min。脱蜡完成后进行梯度浓度乙醇复水,复水完成后进行H&E染色。染色结束后进行脱水处理并晾干,最后采用中性树胶进行封片,置于显微镜下观察拍照。
1.11 Western Blot
选取10日龄基因编辑猪和野生型猪各一头,取背最长肌组织样品提取总蛋白,使用12%的PAGE胶进行电泳分离蛋白,按照80 V×30 min和120 V×60 min 的程序进行电泳。电泳结束后转膜,按25 V恒压条件转膜35 min。转膜完成后,迅速将PVDF膜取出浸入3% BSA溶液中,放在摇床上室温封闭1 h,后将膜放入含有一抗的溶液中,置于摇床上,以60 r/min,4℃孵育过夜;次日将膜取出放入TBST中,置于摇床上,室温下,以120转/min漂洗4次,每次5 min;然后将膜放入含有二抗的溶液中,置于摇床上,室温下,以60 r/min孵育1 h;孵育完成后,将膜放入TBST中,置于摇床上,室温下,以120 r/min漂洗4次,每次5 min。按照1∶1的比例配制ECL曝光液,将膜平铺在曝光板上,加上曝光液曝光,于BLT GelView 6000 Pro曝光成像仪中进行曝光拍照。本研究中使用的一抗包括 anti-MSTN (abcam)、anti-Myf5 (abcam)、anti-MyoD (abcam)、anti-Myogenin (abcam)和anti-GAPDH (abcam),稀释比皆为1∶500;二抗包括anti-Mouse (abcam)和anti-Rabbit (abcam),稀释比皆为1∶5000。
1.12 统计分析
定量实验包括至少3个独立重复。数据以均数±标准差(SD)表示。数据分析采用检验或单因素方差分析,再进行邓肯检验。
2 结果与分析
2.1 LPKCs中高效编辑MSTN基因
分选得到的EGFP阳性LPKCs继续培养至48 h,取一部分细胞提取基因组DNA,利用引物对-E3进行PCR扩增靶位点序列,然后通过T7E1酶切实验检测pX458-sgRNA3-3的打靶效率。结果显示,sgRNA3-3打靶效率为17.2% (图2)。TA克隆测序结果显示,sgRNA3-3的打靶效率为33.3% (图3)。
2.2 高效获得MSTN基因编辑两广小花猪
将981枚克隆胚胎移植到5头代孕母猪体内,最终有4头母猪怀孕到终期,分娩出13头克隆猪,其中12头活仔,编辑型两广小花猪的初生重为0.885±0.3 kg,野生型两广小花猪初生重为0.725± 0.2 kg,两者体重无差异显著性(= 0.3303),24 h后剩余10头健仔(表3)。出生的12头活仔,经基因型鉴定,有8头是编辑个体,编辑效率达66.7% (图4)。
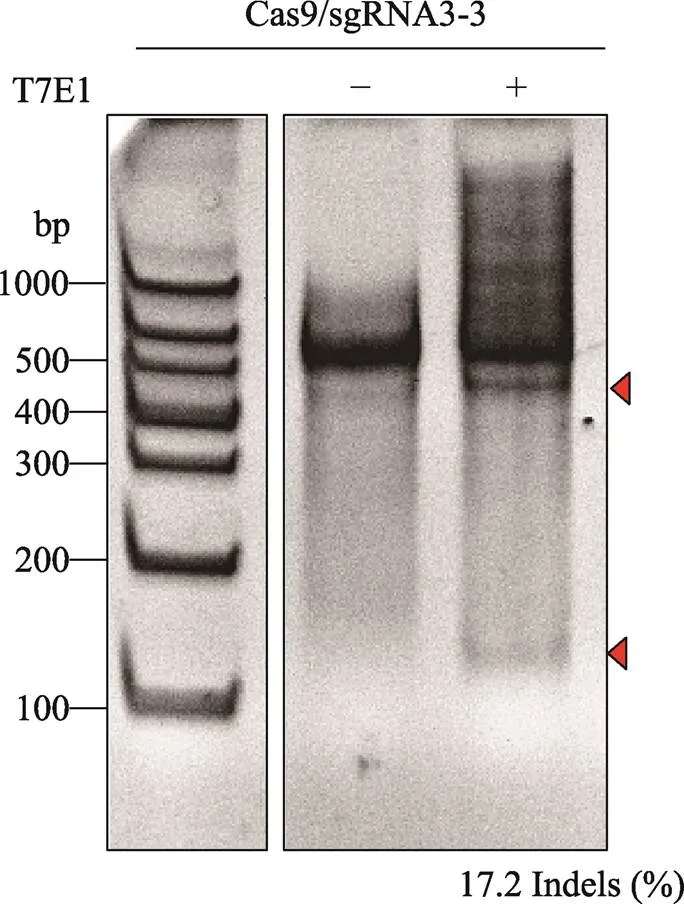
图2 T7E1酶切鉴定结果
M:DNA Marker;箭头代表T7E1酶切后预期产物所在位置;Indel(%)表示随机插入或缺失的比例。

图3 sgRNA打靶效率测序结果
MSTN gRNA3-3诱导产生的随机插入与缺失的效率达33.3%(6/20)。红色字母表示sgRNA序列;黄色字母表示PAM序列;虚线代表缺失碱基;WT:野生型序列;+:碱基插入,–:碱基缺失。
出生后第10 d,只剩下3头存活仔猪,处死两头偏弱的个体进行采样。最后一头编辑猪3周后死亡。与野生型相比,编辑猪的肩部和臀部、背部肌肉较为发达(图5)。基因型鉴定结果显示,3-1为野生型;3-2的一个等位基因发生2 bp缺失(c.1113_ 1114del),导致翻译产物中含有半胱结基序的C-G-C-S-Ter突变为W-V-L-M,并产生一段含有45个氨基酸的延长序列;3-3则为一个等位基因发生1 bp插入以及一个G碱基替换为A碱基,结果导致翻译产物中含有半胱结基序的C-G-C-S-Ter突变为L-L-W-V-L,并产生一段含有46个氨基酸的延长序列,两者皆导致MSTN成熟肽C端的半胱氨酸结基序的破坏(图6)。

表3 SCNT产生的MSTN编辑猪
*仅展示出生第1 d健康猪的数据。

图4 MSTN基因编辑两广小花猪基因型鉴定
红色字母表示sgRNA序列;黄色字母表示PAM序列;虚线代表缺失的碱基;WT:野生型序列;3-1至3-12代表同一窝的12个不同的个体,WT序列下方的数字表示每一个体所测的TA克隆数。
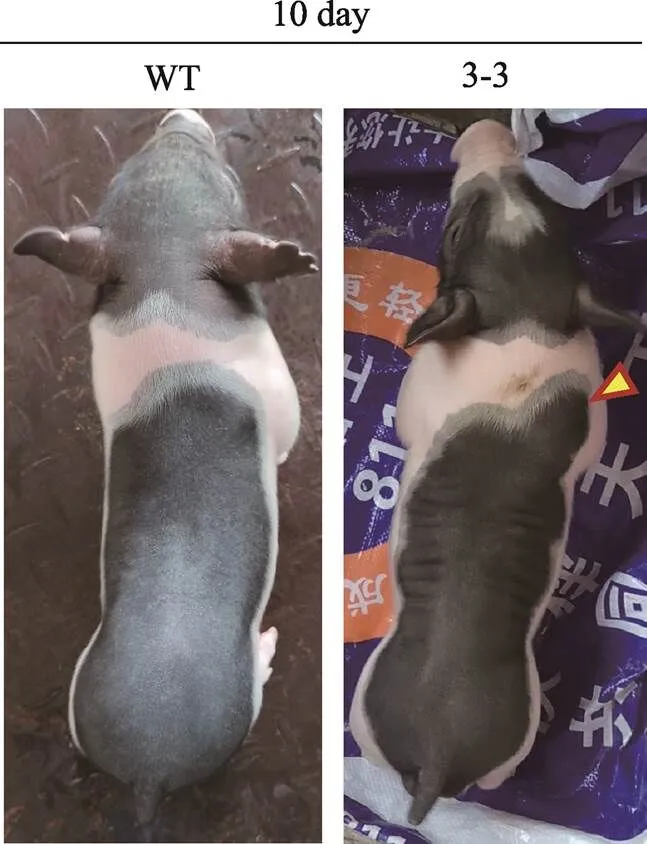
图5 MSTN基因编辑两广小花猪表型
黄色箭头表示基因编辑型猪比野生型猪肌肉发达的部位;WT:野生型;3-3为基因编辑猪;10 day表示日龄。
2.2 MSTN基因编辑猪杂合子的肌纤维数量显著增多
对10日龄基因外显子3编辑型两广小花猪杂合子3-3及其野生型小花猪3-1的肩胛部位的三角肌进行H&E切片染色,肌纤维数量通过随机选取3个单位面积(mm2)的横截面切片视角,采用软件Photoshop进行肌纤维计数,并使用显微镜相机自带软件进行肌纤维面积统计。结果显示,基因编辑两广小花猪杂合子肌纤维数量显著大于野生型猪,而肌纤维面积显著小于野生型猪 (图7),表明破坏MSTN蛋白C端的半胱氨酸结基序可显著促进肌纤维增生。
2.3 MSTN基因编辑猪杂合子的成肌调控因子表达显著上调
取10日龄野生型(3-1)和编辑杂合子(3-2)的背最长肌肉组织,通过Western Blot检测MSTN及关键成肌调控因子的表达水平。Western Blot结果则采用软件Image J扫描3次重复实验结果中条带的灰度值,进行统计分析。结果显示,与对照相比,编辑猪的MSNT表达无显著性变化,但是其关键成肌调控因子Myf5、MyoD和Myogenin的表达水平均显著上调(图8),表明破坏MSTN蛋白C端的半胱氨酸结基不影响MSTN蛋白表达,但可显著提高成肌分化潜能。

图6 MSTN基因编辑猪基因型鉴定结果
红色字母表示sgRNA序列;黄色字母表示PAM序列;虚线代表缺失的碱基;个体编号后的括号内显示的是基因型,个体编号下方括号内显示推测的翻译后蛋白序列型;WT:野生型序列,WT序列下方的数字表示每一个体所测的TA克隆数。
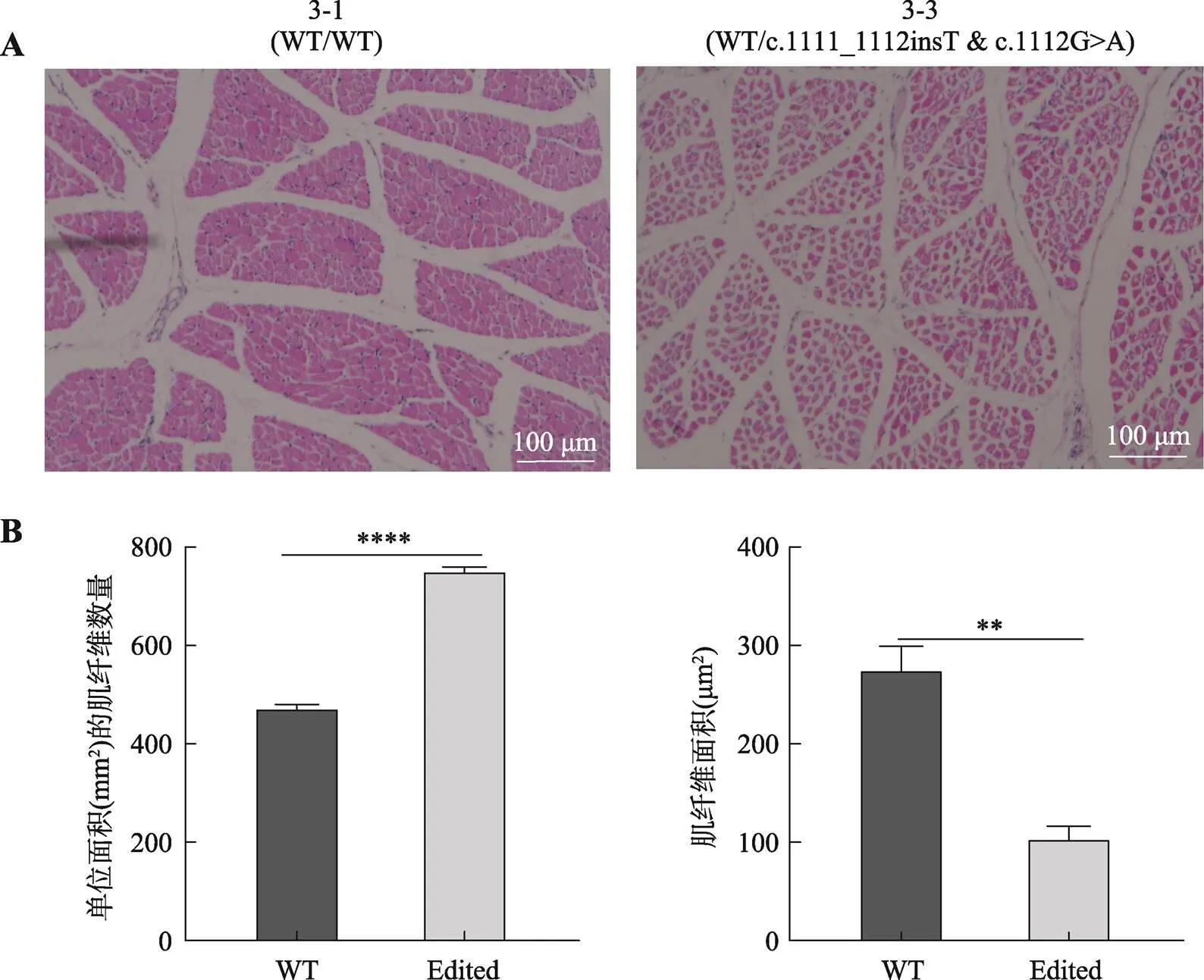
图7 10日龄外显子3编辑猪肌纤维H&E染色结果
A:肌肉横截面切片HE染色图。3-1、3-2表示野生型及克隆猪的编号;标尺=100 μm。B:肌纤维数量和肌纤维面积统计柱状图;**:<0.01,****:<0.0001;WT:野生型两广小花猪(3-1);Edited:编辑型两广小花猪(3-3)。
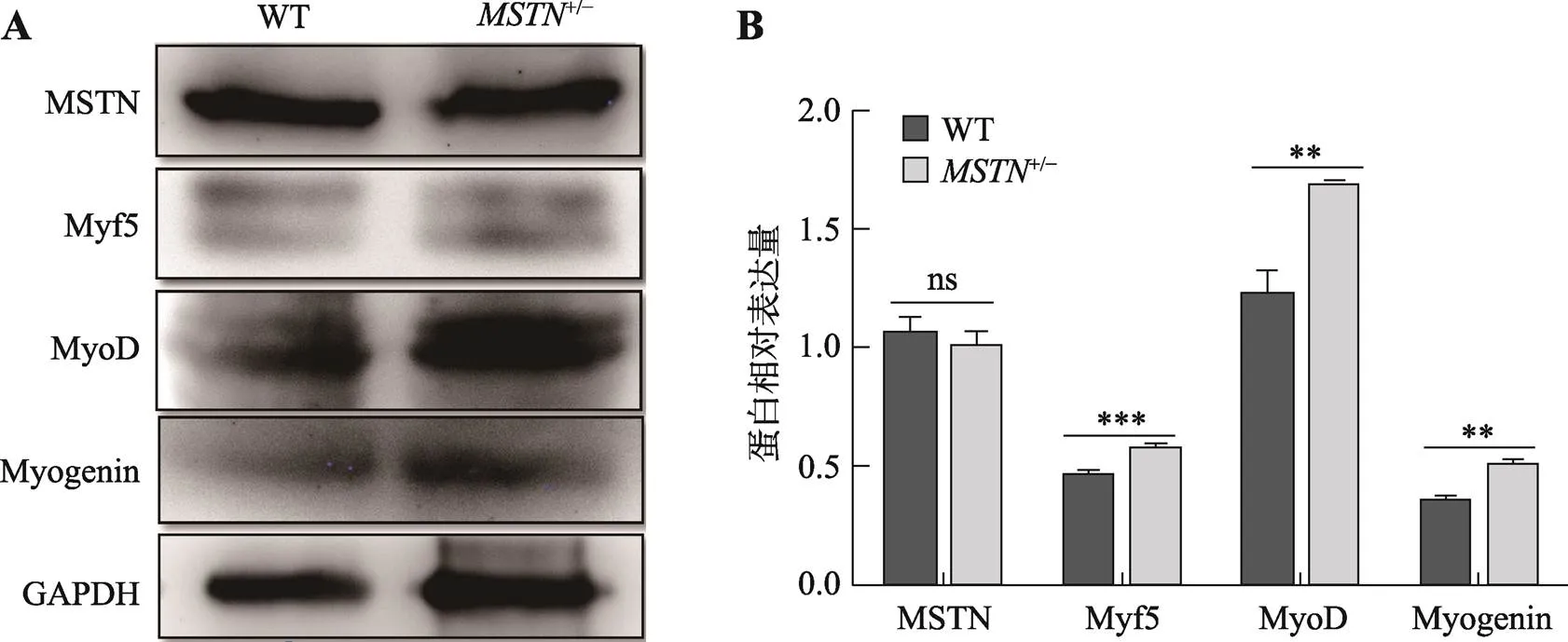
图8 Western Blot检测MSTN及关键成肌调控因子的蛋白表达量
A:Western Blot检测结果。WT为野生型,+/–为杂合子基因编辑猪,左侧为条带对应的蛋白名称。B:蛋白条带灰度扫描统计结果;ns:>0.05,**:<0.01,***:<0.001。
3 讨论
本研究利用CRISPR/Cas9对两广小花猪MSTN蛋白C端的半胱氨酸节基元进行编辑,以EGFP阳性的混合细胞群作供体进行核移植,获得的12头活仔中有8头是基因编辑个体,编辑效率达66.7%,与本团队前期利用类似方法获得基因编辑猪效率相当[17]。本研究中基因编辑两广小花猪在出生后存活率较低,仅有3头存活到10日龄以上,这可能跟代孕猪场是专业饲养瘦肉型商品猪,饲养员对两广小花猪新生仔猪的护理缺乏经验,以及该品种易患喘气综合征等因素相关,这与本团队前期构建的基因编辑两广小花猪模型出现的高死亡率情况类似[17]。但是MSTN蛋白C端的半胱氨酸节基元的编辑是否也对两广小花猪的死亡造成影响,有待后续深入研究。
对一头存活到10日龄的基因外显子3编辑杂合子的肌肉组织进行切片,分析结果表明破坏MSTN蛋白C端的半胱酸节基元可显著促进肌纤维增生,达到与基因双敲除类似的效果[18]。通过Western Blot对MSTN及成肌调节因子的分子表达水平进行分析,结果表明破坏MSTN蛋白C端的半胱酸节基元不影响MSTN蛋白的表达,但可显著促进关键成肌调节因子的蛋白表达,这与皮埃蒙特牛中基因半胱氨酸节基元中发生的C313Y突变不影响MSTN蛋白表达,但却能显著增强其肌肉发育相似[19],表明改变MSTN半胱氨酸节基元可显著促进动物肌肉生长发育。本研究的基因编辑并没有完全敲除,而只改变了MSTN的半胱氨酸节基元,显著促进了肌纤维增生,同时有可能保留了MSTN的其他重要生物学功能,有利于维持家猪的生理健康,为培育高产肉量的两广小花猪提供研究基础。
[1] Walker RG, Poggioli T, Katsimpardi L, Buchanan SM, Oh J, Wattrus S, Heidecker B, Fong YW, Rubin LL, Ganz P, Thompson TB, Wagers AJ, Lee RT. Biochemistry and biology of GDF11 and myostatin: similarities, differences, and questions for future investigation., 2016, 118(7): 1125–1142.
[2] McPherron AC, Lawler AM, Lee SJ. Regulation of skeletal muscle mass in mice by a new TGF-beta superfamily member., 1997, 387(6628): 83–90.
[3] Grobet L, Martin LJ, Poncelet D, Pirottin D, Brouwers B, Riquet J, Schoeberlein A, Dunner S, Ménissier F, Massabanda J, Fries R, Hanset R, Georges M. A deletion in the bovine myostatin gene causes the double-muscled phenotype in cattle., 1997, 17(1): 71–74.
[4] Clop A, Marcq F, Takeda H, Pirottin D, Tordoir X, Bibé B, Bouix J, Caiment F, Elsen JM, Eychenne F, Larzul C, Laville E, Meish F, Milenkovic D, Tobin J, Charlier C, Georges M. A mutation creating a potential illegitimate microRNA target site in the myostatin gene affects muscularity in sheep., 2006, 38(7): 813–818.
[5] Mosher DS, Quignon P, Bustamante CD, Sutter NB, Mellersh CS, Parker HG, Ostrander EA. A mutation in the myostatin gene increases muscle mass and enhances racing performance in heterozygote dogs., 2007, 3(5): e79.
[6] Catipović B. Myostatin mutation associated with gross muscle hypertrophy in a child., 2004, 351(10): 1030–1031.
[7] Lee SJ, McPherron AC. Regulation of myostatin activity and muscle growth., 2001, 98(16): 9306–9311.
[8] Sonstegard TS, Rohrer GA, Smith TP. Myostatin maps to porcine chromosome 15 by linkage and physical analyses., 1998, 29(1): 19–22.
[9] Thies RS, Chen T, Davies MV, Tomkinson KN, Pearson AA, Shakey QA, Wolfman NM. GDF-8 propeptide binds to GDF-8 and antagonizes biological activity by inhibiting GDF-8 receptor binding., 2001, 18(4): 251–259.
[10] Wolfman MW, McPherron AC, Pappano WN, Davies MV, Song K, Tomkinson KN, Wright JF, Zhao L, Sebald SM, Greenspan DS, Lee SJ. Activation of latent myostatin by the BMP-1/tolloid family of metalloproteinases., 2003, 100(26): 15842–15846.
[11] Lee SJ. Regulstion of muscle mass by myostatin., 2004, 20(1): 61–86.
[12] Kambadur R, Sharma M, Smith TP, Bass JJ. Mutations in myostatin (GDF8) in double-muscled Belgian Blue and Piedmontese cattle., 1997, 7(9): 910–916.
[13] Starck CS, Sutherland-Smith AJ. The C313Y Piedmontese mutation decreases myostatin covalent dimerisation and stability.. 2011, 4: 442.
[14] Wang M, Huang X, Shi X, Liu XF, Zeng JH, Liu XH, Chen YS, He ZY. Editing the MSTN gene of Guangdong Small Spotted pigs by using CRISPR-Cas9 system., 2017, 44(02): 141–148.王敏, 黄翔, 石翾, 刘小凤, 曾检华, 刘小红, 陈瑶生, 何祖勇. 应用CRISPR/Cas9编辑广东小耳花猪MSTN基因. 广东农业科学, 2017, 44(2): 141–148.
[15] Zhang ZG, Zhang XL, Li JY. The excellent breeding of Chinese pigs and its contribution to the world pig industry., 1994, 9(1): 1–8.张仲葛, 张晓岚, 李锦钰. 中国猪的优良种性及其对世界养猪业的贡献. 自然资源学报, 1994, 9(1): 1–8.
[16] Ran FA, Hsu PD, Wright J, Agarwala V, Scott DA, Zhang F. Genome engineering using the CRISPR-Cas9 system., 2013, 8(11): 2281–2308.
[17] Liu XF, Liu HB, Wang M, Li RQ, Zeng JH, Mo DL, Cong PQ, Liu XH, Chen YS, He ZY. Disruption of the ZBED6 binding site in intron 3 of IGF2 by CRISPR/Cas9 leads to enhanced muscle development in Liang Guang Small Spotted pigs., 2019, 28(1): 141–150.
[18] Qian LL, Tang MX, Yang JZ, Wang QQ, Cai CB, Jiang SW, Li HG, Jiang K, Gao PF, Ma DZ, Chen YX, An XR, Li K, Cui WT. Targeted mutations in myostatin by zinc-finger nucleases result in double-muscled phenotype in Meishan pigs., 2015, 5: 14435.
[19] Berry C,Thomas M, Langley B, Sharma M, Kambadur R. Single cysteine to tyrosine transition inactivates the growth inhibitory function of Piedmontese myostatin., 2002, 283(1): C135–141.
Editing the cystine knot motif of MSTN enhances muscle development of Liang Guang Small Spotted pigs
Dingwei Peng1, Ruiqiang Li1, Wu Zeng1, Min Wang1, Xuan Shi1, Jianhua Zeng2, Xiaohong Liu1, Yaoshen Chen1, Zuyong He1
Myostatin (MSTN) is a member of the transforming growth factor-β (TGF-β) family, and functions as an inhibitor of muscle growth. Disrupting the inhibitory effect of MSTN on growth can provide an effective way to increase the muscle yield of livestock and poultry. The cysteine knot motif of TGF-β can stabilize the structure of MSTN protein and plays an important regulatory role in the biological function of MSTN. Accordingly, in this study, we used the CRISRP/Cas9 to edit the exon 3 of MSTN in the kidney cells of Liang Guang Small Spotted pig (LPKCs), in order to disrupt the cysteine knot motif of MSTN and remove the inhibitory effect of MSTN on its target genes.-edited LPKCs were obtained through fluorescence-activated cell sorting (FACS) and used as donor cells for somatic cell nuclear transfer (SCNT) to generate cloned embryos, which were then transferred to surrogate sows to finally obtain eight-edited Liang Guang Small Spotted piglets. Among them, two survived to 10 days old. Genotyping revealed that these two piglets were gene edited heterozygotes with base deletion and substitution occurred within the coding sequence of C106 and C108 at the cystine knot motif of MSTN. These changes resulted in frameshift mutations, and conversion of C106 and C108 to other amino acids. More developments of muscles were observed at the shoulders and hips of the heterozygotes of-edited Liang Guang Small Spotted pigs. H&E analysis showed that the cross-sectional area (CSA) of myofiber in-edited pigs was significantly decreased, and the number of myofiber were significantly increased. Western blot analysis showed that the disruption of C106 and C108 did not affect the expression of MSTN protein, but significantly up-regulated the expression of its target genes such as,,and other myogenic regulatory factors. In summary, the gene-edited pig model obtained in this study did not cause complete loss of MSTN expression, and could retain other biological functions of MSTN, thereby promoting muscle growth while minimizing the potential adverse effects on complete loss of MSTN in the Liang Guang Small Spotted pigs.
; CRISPR/Cas9; Liang Guang Small Spotted pig; gene editing
2020-07-15;
2020-12-24
国家转基因生物新品种培育重大专项(编号:2016ZX08006003-006)和广东省重点领域研发计划项目(编号:2018B020203003)资助[Supported by the National Transgenic Major Program (No. 2016ZX08006003-006) and the Key R&D Program of Guangdong Province (No. 2018B020203003)]
彭定威,在读硕士研究生,专业方向:生物化学与分子生物学。E-mail: 840450611@qq.com 李瑞强,在读硕士研究生,专业方向:生物化学与分子生物学。E-mail: 1584896796@qq.com曾武,在读硕士研究生,专业方向:生物化学与分子生物学。E-mail: 1045044813@qq.com彭定威、李瑞强和曾武为并列第一作者。
何祖勇,博士,副教授,研究方向:动物遗传与育种。E-mail: zuyonghe@foxmail.com
10.16288/j.yczz.20-222
2021/2/5 14:47:17
URI: https://kns.cnki.net/kcms/detail/11.1913.r.20210203.1205.002.html
(责任编委: 赵要风)

