三疣梭子蟹几丁质酶基因1 的克隆及功能鉴定*
宋 柳 张 凤 吕建建 刘 萍① 高保全 李 健
(1. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;2. 上海海洋大学 水产科学国家级实验教学示范中心 上海 201306)
几丁质(Chitin)是昆虫和甲壳动物外骨骼和围食膜的主要分子成分,是由β-1,4 糖苷键连接的N-乙酰-β-D-氨基葡萄糖直链多聚糖,其含量仅次于纤维素,为第二大天然多糖(Zhang et al, 2013; Qiang et al,2018)。几丁质酶(Chitinase)是广泛存在于动物、植物、真菌、细菌和病毒中的一种能够随机催化几丁质聚合物水解的酶(Adrangi et al, 2013; Umemoto et al,2013)。在甲壳动物中,几丁质酶在几丁质类食物的消化、蜕皮和应激反应等生理功能中起关键作用(Zou et al, 2004; Merzendorfer, 2006; Gao et al, 2017)。
几丁质酶基因是一个具有GH18 和GH19 两大家族的多基因家族(Gao et al, 2018; Gayathri et al,2018),目前,在隶属于GH18 家族的主要经济甲壳动物中均已开展了几丁质酶基因相关功能的研究,并且根据基因结构特征将其归为7 大类(Group1~7,其所属的基因也大多相应的命名为Cht1~7),但三疣梭子蟹(Portunus trituberculatus)几丁质酶基因仅发现了其中3 类,包括Group3(张凤等, 2017)、Group5(宋柳等, 2019)和Group7(张凤等, 2015),还有很多未知的基因有待发掘。甲壳动物Group1 几丁质酶基因多在肝胰腺中有较高表达,而肝胰腺是消化酶分泌的重要器官,表明其发挥着消化几丁质类食物的功能。Salma等(2012)在日本仿长额虾(Pandalopsis japonica)研究中发现,Pj-Cht1 主要在肝胰腺中表达,可能在几丁质类食物的消化中起作用。凡纳滨对虾(Litopenaeus vannamei) LvChi1 基因(Huang et al, 2010; Rocha et al,2012)和拟穴青蟹(Scylla paramamosain) (Zhou et al,2018) SpCht1 基因均在肝胰腺中特异性表达,推测其参与了几丁质类食物的消化。类似结果在中华绒螯蟹(Eriocheir sinensis) (Li et al, 2015)、日本对虾(Marsupenaeus japonicus) (Watanabe et al, 1996、1998)、斑节对虾(Penaeus monodon) (Proespraiwong et al, 2010)和中国对虾(Fenneropenaeus chinenis)(Priya et al, 2009)等物种中也有发现。此外,也有研究显示,在尾扇、眼柄、鳃等组织(Watanabe et al, 1997; Rocha et al, 2012)亦有几丁质酶Group1 基因的表达,暗示了其功能的多样性,可能参与了多种生理学进程。例如,日本沼虾(Macrobrachium nipponense) (Zhang et al,2014) MnCht1A 和MnCht1B 除了在肝胰腺中高表达外,在表皮和肠道中亦有少量分布,表明该基因可能还在肠内围食膜中内源几丁质的降解以及几丁质外骨骼的分解中起作用。然而,Group1 几丁质酶基因的结构及功能虽在其他虾蟹中有较多研究,但在三疣梭子蟹中相关的内容却鲜有报道。
本研究中,通过RACE 克隆、生物信息学分析及qRT-PCR 等方法对三疣梭子蟹PtCht1 基因的结构及功能进行探究,明确基因的分类,解析PtCht1 在促进消化等方面的功能,可为三疣梭子蟹几丁质酶GH18 家族Group1 基因的研究奠定基础,为耐低盐新品种的培育提供新思路。
1 材料与方法
1.1 实验材料
实验材料取自中国水产科学研究院黄海水产研究所实验基地—山东潍坊昌邑市海丰水产有限公司养殖的健康三疣梭子蟹,湿重为(5.78±1.11) g。室内养蟹池4 个,体积均为20 m3,每池150 只蟹,暂养7 d。盐度33、pH 8.7 的自然海水养殖,水温控制在(25±1)℃,保持氧气供应充足,每天定时更换1/3 水量,每天 18:00 定时投喂新鲜蓝蛤(Potamocorbula laevis)。
1.2 全长cDNA 的克隆及测序
随机取8 只(雌雄各4 只)暂养后四肢健全且充满活力的健康三疣梭子蟹,解剖取样,包括心脏、肝胰腺、肠、鳃、胸神经节、肌肉、脑、眼柄、胃、表皮、精巢和卵巢,液氮冷冻后,将所有样品的同一组织混合后进行研磨,Trizol 法提取总RNA,通过Thermo的NanoDrop 2000 核酸定量仪与1%琼脂糖凝胶电泳检测其完整性,选取高质量的总 RNA,混匀后用SMARTTMRACE Amplification Kit 合成用于3ʹ和5ʹ RACE 的cDNA 模板。依据三疣梭子蟹高通量测序数据库中 PtCht1 的已知表达序列标签(Expressed Sequence Tag, EST),运用Primer Premier 5.0 软件设计3ʹ和5ʹRACE 特异性引物(PtCht1 F 和PtCht1 R)、通用引物(UPM)和ORF 验证引物(PtCht1 Fi 和PtCht1 Ri)(表1)。利用Advantage 2 PCR Kit 对3ʹ和5ʹ末端进行扩增。纯化后的扩增产物与pMD18-T 载体连接后转入DH5α 大肠杆菌感受态细胞中扩大培养,挑取阳性单克隆,利用DNA 测序通用引物M13-47/48 进行菌落PCR 鉴定,将目的产物送至睿博生物公司进行测序。利用Vector NTI 11.0 去掉测序结果中冗余序列后,拼接获得完整的基因序列。
1.3 序列分析
利用软件BioEdit 预测ORF 开放阅读框,并翻译蛋白序列;将蛋白序列提交至在线分析软件SignalP 3.0 Server (http://www.cbs.dtu.dk/services/SignalP/),预测信号肽;利用NCBI 的保守结构域(CDD)数据库(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)和Pfam 数据库(http://pfam.sanger.ac.uk/)进行功能结构域的预测和确定;使用DNAMAN 分析软件将三疣梭子蟹的氨基酸序列与其他物种进行多重序列比对;通过软件MEGA 6.0 以Neighbor Joining 法构建系统进化树(段亚飞等, 2013)。
1.4 蜕皮周期实验
根据甲壳硬度和游泳足趾节末端新旧表皮的变化(沈洁等, 2011),将部分暂养7 d 后的健康三疣梭子蟹分成蜕皮间期(甲壳硬,无新表皮出现)、蜕皮前期(甲壳硬,出现新表皮)和蜕皮后期(甲壳柔软),每个时期随机取3 只,取其血细胞、第1 对鳃、第6 对鳃、胃、肝胰腺、心脏、表皮、肌肉、眼柄和肠组织于液氮速冻保存,实验设置3 个平行。

表1 三疣梭子蟹PtCht1 基因克隆和实时荧光定量所用引物序列Tab.1 Primer sequences for cloning and qRT-PCR of PtCht1 gene in P. trituberculatus
1.5 盐度胁迫实验
正式实验前,随机挑取240 只暂养7 d 后充满活力的健康三疣梭子蟹进行低盐胁迫预实验,实验方法参照隋延鸣等(2012)。设置4 个盐度梯度,分别为33(对照)、13、11 和9,每个盐度下放置20 只蟹,设置3 个平行,统计24、36、48 和72 h 三疣梭子蟹死亡数,计算结果显示,72 h 半致死盐度为11,由此正式实验设置2 个盐度,即对照组(33)和低盐组(11)。低盐度海水由自然海水(33)与淡水调配而成,每组设3 个平行,每个平行50 只蟹。分别在胁迫后0、3、6、12、24、48 和72 h 取3 只梭子蟹的肝胰腺和鳃组织,液氮速冻保存,便于后续提取RNA。
1.6 PtCht1 基因mRNA 的实时定量PCR 检测
将获得的组织样品利用Trizol 法提取总RNA,检测方法同 1.2。选取高质量的总 RNA 样品,参照TOYOBO ReverTra Ace qPCR RT Master Mix with gDNA Remover 试剂盒说明书,反转录成cDNA,用于后续的实时荧光定量PCR 分析(qRT-PCR)。根据拼接获得的PtCht1 基因cDNA 序列全长和已知的三疣梭子蟹管家基因β-actin,利用软件Primer Premier 5.0设计荧光定量特异性引物(PtCht1 qF 和PtCht1qR)和内参引物(β-actin-F 和β-actin-R) (表1),通过实时定量PCR 法对PtCht1 基因在各个组织和各实验组中的相对表达量进行检测分析,反应体系及程序参照TOYOBO SYBR® Green Real-time PCR Master Mix说明书进行,结果采用2–ΔΔCt方法计算,借助SPSS 19.0 对数据进行单因素方差分析(One-way ANOVA),利用Origin Pro 和Excel 软件将结果整理统计,P<0.05为差异显著。
2 结果
2.1 PtCht1 基因的cDNA 全长克隆及序列分析
以三疣梭子蟹各组织的混合cDNA 为模板进行RACE 扩增,获得3ʹ-981 bp 和5ʹ-477 bp 的cDNA 片段。将扩增的片段与已知的EST 序列拼接,得到完整的几丁质酶 1 基因的 cDNA,命名为 PtCht1(GenBank No.: KM100752)。基因结构如图1 所示,序列全长共2220 bp,其中,3ʹ端及5ʹ端非编码区分别为324 bp 和144 bp,开放阅读框(Open Reading Frame, ORF)为1752 bp,共编码氨基酸583 个,分子量为65.68 kDa,理论等电点为5.84。通过DNAstar 7.1.0 (Lasergene)软件包中EditSeq 蛋白统计程序分析一级结构的基本性质。结果显示,PtCht1 基因编码的氨基酸组成中强碱性(R 和Lys)、强酸性(D 和E)、疏水性(A、I、L、F、W 和V)和极性氨基酸(S、C、N、Q、Y 和T)残基的数目分别为78、83、266 和141 个。此外,图1 结合图2 蛋白结构域预测结果显示,N 端存在22 个氨基酸的信号肽序列,46~397 个氨基酸为1 个含4 个保守基序的糖基水解酶第18 家族催化结构域(GH18 catalytic domain)和活性位点161FDGFDL DWE169,在463~518 个氨基酸处,含6 个半胱氨酸(Cys)和几丁质结合结构域(ChtBD2)。
2.2 PtCht1 的同源性分析
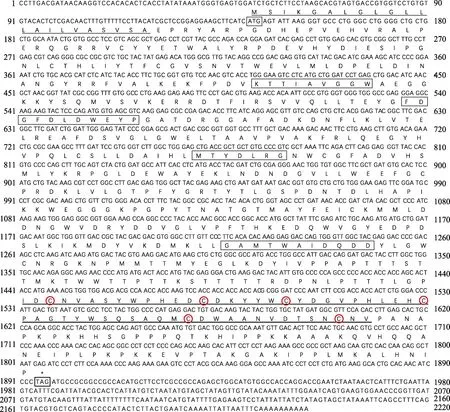
图1 三疣梭子蟹PtCht1 基因核苷酸序列及其推导的氨基酸序列Fig.1 Nucleotide sequence and deduced amino acids sequence of P. trituberculatus PtCht1

图2 三疣梭子蟹PtCht1 基因编码的蛋白结构域位置Fig.2 The protein domain architecture of P. trituberculatus PtCht1
将三疣梭子蟹Cht1 的氨基酸序列与其他物种进行同源性比对分析(图3)可知,PtCht1 基因与拟穴青蟹SpCht1 的同源性最高,为92.80%,与锯缘青蟹(Scylla serrata)、日本蟳(Charybdis japonica)、凡纳滨对虾、日本对虾、日本沼虾和中华绒螯蟹的同源性次之,分别为91.94%、90.85%、80.87%、76.98%、75.70%和75.00%。此外,甲壳动物几丁质酶GH18 催化结构域的4 个保守基序MotifⅠ~Ⅳ和含6 个Cys 的几丁质结合结构域ChtBD2 在上述几个物种中均存在。系统进化树图谱显示(图4),甲壳动物第18 家族几丁质酶主要分为7 大类,分别以Cht1、Cht2、Cht3、Cht4、Cht5、Cht6 和Cht 聚类于Group 1~7。三疣梭子蟹PtCht1 基因与凡纳滨对虾、日本对虾、斑节对虾、锯缘青蟹、中国对虾、日本沼虾和日本仿长额虾的Cht1聚为一类,隶属于Group1。
2.3 基因PtCht1 的组织分布特征分析
利用qRT-PCR 技术,对三疣梭子蟹PtCht1 基因进行了全组织表达分布分析。结果显示,PtCht1 在肝胰腺、胃、肠、表皮、肌肉、眼柄、心脏、第6 对鳃、血细胞和第1 对鳃中均有表达,其中,在肝胰腺中的表达量最高,胃次之,而在其他组织中少有表达(图5)。
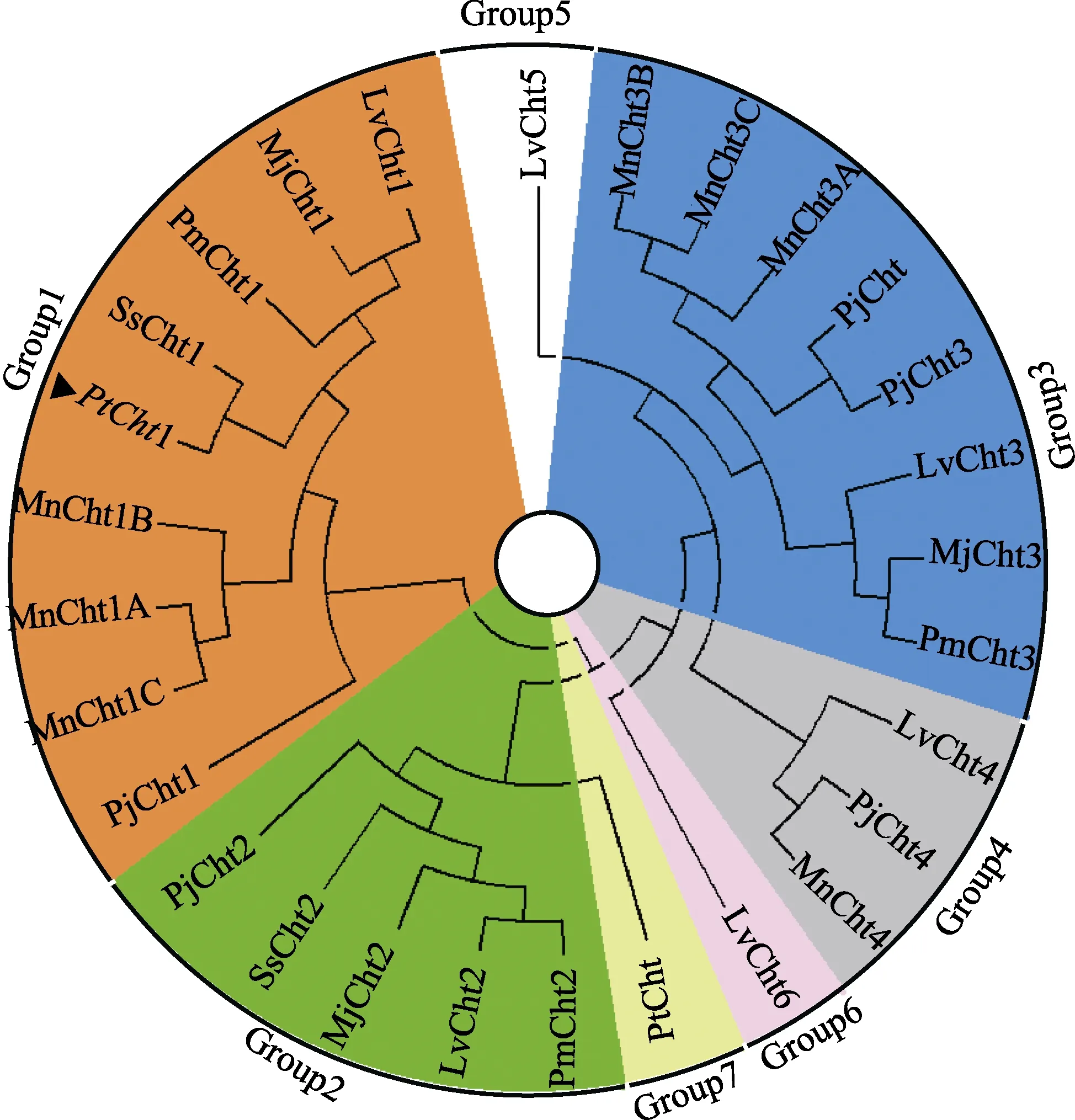
图4 三疣梭子蟹几丁质酶蛋白PtCht1 的系统进化树Fig.4 Phylogenetic analysis of chitinase PtCht1 fromP. trituberculatus
2.4 PtCht1 在蜕皮周期中的表达
PtCht1 基因在三疣梭子蟹不同蜕皮时期的肝胰腺中的表达模式显示(图6),PtCht1 在蜕皮间期的肝胰腺中的表达量最高,蜕皮后期次之,在蜕皮前期最低,不同蜕皮时期之间表达量差异显著(P<0.05)。
2.5 PtCht1 在低盐胁迫下的表达
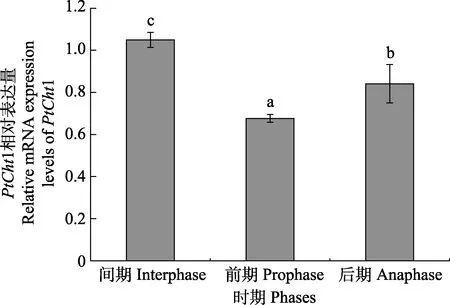
图6 PtCht1 基因在三疣梭子蟹不同蜕皮时期肝胰腺中的表达水平Fig.6 Relative mRNA expression level of P. trituberculatus PtCht1 gene in hepatopancreas during molting
三疣梭子蟹在进行72 h 低盐度(11)胁迫后,PtCht1基因在肝胰腺及第6 对鳃中的相对表达量如图7 所示。在肝胰腺中,相比于对照组,胁迫后的PtCht1基因的相对表达量在3 h 急剧上升,达到最大值,为对照组的2.72 倍,呈显著上调表达(P<0.05),6 h 迅速降低,至24 h 均为显著下调表达(P<0.05),其中,12 h 降至最小值,为对照组的0.23 倍,48 h 再次回升至对照组水平,72 h 增至上调表达(P<0.05)。在第6 对鳃组织中,相比对照组,胁迫后的PtCht1 基因在3~6 h 呈现显著上调表达(P<0.05),至6 h 达到第1 个峰值,为对照组的2.67 倍,12 h 急剧降低至最小值,为对照组的0.46 倍,呈显著下调表达(P<0.05),24 h后逐渐上升,至72 h 达到最大值,为对照组的9.96倍,呈显著上调表达(P<0.05)。

图7 低盐胁迫下三疣梭子蟹PtCht1 在肝胰腺和第6 对鳃的表达水平Fig.7 Relative mRNA expression levels of P. trituberculatus PtCht1 gene in the hepatopancreas and sixth gill under low salinity stress
3 讨论
三疣梭子蟹养殖的不同发育阶段的动物性饵料多以卤虫、杂鱼、蓝蛤等为主,而这一摄食组成中含有大量的几丁质成分,需要几丁质酶进行消化分解后才能吸收(Das et al, 2018; Zhou et al, 2018)。本研究成功克隆三疣梭子蟹几丁质酶基因1 (PtCht1),其编码的蛋白具有含第18 家族保守基序的催化结构域、活性位点(FDGLDLDVE)以及几丁质结合结构域ChtBD2 (Boot et al, 2001),且ChtBD2 含6 个保守的半胱氨酸,可形成3 个二硫键,对稳定几丁质酶的结构及调控几丁质酶的活性十分重要(Zhou et al,2017)。氨基酸比对及系统进化树分析显示,PtCht1与拟穴青蟹SsCht1 基因的同源性最高,同时,与其他甲壳动物几丁质酶1 紧密聚为一支。由此,根据结构域和活性位点的高度保守性结合聚类分析,确定了PtCht1 基因为三疣梭子蟹第18 家族几丁质酶基因,且隶属于Group1。
甲壳动物几丁质酶1 基因常高表达于肝胰腺中,而肝胰腺是分泌消化酶的主要场所,故几丁质酶1 基因在肝胰腺中的功能与几丁质类食物的消化相关(Watanabe et al, 1998)。本研究中,三疣梭子蟹PtCht1基因在肝胰腺和胃等消化器官中的表达量远高于其他组织,表明PtCht1 亦可能发挥消化几丁质类食物的功能,这与Zhang 等(2010)关于中国对虾的几丁质酶基因FcCht1 和FcCht3 的报道类似。此外,Zhang等(2014)发现,日本沼虾MnCht1A 和MnCht1B 基因可能与可溶性几丁质的消化水解有关,因其具有几丁质结合结构域ChtBD2,而PtCht1 同样具有该结构,所以PtCht1 可能与非可溶性几丁质类食物的消化有关。
斑节对虾几丁质酶PmCht1(Tan, 2000)与日本对虾PjCht1(Watanabe et al, 1996)高度同源,均在肝胰腺中特异性表达,被认为主要与几丁质类食物的降解有关,且在不同的蜕皮阶段,肝胰腺mRNA 水平上的表达差异显著。PtCht1 在蜕皮间期,表达量显著升高(P<0.05),但在蜕皮前期和后期有所下降,可能与三疣梭子蟹的生活习性相关。一般情况下,梭子蟹在蜕皮前期和后期阶段摄食停滞,而在蜕皮间期,处于快速生长阶段,摄食活跃,需要更多的几丁质酶消化食物(周凯敏, 2017),进一步表明PtCht1 在消化中发挥重要作用。
盐度是影响三疣梭子蟹生长的主要环境因素之一(何鹏等, 2019)。本研究探究了低盐胁迫对几丁质酶基因的表达和三疣梭子蟹生长的影响。结果显示,低盐度会干预PtCht1 基因的正常表达,使其在肝胰腺中呈先上调后下调再回升的表达规律,并且PtCht1基因亦能够对盐度的改变做出快速应答,在3 h 即达到峰值,而已有研究表明,低盐度条件下,需要机体提供更多的能量来调节渗透压(Ye et al, 2009),由此推断,PtCht1 可能在促进食物消化,提供机体所需的能量,进而调控三疣梭子蟹生长及机体应对低盐胁迫过程中具有重要作用(Nikapitiya et al, 2015; Lu et al,2019)。三疣梭子蟹主要依靠后鳃进行渗透压的调节,PtCht1 基因在低盐度胁迫下第6 对鳃中的表达具有显著性差异,除12 h 外,整体为上调表达,暗示了PtCht1 基因可能参与抗低盐胁迫的渗透压调节过程(Lü et al, 2013),并发挥积极作用,但详细的调节机制尚需进一步探索。
综上所述,本研究克隆并分析了三疣梭子蟹几丁质酶基因GH18 家族Group1 成员PtCht1 基因的结构特征,丰富了甲壳动物几丁质酶基因家族。通过分析PtCht1 基因的组织表达特征,蜕皮周期及低盐度胁迫下的表达模式,探究了基因在三疣梭子蟹消化、生长及渗透压调节方面发挥的生理功能,可为甲壳动物几丁质酶基因的相关调控机理研究提供参考信息,对快速生长及耐低盐新品种的培育提供新途径。

