地衣芽孢杆菌对大泷六线鱼生长、肠道消化酶、血清非特异性免疫及抗病力的影响*
樊 英 王晓璐 于晓清 刘洪军 叶海斌王淑娴 刁 菁 胡发文 菅玉霞
(山东省海洋生物研究院 山东省海水养殖病害防治重点实验室 青岛 266104)
近年来,随着养殖规模迅速发展、集约化程度不断提升,养殖动物疾病频发,而为控制病害暴发滥用各种药物,不仅破坏了养殖生态环境,也带来了养殖产品的质量安全问题。然而,益生菌制剂在保证生态环境平衡、食品安全的前提下,因其具有促生长、提免疫、保健康的良好优势,已成为当前水产养殖研究的热点。研究表明,益生菌的应用可明显促进养殖动物的生长(Madani et al, 2018; Azarin et al, 2015),提高溶菌酶、超氧化物歧化酶、过氧化氢酶以及蛋白酶的活性,间接提升机体免疫力(刘淑兰等, 2017;Abarike et al, 2018),或调控养殖动物机体内免疫球蛋白、热休克蛋白等重要基因的表达水平,增强防御能力(Huang et al, 2015)。在众多已批准的饲料添加剂中,芽孢杆菌(Bacillus)是被研究最多的菌种之一,包括枯草芽孢杆菌(Bacillus subtilis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和地衣芽孢杆菌(Bacillus licheniformis)等。本研究选用地衣芽孢杆菌,属于孢子形成菌,加工过程能够抵抗饲料颗粒化的热度,被摄食后在养殖动物体内能够存活,增殖过程中能够分泌各种酶类,提供丰富的营养物质(El-Haroun et al,2006),对动物机体无明显的毒副作用,具有高效、绿色和安全等特点,市场发展潜力巨大。
1 材料与方法
1.1 实验材料
实验用大泷六线鱼来自青岛鲁海水产技术发展公司,游动活泼,体色光亮正常,食欲旺盛,未发现病症,初始平均体重为(22.0±2.0) g。地衣芽孢杆菌购自中国普通微生物菌种保藏管理中心(China General Microbiological Culture Collection Center, CGMCC),通过营养肉汁培养基活化,–80℃保存备用。攻毒所用杀鲑气单胞菌为本实验室保存。基础配合饲料来自北京汉业科技有限公司,其营养水平为粗蛋白质471 g/kg、粗脂肪174 g/kg、粗灰分96 g/kg、可溶性膳食纤维5.91 g/kg、水解氨基酸之和404.4 g/kg、Ca 1.52×104mg/kg、Fe 808 mg/kg、Zn 137 mg/kg、水分75.3 g/kg。
地衣芽孢杆菌通过大豆蛋白胨肉汤培养基30℃过夜培养,浓度达1010CFU/ml。按照0.5%和1.0%比例将活化的菌液均匀喷洒到基础饲料上,搅拌均匀,阴凉处晾干,再在其表面直接包裹一层鸡蛋稀蛋白液(水分为85.5%,蛋白质为2.8%,脂肪为0.25%,碳水化合物为0.77%),阴干后4℃保存备用(活菌数分别为5×107和1×108CFU/g)。对照组基础饲料同样包裹蛋白液,阴干后4℃保存备用。每次制备实验饲料保存期限为7 d。
1.2 实验设计及饲养条件
养殖实验于2018 年11 月15 日~2019 年1 月25日在山东省海洋生物研究院养殖实验室进行。选取大小均匀、健康正常的大泷六线鱼随机分成3 组,每组3 个平行,每个平行30 尾,放养于循环水养殖系统(500 L)中,实验前用基础配合饲料暂养10 d。对照组(Control)投喂仅有蛋白液包裹的基础配合饲料;实验组(B. licheniformis)分别投喂添加0.5%和1.0%地衣芽孢杆菌的实验饲料。
实验过程中每天排污、吸除残饵,每天分别在10:00 和18:00 投喂2 次,日投喂量为鱼体重的2%,根据摄食情况适当调整投喂量,达到饱食投喂,无残饵剩余,饲喂饵料在1 h 内摄食完。实验期间水温为(11.5±1.0)℃,溶氧为(7.0±0.5) mg/L,pH 为7.2±0.3,氨氮和亚硝酸氮含量<0.1 mg/L。
1.3 测定指标及方法
1.3.1 生长指标检测 喂养实验结束后,将鱼饥饿24 h,对每个平行组中的鱼进行计数和称重(终末体重),计算成活率(Survival rate, SR)和特定生长率(Specific growth rate, SGR)。计算公式为:
SR=(终末活鱼尾数/初始活鱼尾数)×100%
SGR=(ln 末均重–ln 初均重)/实验天数×100%
1.3.2 血清样品采集及免疫相关酶指标检测 喂养实验过程中,每10 d 随机从每个平行组中抽取3 尾实验鱼,用无菌注射器从尾静脉处采血,将血液迅速置入离心管后于4℃下静置6 h,以3000 r/min离心10 min,取血清迅速置于液氮中,–80℃超低温保存、备测。
谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)、超氧化物歧化酶(Superoxide dismutase,SOD)、丙二醛(Microscale malondialdehyde, MDA)、总抗氧化能力(Total antioxidant, T-AOC)以及过氧化氢酶(Catalase, CAT)活性均采用南京建成生物工程研究所试剂盒测定,反映机体抗氧化能力的变化。
谷氨酰胺合成酶(Glutamine synthetase, GS)、苹果酸脱氢酶(Malate dehydrogenase, MDH)和己糖激酶(Hexokinase, HK)活性均采用南京建成生物工程研究所试剂盒的操作方法测定,反映机体对营养物质代谢能力的变化。
谷草转氨酶(AST)、谷丙转氨酶(ALT)、腺苷脱氨酶(ADA)和胆碱酯酶(CHE)活性均按照南京建成生物工程研究所试剂盒微板法测定,从肝功能相关指标的变化间接反映机体免疫力。
1.3.3 肠道样品采集及消化酶活性检测 实验过程每10 d 分别从每个平行组取3 尾实验鱼,冰上无菌操作取前中肠肠道样品,按1∶9 (m/v)比例加入预冷的0.85%生理盐水,冰浴匀浆后2500 r/min 离心10 min,取上清液备测。胰蛋白酶、淀粉酶和脂肪酶活性均采用南京建成生物工程研究所试剂盒进行测定。
1.4 血清免疫指标间的相关性研究
经SPSS 19.0 进行双变量相关性分析,确定双侧检验显著性(P<0.01 或P<0.05)。
1.5 攻毒感染实验
本实验室保存的杀鲑气单胞菌经脑心浸液培养基(Brian Heart Infusion, BHI) 28℃培养24 h,预实验确定半致死浓度(LD50),用无菌生理盐水调整浓度为108CFU/ml。芽孢杆菌喂养实验结束后,每组随机取15 尾鱼进行攻毒实验,经肌肉注射100 μl 杀鲑气单胞菌稀释液,对照组注射相同剂量的生理盐水。实验期间观察感染后大泷六线鱼的表征并及时记录日死亡情况,及时取出死亡鱼体,14 d 后结束感染实验并统计其累积死亡率。计算公式如下:
累积死亡率(Cumulative mortality rate, %)=累积死亡数量/初始数量×100。
1.6 数据统计分析
实验所得数据均表示为平均值±标准误(Mean±SE, n=3),通过SPSS 19.0 软件进行单因素方差分析(One-way ANOVA)和柱状图绘制,同时通过Tukeyʹs检验方法对实验数据进行多重比较,当P<0.05 时,表示具有显著性差异。
2 结果
2.1 地衣芽孢杆菌对大泷六线鱼生长性能的影响
含地衣芽孢杆菌实验饲料喂养大泷六线鱼50 d后,称重并统计各组实验鱼的存活率和SGR。从表1中可见,地衣芽孢杆菌可显著提高大泷六线鱼终末体重和 SGR(P<0.05),但两实验组之间无显著差异(P>0.05),对照组和实验组鱼的存活率均为100%。

表1 地衣芽孢杆菌对大泷六线鱼生长性能的影响(平均值±标准误)Tab.1 Effect of B. licheniformis on growth performance of H. otakii (Mean±SE)
2.2 地衣芽孢杆菌对大泷六线鱼血清中抗氧化指标的影响
含地衣芽孢杆菌实验饲料喂养大泷六线鱼50 d后,各实验组和对照组大泷六线鱼血清的抗氧化相关酶活力测定结果见图1。与对照组比较,饲料中添加0.5%和1.0%地衣芽孢杆菌均可提高大泷六线鱼血清中SOD、CAT 和T-AOC 活性,降低MDA 含量。GSH-Px 活性在1.0%实验组较对照组下降,而0.5%实验组较对照组提高,且第50 天最高,但与对照组差异不显著(P>0.05),与 1.0%实验组差异显著(P<0.05)。SOD 和CAT 活性在第40 天较高,两实验组差异不显著(P>0.05);MDA 含量第40 天最低,两实验组差异不显著(P>0.05);T-AOC 活性在第50 天最高,两实验组差异显著(P<0.05)。
2.3 地衣芽孢杆菌对大泷六线鱼血清中代谢相关酶的影响
含地衣芽孢杆菌实验饲料喂养大泷六线鱼50 d后,各实验组和对照组大泷六线鱼血清中代谢相关酶活力的测定结果见图2。与对照组相比,1.0%地衣芽孢杆菌组的鱼血清中代谢相关酶GS、MDH 活性第40 天最高(P<0.05),0.5%实验组第50 天最高(P<0.05),且1.0%实验组高于0.5%实验组。HK 活性第40 天最高,0.5%实验组高于1.0%实验组,两实验组之间无显著差异(P>0.05)。
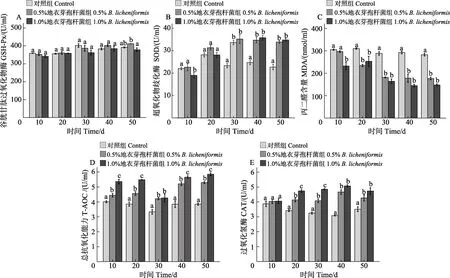
图1 地衣芽孢杆菌对大泷六线鱼血清中抗氧化指标的影响Fig.1 Effect of B. licheniformis on antioxidant indicators in serum of H. otakii

图2 地衣芽孢杆菌对大泷六线鱼血清中代谢相关酶的影响Fig.2 Effect of B. licheniformis on metabolic enzymes in serum of H. otakii
2.4 地衣芽孢杆菌对大泷六线鱼血清中肝功能相关酶的影响
含地衣芽孢杆菌实验饲料喂养大泷六线鱼50 d后,各实验组和对照组大泷六线鱼血清中肝功能相关酶活力测定结果见图3。与对照组比较,地衣芽孢杆菌实验组鱼血清中AST 活性降低,且幅度较大,第50 天最低,两实验组间差异显著(P<0.05)。ALT 活性在0.5%实验组持续降低,第40 天最低,两实验组差异显著(P<0.05),而1.0%实验组变化起伏,第20 天和第50 天活性较低。1.0%实验组CHE 和ADA 活性均比对照组有提高(P<0.05),CHE 活性在第30 天最高,与0.5%实验组差异不显著(P>0.05),而ADA 活性在第 40 天最高,与 0.5%实验组差异不显著(P>0.05)。
2.5 地衣芽孢杆菌对大泷六线鱼肠道消化酶活性的影响

图3 地衣芽孢杆菌对大泷六线鱼血清中肝功能相关酶的影响Fig.3 Effect of B. licheniformis on liver enzymes in serum of H. otakii

图4 地衣芽孢杆菌对大泷六线鱼肠道消化酶活性的影响Fig.4 Effect of B. licheniformis on activities of intestinal digestive enzymes in H. otakii
含地衣芽孢杆菌实验饲料喂养大泷六线鱼50 d后,各实验组和对照组大泷六线鱼肠道消化酶活性变化见图4。与对照组比较,两实验组胰蛋白酶活性随时间延长呈递增趋势,第40 天1.0%实验组酶活性达到最高,且两实验组之间差异显著(P<0.05),第50 天变化平稳。1.0%实验组第40 天肠道淀粉酶活性达最高(P<0.05),比对照组提高近3 倍,两实验组之间无显著差异(P>0.05)。脂肪酶活性在实验第30 天以1.0%实验组最高(P<0.05),而0.5%实验组在第40 天最高(P<0.05),与1.0%实验组无显著差异(P>0.05)。
2.6 大泷六线鱼血清非特异性免疫指标相关性分析
相关性是一种动态化的特征,它表示各个因素在某个特定的时间点上的分析,本研究是通过第50 天各免疫指标的活性值进行分析,不同指标之间交互检验双侧显著性系数不同。如表2 所示,GSH-Px 和GS相关性极显著,达到P<0.01 显著水平,说明二者之间密切程度较高;T-AOC 和GSH-Px、T-AOC 和MDA、MDA 和GS、GSH-Px 和MDH 之间存在一定的联系和概率,达到P<0.05 显著水平。
2.7 攻毒感染实验
含地衣芽孢杆菌实验饲料喂养大泷六线鱼50 d后,进行杀鲑气单胞菌注射感染实验,感染期间各组累积死亡率的统计结果见图5。对照组感染后,第2天即出现死亡情况,6 d 内死亡率急剧增加,第8 天减缓,第10 天达到平稳期,14 d 内的累积死亡率达75.55%;而实验组在第4 天出现死亡,与对照组差异性显著(P<0.05);1.0%实验组第8 天达到平稳期,14 d内的累积死亡率仅有35.55% (P<0.05),而0.5%实验组第 10 天达到平稳期,累积死亡率为 53.33%(P<0.05)。
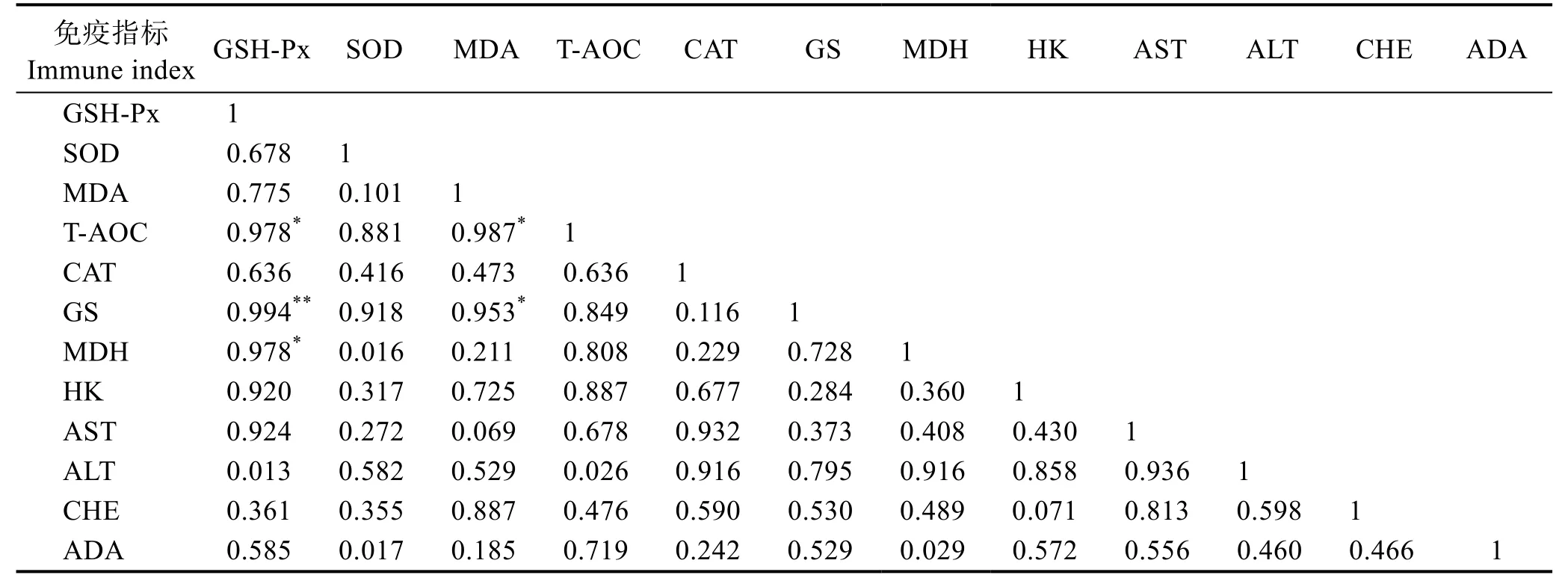
表2 双变量方差分析大泷六线鱼血清非特异性免疫因子的相关性Tab.2 Two-way ANOVA correction analysis of non-specific immune in serum of H. otakii
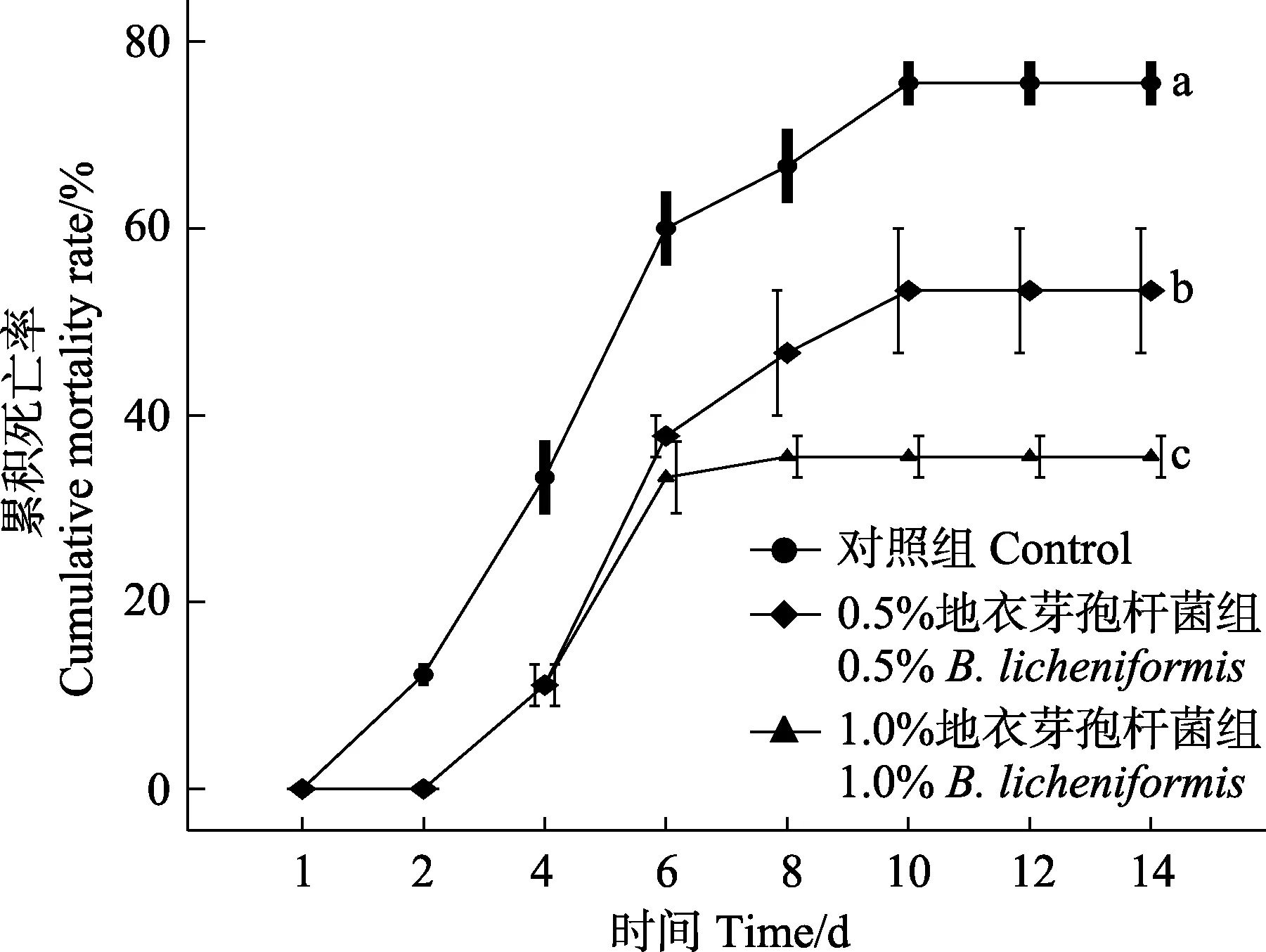
图5 杀鲑气单胞菌感染14 d 内大泷六线鱼累积死亡率Fig.5 Cumulative mortality rate of H. otakii challenged with A. salraonicida in 14 days
3 讨论
益生菌是一类对养殖动物机体有益的活性微生物,可通过不同的作用机制为动物提供良好的营养和环境,提高养殖动物的生长和存活率,提高动物机体免疫力和抗病力等(韩卓然等, 2016; 何伟聪等, 2015;叶海斌等, 2018)。地衣芽孢杆菌是国家批准使用的一种益生菌添加剂。Abarike 等(2018)研究含有地衣芽孢杆菌的商业益生菌制剂对罗非鱼(Oreochromis niloticus)的生长、免疫及抗病力的影响,不同剂量的益生菌制剂可提高鱼体重、SGR 和饲料利用效率,提高免疫酶活性和基因表达量,间接提高机体抵抗致病菌乳链球菌(Streptococcus agalactiae)的能力。Gao 等(2018)研究表明,105CFU/ml 地衣芽孢菌的摄入可提高鲍鱼(Haliotis discus hannai Ino)的摄食性、生长能力和免疫功能,提高对副溶血性弧菌(Vibrio parahemolyticus)的抵抗力。潘雷等(2012)研究也表明,地衣芽孢杆菌或含有地衣芽孢杆菌的复合益生菌均可降低大菱鲆(Scophthalmus maximus)肠道弧菌数量,提高血清免疫酶活性。彭树锋等(2007)研究表明,向养殖水体中加入地衣芽孢杆菌可以有效改善养殖水环境,减少弧菌量,且提高石斑鱼(Epinephelus sp.)的摄食性和存活率。本研究也获得相似的结果,地衣芽孢杆菌可有效促进大泷六线鱼机体SGR,可能原因是地衣芽孢杆菌在鱼体内繁殖代谢产生大量短链脂肪酸等营养物质,优化肠道菌群结构,提高消化酶活性,从而促进营养物质的降解、吸收、利用,最终发挥促生长的效果。有研究报道,外源营养物质对肠道消化酶活性可产生积极或消极的影响,消化酶活性变化与投喂饲料有直接的相关性(潘雷等, 2013; 陈飞等,2016a)。而且,地衣芽孢杆菌在代谢过程中能够产生蛋白酶、脂肪酶和淀粉酶等具有较强活性的酶类(Nazmi et al, 2008),间接促进鱼机体的健康和抗病力。本研究中,实验组消化酶活性与对照组相比均有提高,地衣芽孢杆菌的添加影响了鱼对蛋白质的消化吸收效率,从而提高胰蛋白酶活性;通过改变肠道内碳水化合物、脂类和糖类物质的含量,影响脂肪酶和淀粉酶活性的变化。因此,饲料中添加地衣芽孢杆菌能够适应大泷六线鱼机体的消化能力,从而提高鱼肠道消化功能。然而,消化酶活性与养殖动物种类差异、饲养环境及饲养方式等都存在相关性(刘颖等, 2009;刘洋等, 2011; 陈飞等, 2016b),具体实验在进一步研究中。
在鱼类防御体系中抗氧化系统起到重要作用,其动态平衡是确保动物健康的重要因素之一。GSH-Px参与血清过氧化物的分解,可将有害的过氧化物还原成羟基化合物(李国明等, 2019)。本研究中,1.0%实验组鱼血清中GSH-Px 活性较对照组降低,可能是由血清中该酶的作用底物谷胱甘肽的变化引起的,其具体原因有待进一步探究。然而,催化体内H2O2转化成无害的H2O 和O2就由CAT 完成,即1.0%实验组呈现出较高的活性。SOD 可把有害的超氧自由基转化为H2O2,CAT 即会将其分解为完全无害的H2O,二者的协同作用保护机体细胞免受氧自由基的损伤(Cavaletto et al, 2002)。本研究中,SOD 和CAT 2 种酶活性的变化相似,均在实验第40 天活性达最高,SOD 活性升高导致H2O2浓度增加,而后,高活性的CAT 便会及时将其清除,减少其对机体产生的伤害,增强机体的抗氧化能力,这与孙金辉等(2017)对鲤(Cyprinus carpio)幼鱼的研究结果一致。Kucukbay 等(2009)研究表明,当机体内氧自由基ROS 过量且未及时清除时,将对细胞产生损伤并促进脂质的过氧化反应。脂质过氧化物MDA 的浓度不仅可直接反映机体的脂质过氧化程度,而且可间接反映抗氧化能力的强弱,MDA 水平升高,SOD 活性降低,即可引发氧化应激反应,导致细胞损伤甚至死亡。本研究结果显示,MDA 含量随SOD 活性的提高有所降低,且第50 天又呈现升高,这可能是因为抗氧化系统酶SOD 和CAT 消除活性氧自由基的能力降低,刺激到脂质过氧化反应,导致鱼体内MDA含量增加,吴庆元等(2014)对鲻鱼(Mugil cephalus)幼鱼的研究也呈现类似结果。T-AOC 是反映血清中总抗氧化能力的重要指标,亦是评价益生菌应用效果的主要指标(Castex et al,2009)。本研究发现,T-AOC 的活性在实验第50 天达到最高,虽然达到最高活性的时间不同于SOD 等其他酶,但发生趋势相似,然而,第30 天活性下降,可能是由于环境差异或人为操作差异造成。这些结果均表明,地衣芽孢杆菌可有效提高大泷六线鱼机体的抗氧化防御能力,各种指标协同作用,进而提高鱼机体抗病力。
GSase 积极参与机体细胞氮原代谢以及谷氨酞胺合成,在养殖动物维持机体平衡中起到重要作用。孙武卫等(2012)研究GSase 在对虾非特异性免疫方面的重要作用,Tok 等(2009)研究了低氧环境下GSase在调控机体平衡中的作用。本研究中,地衣芽孢杆菌的添加同样对大泷六线鱼血清GSase 活性产生了增强作用,推测地衣芽孢杆菌在增殖过程中分泌较强的蛋白酶活性,促进鱼机体对蛋白质的代谢利用,从而提升GSase 活性。HK 是参与糖代谢的关键酶之一,其活性大小与底物糖的种类和含量均有直接的关系(杨品贤等, 2019)。本研究中,地衣芽孢杆菌组HK 活性比对照组明显提高,由于地衣芽孢杆菌在增殖代谢过程中促进营养物质的降解,增加分泌代谢物中底物糖的种类和含量,从而促进酶活性的提高。MDH 是参与脂肪代谢的重要标志酶之一(魏胜娟等, 2011),本研究中,地衣芽孢杆菌分泌的高消化酶活性使得鱼体对营养物质的吸收率提高,诱导增强脂肪合成力,促进脂肪代谢过程,提高了血清中MDH 活性。
评价肝脏功能常用的血清转氨酶有 ALT 和AST,是催化氨基酸与酮酸之间氨基转移的关键酶(王成强等, 2019)。当肝脏受到刺激损伤时,细胞中的转氨酶便进入血液,血清中的酶活性会有不同程度的增加,因此推测,检测ALT 和AST 活性可揭示添加地衣芽孢杆菌是否对大泷六线鱼肝脏造成负担或损伤。ADA 是一种核酸代谢酶,与机体细胞免疫活性有重要关系,可作为反映外界刺激对肝损伤的敏感指标。CHE 是一种水解酶,作用于乙酰胆碱,其活性与肝损伤呈负相关,若外界刺激对肝脏造成负担或损伤,CHE 活性即会下降(Anderson et al, 2000; 樊英等, 2019)。本研究中,AST 活性在实验过程中呈持续下降状态,说明饲料中地衣芽孢杆菌对鱼机体肝功能未造成负担或明显的损伤,而是起到一定的保护作用;ALT 活性变化与对照组相比时高时低,这可能表明开始给予地衣芽孢杆菌时对鱼机体的适应水平产生了压力,然而,在代谢过程中机体通过自我调节实现压力能量的转换,未发生明显的损伤,其具体调节机制还需后续进一步研究。CHE 和ADA 活性在实验过程中逐渐升高,分别在第30 天和第40 天达到最高,随着时间的延长,酶活性在正常范围内发生浮动,但比对照组活性仍有所提升。故认为,本研究中地衣芽孢杆菌的添加对大泷六线鱼肝功能未造成明显的负影响,间接对机体非特异性免疫功能产生积极的作用。而且,适量的添加才会对养殖动物的肝脏起到保护作用,同时提高肝脏抵抗外界刺激的能力,过量或不正确的添加将会产生一定程度的损伤(何远法等,2016; 王成强等, 2019),机理有待进一步探究。
在鱼类机体整个免疫防御体系中,血清抗氧化功能指标的变化与代谢功能、肝脏功能指标的变化之间存在着不可分割的联系,其中,血清转氨酶在氨基酸代谢和蛋白质、脂肪和糖三者相互转化的过程中起着重要作用,氧自由基含量直接影响着整个非特异性免疫及其代谢能力,三大营养物质在体内的吸收转化和机体器官的健康水平也存在着重要联系。鱼类消化酶活性的强弱也可影响着蛋白质、糖类和脂肪等物质的消化、吸收,进而影响鱼机体生长发育等生命活动,鱼体的健康水平又直接体现其抵抗病害的能力(刘波等, 2006; 刘淑兰等, 2017; 孙金辉等, 2017; 李国明等, 2019; 王成强等, 2019),这些联系和相关性在本研究中均得到了体现。攻毒感染方式是检验养殖动物抗病力和免疫功能的一种常用方法,杀鲑气单胞菌是冷水鱼细菌性疾病的代表性致病菌之一(刁菁等, 2018)。本研究中,地衣芽孢杆菌延长了实验鱼出现死亡的时间,14 d 累积死亡率比对照组降低了一倍多,可能因为地衣芽孢杆菌独特的生物夺氧机制抑制了致病菌的生长繁殖,调节肠道内微生态平衡,结合非特异性免疫功能的增强,刺激体内免疫系统的发育,进而降低大泷六线鱼的累积死亡率。

