云龙石斑鱼胃排空特征和摄食消化特性研究*
高云红 景琦琦 黄 滨 关长涛 张佳伟李文升 翟介明 贾玉东①
(1. 上海海洋大学水产与生命学院 上海 201306;2. 青岛国家科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;3. 中国水产科学研究院黄海水产研究所 青岛 266071;4. 莱州明波水产有限公司 莱州 261400)
鱼类的摄食和消化是一个复杂的动态生理过程,多种激素和消化酶参与其中,保证其有序进行。在激素和消化酶的作用下,鱼类形成各自特有的胃排空类型,一直以来,研究者都将胃排空率(Gastric evacuation rate, GER)作为评价鱼类消化功能的重要指标(余方平等, 2007)。胃排空率是指摄食后食物从胃中排出的速率(李可贵等, 2009)。自20世纪60年代起,胃排空率被广泛应用于鱼类生理、生态学的评价。迄今为止,国内学者已对多种养殖鱼类的胃排空率进行了系统研究,并以多种数学模型拟合胃排空率,为科学制定养殖鱼类投喂频率提供重要参数。冯宪斌等(2012)深入分析了岩原鲤(Procypris rabaudi)幼鱼胃排空率和摄食量;余方平等(2007)测定了美国红鱼(Sciaenops ocellatus)的胃排空率;郭浩宇等(2017)阐明了许氏平鲉(Sebastes schlegelii)幼鱼的胃排空特征;仇登高等(2018)明确了投喂频率对鞍带石斑鱼(Epinephelus lanceolatus)胃排空率及消化酶的影响。研究表明,鱼类胃排空率受自身内在因素和诸多外在因素的共同影响,如鱼类的种属、日龄、饲养温度、饲料种类、投喂频率等(张波等, 2001)。摄食后,鱼类摄食神经中枢产生神经冲动,刺激下丘脑垂体分泌促进摄食或抑制摄食因子,加之食物摄入后对胃肠道刺激,生理性反馈调控摄食因子分泌,引起血液生理指标和消化酶活性的变化,影响鱼类摄食行为发生。而摄食消化过程中,胃排空率与鱼类血液生理状态和消化酶活性变化是否具有相关性目前尚未有深入研究。因此,阐明鱼类血液生理、消化酶和胃排空之间的关系,将有助于了解其食欲恢复状况,科学制定最佳投喂方案,对鱼类高效健康养殖和经济性状调控意义重大。
云龙石斑鱼(E. moara ♀ × E. lanceolatus ♂)是由中国水产科学研究院黄海水产研究所与莱州明波水产有限公司选育的石斑鱼新品种,其父本为鞍带石斑鱼,母本为云纹石斑鱼(E. moara),云龙石斑鱼兼具二者优点,具有肉质鲜美、营养价值高、生长速度快的特点(唐江等, 2018; 李振通等, 2019; 成美玲等,2018)。2016 年初全面推向市场后,获得了极高赞誉。目前,对云龙石斑鱼的研究主要集中在亲本表型数量性状分析、幼鱼温度和盐度适应调控机制(邢道超等,2017)、肌肉营养成分分析及品质评价(王林娜等, 2018)等方面,而有关云龙石斑鱼摄食投喂的研究尚未见报道。本文通过研究云石斑鱼摄食后胃排空特征,比较线性模型、平方根模型和立方模型对胃排空曲线的拟合程度,构建云龙石斑鱼胃排空的最佳数学模型,查明云龙石斑鱼摄食后血清中葡萄糖、皮质醇含量和肝脏消化酶活性的变化规律,旨在优化云龙石斑鱼养殖投喂策略,为实现标准化养殖提供有效技术支撑。
1 材料与方法
1.1 实验材料
实验鱼由莱州明波水产有限公司提供,共150尾,平均体重为(680.35±39.84) g,体长为(30.05±1.72) cm。实验前在5 m×5 m×1.5 m养殖池中暂养1周(50尾/池,共3个养殖池),水温为18℃~19℃,溶氧为9~10 mg/L,pH为7.8~8.2,NH3-N<0.5 mg/L。采用循环水饲养,每天投喂2次(间隔12 h)。投喂海童系列商品配合饲料(粗蛋白≥48%,粗脂肪≥10%,粗灰分≤17.0%,Ca≤4.0%,赖氨酸≥2.5%,总磷≥1.5~3.0,含少量几丁质的虾或蟹)。
1.2 实验设计与样品收集
实验开始前24 h 停止投喂,以保证其消化道彻底排空。实验开始时,用颗粒饲料进行一次性饱食投喂,1 h 后清除残饵。在投喂后0、3、6、9、12、15、18 和24 h,依次从每个养殖池中取6 尾鱼,MS-222(100 mg/L)麻醉,解剖取样。测定全长、体长和体重,尾静脉取血,置于1.5 ml 的EP 管中,静置15~20 min,3500 r/min 离心10 min,取上清液,保存于–20℃,用于检测皮质醇和葡萄糖含量。解剖取出胃、肝脏和肠组织。以滤纸吸干胃表面水分、称重,排净胃内容物;用蒸馏水反复清洗胃内壁,滤纸吸干、称重,所得重量差值即为胃内容物质量(湿重)(曾令清等, 2011);肝脏和肠组织于–20℃保存,用于检测消化酶活性。
1.3 样品处理与指标检测
1.3.1 血清中皮质醇和葡萄糖含量测定 血清中葡萄糖含量采用南京建成公司试剂盒检测,血清中的葡萄糖经葡萄糖氧化酶的作用生成葡萄糖酸和H2O2,后者在过氧化物酶的作用下,将还原性4-氨基安替比林与酚偶联缩合成可被分光光度计测定的物质,所用波长为505 nm,单位为mmol/L。血清中皮质醇含量采用竞争法检测,向预先包被了抗体的酶标孔中加入样本,再加入生物素标记的识别抗原,在37℃下孵育30 min,经PBST 洗涤5 次后,加入亲和素HRP,在37℃下孵育30 min,洗涤后加入显色液,37℃显色10 min,再加入终止液,在450 nm 波长下检测,单位为ng/ml。
1.3.2 消化酶的测定 准确称重肝脏和肠组织,按重量(g)∶体积(ml)=1∶9,加入9倍体积1.2%的生理盐水,冰水浴条件下机械匀浆,2500 r/min,离心10 min,取上清液,以生理盐水1∶9稀释为1%组织匀浆。肝脏和肠组织总蛋白浓度,淀粉酶、糜蛋白酶、脂肪酶比活力均采用南京建成公司试剂盒检测,波长为562、660、580和660 nm,所用仪器为UV 2800紫外可见分光光度计。
1.3.3 胃排空率计算 胃内容物残余百分比计算公式为:
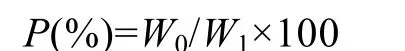
式中,P 表示任一取样时间胃内容物重量(湿重)占总摄食量的百分比,W0表示在任一取样时间时胃内容物的重量,W1表示实验鱼饱食状态下的总摄食量(谢小军等, 1998)。
用线性、立方根和平方根3 种数学模型分别拟合云龙石斑鱼胃排空率实验数据。各数学模型公式如下:
线性模型:Y=A–Bt
立方模型:Y=At3+Bt2+Ct+D
平方根模型:Y0.5=A–Bt
式中,Y 为胃内残余食物的湿重;t 为进餐后的时间;A、B、C、D 为常数。
采用SPSS 18.0 和GraphPad Prism 7.0 进行数据统计分析及绘图。通过比较分析各拟合模型的相关系数(R2)、残差标准差(SDR)、残差平方和(RSS)值,确定云龙石斑鱼最佳胃排空模型。
以相邻取样点胃内容物量差值(St)的自然对数值与所对应的间隔取样时间(t)进行线性回归,其线性方程为:

式中,所得线性方程的斜率a 即为云龙石斑鱼的瞬时排空率(刘丽华等, 2005)。
1.4 数据分析
实验数据采用SPSS 18.0 软件进行单因素方差分析(One-way ANOVA),当差异达到显著水平,进行Duncan 氏多重比较。数据用平均值±标准误(Mean±SEM)表示,P<0.05 为差异显著。3 种数学模型的参数A、B、C、D 均由统计软件进行曲线拟合得到。
2 结果
2.1 云龙石斑鱼胃排空特征及胃排空模型
饱食投喂后,云龙石斑鱼的胃内容物百分比随时间呈规律性变化(图1)。投喂后,云龙石斑鱼胃内容物百分比呈逐渐下降的趋势,3~6 h 急剧下降,由88.5%降至33.2%,差异显著(P<0.05),0~3、6~15 h胃内容物百分比下降速率较缓,摄食后15 h,胃内容物基本排空,属于典型的先慢后快再慢胃排空类型。

图1 云龙石斑鱼胃排空变化Fig.1 The changes of gastric evacuation of Yunlong grouper(E. moara ♀× E. lanceolatus ♂)
利用SPSS 软件将实验结果与数学模型进行拟合,可知线性模型、平方根模型、立方模型均可拟合本实验胃排空率(图2)。从R2来看,立方模型>平方根模型>线性模型;从RSS 来看,线性模型>平方根模型>立方模型;从SDR 来看,线性模型>平方根模型>立方模型(表2)。综合R2、RSS、SDR 结果,立方模型对云龙石斑鱼胃排空率的拟合程度最佳,其公式为Y=–0.001t3+ 0.099t2–2.644t+20.677,根据公式可得,投喂后14.8 h,胃内容物完全排空。
2.2 云龙石斑鱼消化酶的变化
云龙石斑鱼消化酶呈规律性变化(图3)。饱食投喂后0~3 h,云龙石斑鱼肝脏内淀粉酶活性无显著变化,3~6 h 呈急剧上升趋势(P<0.05),6 h 时活性达到最高值(0.151 U/g prot),之后呈下降趋势,至投喂后15 h 时,肝脏内淀粉酶活性恢复至初始水平,而投喂后云龙石斑鱼肠道内的淀粉酶活性无显著变化,且肝脏内淀粉酶活性高于肠道内淀粉酶活性(图3A)。肝肠内的糜蛋白酶、脂肪酶活性均呈现先升高后降低的变化趋势,且均在饱食投喂后6 h 时,活性达到最高(P<0.05),随后显著下降(图3B、图3C)。同时,肠道内糜蛋白酶活性显著高于肝脏(P<0.05)。如表2 所示,云龙石斑鱼瞬时胃排空率与肝肠消化酶(除肠道内淀粉酶)均呈正相关(P<0.05),消化酶之间无显著相关性。

表1 云龙石斑鱼胃排空曲线的3 种数学模型拟合Tab.1 The fitting with 3 types of mathematical models for gastric evacuation of Yunlong grouper(E. moara ♀ × E. lanceolatus ♂)

图2 云龙石斑鱼胃排空曲线的3 种数学模型拟合Fig.2 The fitting with 3 types of mathematical models for gastric evacuation of Yunlong grouper(E. moara ♀×E. lanceolatus ♂)
2.3 云龙石斑鱼血清皮质醇和葡萄糖的变化
云龙石斑鱼血清中皮质醇和葡萄糖的含量均呈先升高后降低的变化趋势(图4)。投喂后0~3 h,云龙石斑鱼血清中葡萄糖含量逐渐升高,3~6 h 急剧升高,差异性显著(P<0.05),6 h 时葡萄糖含量达到最高(21.02 mmol/L),6~18 h 呈下降趋势,18 h 后血清中葡萄糖含量不再变化(图4A)。血清中皮质醇含量同葡萄糖含量呈相似的变化趋势,投喂后,血清中皮质醇含量逐渐升高,3~6 h 急剧增加,差异显著(P<0.05),6 h 时,其含量达到最高(152.6 mmol/L)。6 h 后,血清中皮质醇含量呈显著下降趋势,12 h 后无显著差异(图4B; P>0.05)。
3 讨论
3.1 鱼类胃排空方式与模型选择
鱼类种属多样,摄食习性和消化道结构存在差异,胃排空方式复杂多样。研究表明,鱼类胃排空方式主要有3 种类型:直线下降型、先快后慢型和先慢后快再慢型。胃排空类型与食物类型、饲料组成及鱼类摄食偏好存在显著相关性,以大而不易碎食物为食的鱼类,胃排空方式多为直线下降型,如黑鲷(Acanthopagrus schlegelii)(张波等, 2001)、美国红鱼(余方平等, 2007);以小而易碎食物为食的鱼类,多呈先快后慢型,也被称为固有的内在排空方式,如:黄颡鱼(Pelteobagrus vachelli)(覃志彪等, 2011)、尼罗罗非鱼(Oreochromis niloticus)(孙晓峰等, 2011)。本研究中,投喂云龙石斑鱼颗粒饲料中添加了几丁质外壳的虾或蟹,延缓了消化酶与食物作用的时间,云龙石斑鱼胃排空方式呈先慢后快再慢型。日本皇姑鱼(Nibea japonica)(朱云海等,2013)、俄罗斯鲟鱼(Acipenser gueldenstaedtii)(张涛等,2015)也呈现类似的胃排空方式。

表2 云龙石斑鱼瞬时排空率与消化酶相关性分析Tab.2 Correlation between instantaneous emptying rate and digestive enzymes in Yunlong grouper(E. moara ♀ × E. lanceolatus ♂)

图3 云龙石斑鱼摄食24 h 内消化酶变化Fig.3 Changes of digestive enzymes of Yunlong grouper (E. moara ♀ × E. lanceolatus ♂) within 24 hours of feeding

图4 云龙石斑鱼摄食24 h 内血清中葡萄糖和皮质醇变化Fig.4 Changes of glucose and cortisol in serum of Yunlong grouper(E. moara ♀×E. lanceolatus ♂) within 24 hours after ingestion
鱼类的胃排空方式复杂多样,如何选择并构建合适的胃排空数学模型存在较大争议。Jobling(1981)首次以数学模型评估了鱼类胃排空率变化。随后,各国研究者纷纷开展了以数学模型拟合胃排空率的研究,但如何选择合适的数学模型拟合数据,鉴于鱼类种属间差异,仍要根据具体情况进行深入分析研究。目前,常见的数学拟合模型有线性模型、指数模型和平方根模型3 种(张波等, 2001)。本研究中,线性模型、平方根模型、立方模型均可拟合实验数据,通过统计学分析发现,立方模型拟合度最佳。Ruohonen 等(1998)对虹鳟(Oncorhynchus mykiss)的研究发现,在投喂后15 h,胃内容物消化完全,但在其胃排空率达到80%~90%时(投喂后6 h),其食欲已经基本恢复,所以,将投喂后6 h 作为最适投喂间隔。Riche 等(2004)对尼罗罗非鱼的研究同样可以证实这一点。根据立方模型公式得出,云龙石斑鱼在投喂后9.5 h 胃排空率达到80%,14.8 h 时,胃内容物全部排空。
3.2 消化酶活性分析
消化酶依据消化对象不同分为淀粉酶、蛋白酶、脂肪酶和纤维素酶,其活性变化直接影响鱼类对营养物质的消化吸收,进而调控鱼类的生长发育(Vera et al,2007)。鱼类消化酶活性受鱼类种属、生理状态、发育阶段等内在因素和水温、盐度、饲料等外在因素共同影响(黄瑾等, 2011)。鱼类食性不同,消化道内消化酶组成和活性存在显著差异,肉食性鱼类消化道短,食物的消化吸收主要在肠道,肠道中蛋白酶活性远高于其他组织(区又君等, 2012; 向枭, 2002; 吴水清,2014)。本研究结果显示,摄食后云龙石斑鱼肝脏和肠道内消化酶活性均呈规律性变化,且在肝脏和肠道内消化酶分布有所不同。肝脏中淀粉酶呈先升高后降低的变化趋势,肠道内淀粉酶活性无显著变化,肠道内糜蛋白酶活性显著高于肝脏内糜蛋白酶活性,脂肪酶在肝脏和肠道内活性均呈先升高后降低的趋势。吴婷婷等(1994)对鳜鱼(Siniperca chuatsi)、青鱼(Mylopharyngodon piceus)、鲤(Cyprinus carpio)、鲫(Carassius auratus)、草鱼(Ctenopharyngodon idellus)和鲢(Hypophthalmichthys molitrix)消化酶活性的研究中也得到了类似结果,发现草鱼、鲤、鲢肝脏内淀粉酶活性要高于肠道内淀粉酶活性,但青鱼和鲫肝脏内淀粉酶活性显著低于肠道内淀粉酶活性。付新华等(2005)对大菱鲆(Scophalmus maximus)的研究发现,肠是水解脂肪和淀粉的主要器官,而肠水解蛋白的能力较弱。鱼类消化酶分布广泛,种属差异必然会造成其时空分布及表达活性不同。Santos 等(2016)也得出了相似的结论。云龙石斑鱼作为肉食性鱼类,其糜蛋白酶活力和脂肪酶活性显著高于淀粉酶活性,同时,胃排空速率与肝肠消化酶呈显著正相关关系。
3.3 血液生理学变化
哺乳动物下丘脑中存在中枢葡萄糖感应器和整合与发放食欲信号的中枢,可通过监测机体内葡萄糖的变化控制动物体的摄食情况(杨丽萍等, 2014)。Fuentes等(2013)发现,鱼类存在与哺乳动物类似的摄食调控机制,葡萄糖同样对鱼类的摄食有着重要的调控作用。本研究中,摄食后,云龙石斑鱼血清中葡萄糖含量显著升高,6 h 时达到峰值,且在3~12 h 时,血清中葡萄糖含量持续维持在较高水平,认为此时云龙石斑鱼食欲尚未恢复,不适宜投喂。李晨晨等(2018)在对黄颡鱼的研究中指出,摄食后鱼体血清葡萄糖浓度显著升高,且饲喂不同饲料葡萄糖升高浓度有所不同。皮质醇为糖皮质激素,皮质醇诱导葡萄糖水平升高,促进脂肪积累(Kominiarek et al, 2018)。葡萄糖和皮质醇协同作用,共同参与调节鱼类摄食和营养物质的摄取。Milligan 等(2003)对虹鳟的研究发现,皮质醇可以激活肝脏内酶活性,促进糖元合成。因此,摄食后4~9 h 中,血清中皮质醇浓度显著升高,可能主要用于葡萄糖合成,但具体代谢调控机制尚不明确,需要进一步研究。
4 结论
综上所述,摄食后云龙石斑鱼血清内葡萄糖和皮质醇含量、肝脏及肠道内消化酶活性均呈规律性变化,胃排空率呈典型的先慢后快再慢类型,其最优拟合模型为立方模型,根据模型可知,云龙石斑鱼食欲基本恢复时间为投喂后9.5 h (80%胃排空),基于以上数据结合生产实际,云龙石斑鱼每日饲喂2 次,每次间隔10 h 左右效果最佳。

