基于定量思维深度学习“溶液中的离子反应”
林 怡
(福州屏东中学,福建 福州 350003)
化学学科新课程标准提出了五个维度构成学科核心素养,其中“变化观念与平衡思想”“宏观辨析与微观探析”“证据推理与模型认知”贯穿在化学反应原理的教与学过程中。化学反应原理在选修教材中地位突出,教师教学过程重在引导学生认识化学变化所遵循的基本原理。从热化学、电化学到溶液中的离子反应,较多的内容涉及抽象、微观的化学过程,学生学习存在一定的难度。通过定性分析形成结论是较直接的方法,然而这导致学生对微观本质原理无从得知,在陌生情境中对知识的迁移、解决相关问题的综合能力略显薄弱。引导学生形成学科特征的定量思维和探究能力,是对相关知识的深度学习,也是培养“证据推理与模型认知”核心素养的途径之一。本文以探究“溶液中的离子反应”为例,从定量思维角度解析不同现象的本质,让学生对溶液中的平衡观建立新认知,并迁移运用认知解决一系列相关问题,达到对学科知识的深度学习。
一、定量思维在化学学科中的重要性
化学是一门以实验为基础的学科。溶液中离子反应的平衡建立是微观、抽象的。在传统教学设计中教师以实验探究活动为载体,学生通过预测、观察,从实验现象推导结论,获得直观的定性认知。定性分析主要解决“有什么”或者“是什么”等问题,对“为什么”“多或少”却爱莫能助。定性分析是认识物质的基础,定量分析则是对定性分析的深化,它可以借助数学工具,从量化上揭示客体特征。定量分析获得的有效数据是对化学原理和理论最充分的解释,这是无法替代的。为了引导学生探索化学反应的规律及其应用,形成物质变化的科学观念,教师教学中应启发学生观察思考,提出问题,从定性和定量、微观和宏观综合视角共同分析,进行证实或证伪,揭示研究对象的本质和特征。学科特征思维的培养不仅能突破教学难点,帮助学生从现象了解本质原因,也让学生获得必备的定量分析论证能力,提高他们的科学素养。
二、发展定量思维,深度学习学科知识
深度学习是指学习者能够在理解、学习的基础上,批判性地学习新的思想和事实,将它融入原有的认知系统,并将获得的知识迁移应用到新的情境中,决策解决相关问题。[1]纵观近几年高考选择题的热点——电解质溶液的题型,它包含不同溶液酸碱性判断,溶液中各种离子浓度大小比较等知识,这是学生的弱点,也是失分点。学习停留在知识浅层的学生,对具体事实性知识容易遗忘。对于定性分析形成的经验结论,学生更是知其然不知所以然,常不明就里,生搬硬套,学习效果甚微。定量分析是解决实际问题的方法之一,学科特征思维的培养也是能力的培养,是实现对学科知识深度学习的教学手段之一。教师可引领学生在课堂中参与高水平的思维活动,[2]对溶液中的离子反应构成要素,相互关系,建立认知模型,让学生充分体验定量思维在解决实际问题中发挥的重大作用,帮助学生扫清对溶液体系认知的障碍点,建立对溶液中各种平衡常数的新认知,实现对溶液中的离子反应深度学习。
三、基于定量思维深度学习“溶液中的离子反应”案例
为促进学生对学科知识的深度学习,达到融会贯通、灵活应用,提升解决相关问题的能力,张贤金等认为以相关主题为主线,整合、重组、激活教材,可实现教材价值的最大化。[3]笔者在“溶液中的离子反应”专题教学中,基于知识关联的结构化,对教材资源进行整合,以探究不同溶液的酸碱性为主线,引导学生形成定量思维,教会学生运用定量思维解决认知过程中产生的困惑,使学生领悟学科特征思维对实现学科知识深度学习的意义。
(一)思维碰撞,开启定量思维之门——解惑“盐溶液的浓度越小,水解的程度越大”
在“盐类水解”的新授课教学过程中,教师们通常按照教材中的“活动与探究”,让学生通过观察FeCl3溶液稀释10 倍前后pH 数值的变化,依据定性分析,得出“盐溶液的浓度越小,水解的程度越大”结论。教师进一步向学生提出疑问:“若盐溶液浓度越大,平衡仍朝正反应方向移动,水解程度是否还是增大?”学生经过探讨,察觉定性分析无法为新问题提供更多的判断依据。笔者伺机以氯化铵溶液为例,利用数学工具在教学中进行推导、演绎,消除学生疑惑,帮助学生对教材结论形成更深层次的认知。

立足课本实验,提出问题,引发学生思维火花的碰撞。单一的定性实验分析,对宏观现象中的微观解析存在一定的局限性,定量论证弥补了缺憾。教师在学生已建立溶液中平衡观的基础上,启发定量分析思维,让学生意识到解决问题方法的多样性,提高对新知探索的积极性,为后续分析不同溶液中的离子反应,开启探索之门。
(二)深入应用,感受学科特征思维的魅力——预测酸式盐溶液的酸碱性
生活中处处有化学,常用的疏松剂NaHCO3,学生已知其水溶液呈碱性。NaHCO3属于酸式盐,在HCO3ˉ既电离又水解情况下,为何其溶液最终显碱性?如何比较电离与水解程度的大小?显然定性实验无法提供满意的答案。假如学生带着重重疑惑,对结论死记硬背,就违背了教育的真正目的。基于学生已明确酸式盐溶液的酸碱性,取决于电离与水解程度大小的认知,笔者在教学中,从定量思维角度入手,与学生共同分析NaHCO3溶液显碱性的本质原因。

因为Kh>Ka2,所以NaHCO3溶液中水解程度大于电离程度,溶液显碱性。
定量分析思维的建立,不仅让学生能充分理解教材知识,在实战测试应用中,也提高了对陌生物质的分析能力。
例如,2017 年普通高等学校招生全国统一考试(全国Ⅰ卷)中第13 题:常温下将NaOH 溶液添加到己二酸(H2X)溶液中,混合溶液的pH 与离子浓度变化的关系(如图1)所示。下列叙述错误的是

图1

其中C 选项的判断,有定量分析为基础,学生对结论的应用就得心应手。学生知道c(H+)与c(OH-)大小比较,实质就是比较HX-的电离与水解程度大小,依据结论取决于Ka2与Kh大小,再结合题中其他信息就能做出正确判断,有效地提高答题的正确率。
教学中从生活实例入手,解决知识盲区,让学生感受化学与生活的密切联系,提高深度学习学科知识的兴趣。学生通过自主分析,提高了判断类似NaHSO3等盐溶液酸碱性的能力,也进一步体会到定量思维的重要性,感受到学科特征思维的魅力。
(三)能力提升,形成学科特征定量思维——解析弱酸弱碱盐溶液的酸碱性
溶液中离子反应是复杂的,弱酸的酸根离子水解显碱性,弱碱阳离子水解显酸性,而弱酸弱碱盐溶液的酸碱性又该如何判断呢?实验测定虽能直观的给予定性结论,但学生百思不得其解“为何不同的弱酸弱碱盐溶液[如CH3COONH4、(NH4)2CO3]的测定结论却不同?”教师应交给学生开启现象本质原因的“钥匙”——定量思维分析,让学生自主运用、分析并解决问题。以1mol·L-1CH3COONH4溶液为探究对象,结合表1 中查阅的数据[4]引导学生进行论证。
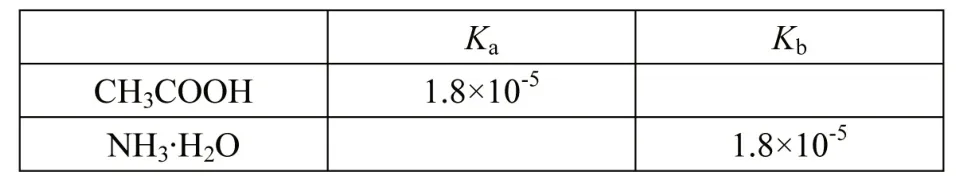
表1 (CH3COOH、NH3·H2O 的电离常数)


(四)拓展迁移,渗透深度学习——辨析混合液的酸碱性
工业生产中,中和滴定应用广泛。用NaOH 溶液滴定CH3COOH 溶液过程中,会产生CH3COONa 与CH3COOH 的混合溶液。CH3COONa 水解呈碱性,CH3COOH 电离呈酸性,混合溶液最终的酸碱性就取决于它们各自产生的c(H+)和c(OH-)的相对大小。为了在高中教学中不引入过多的概念,减轻学生负担,可用弱酸的电离平衡常数来解决类似问题。以常温下等浓度的醋酸(CH3COOH)和醋酸钠(CH3COONa)混合溶液为例

从单一溶质溶液到混合溶质溶液的探究,教师在教学中要充分挖掘教学素材,进行有效重组,教学的深度应该不局限于教材实例。纵观混合溶液中各种离子浓度大小比较的考查,常以浓度的对数表达和图形方式等结合,对学生的综合能力要求高。不具备定量思维的学生总是束手无策,轻易放弃。为树立学生解决困难的信心,教学中定量思维的培养是必不可少。教师在引领学生发现、解决问题过程中要渗透定量思维的培养,为实现对知识的深度学习做好铺垫。
四、定量思维对促进学科知识深度学习的教学反思
(—)定量思维的形成应循序渐进,要渗透在反应原理不同知识的教与学中
定量思维在化学反应原理知识体系中应用广泛。从热化学、电化学到不同溶液中建立的平衡体系,教师在教学中要不断用“数据来说话”,为定性分析提供有说服力的论证支撑。学科特征定量思维的形成,是教师突破“溶液中的离子反应”难点、疑点的“钥匙”。它让学生对溶液中的平衡观建立了新认知,同时让学生感知到具备学科特征思维远比对知识的掌握更重要。学科特征定量思维的应用不仅能解决“溶液中的离子反应”相关知识问题,对化学反应原理的其他专题知识学习也起到举足轻重的作用。它是学生实现对化学学科知识深度学习的有效途径之一。
(二)定量思维形成过程中,关注学生有效实现化学学科知识的深度学习
学科特征思维是学科的灵魂。教师在教学中应抓住学科特点,以学科知识为载体,将最核心、最本质的思想方法通过精心的教学设计来呈现,使学生从单纯的掌握课本知识浅层学习,过渡到对相关知识在陌生情境中的运用解决。教学中教师应注重以学生为主体,不同层次学生对定量思维的形成,运用解决新情境、新问题的能力不同。问题的设置、范例的选择,需要兼顾到不同层次学生的接受水平,既要体现对基本定性结论的验证,又要有对相关知识迁移、综合应用的展示,让大部分的学生都能参与到课堂学习中,领悟化学知识,体验化学学科定量思维所带来的成就感,达到真正对学科知识的深度学习。

