鳜AKT2在传染性脾肾坏死病毒增殖中的作用
明 月,牛银杰,付小哲,刘礼辉,梁红茹,林 强,李宁求
(1中国水产科学研究院 珠江水产研究所,农业农村部渔用药物创制重点实验室/广东省水产动物免疫技术重点实验室,广东 广州 510380;2上海海洋大学 水产与生命学院, 上海 201306)
鳜(Sinipercachuatsi)是我国重要的淡水名优养殖鱼类,具有较高的经济价值。近年来,高密度集约化养殖导致鳜鱼疾病频发,其中传染性脾肾坏死病毒(infectious spleen and kidney necrosis virus,ISKNV)是危害我国鳜养殖的重要病原之一,其致病力强,致死率可达90%以上,给鳜养殖业造成了巨大的经济损失[1-2]。因此,开展ISKNV致病机制研究对该病的防控具有重要意义。
蛋白激酶B(protein kinase B,PKB)基因,即AKT,是一种原癌基因,普遍存在于静息细胞的胞质中。AKT分AKT1、AKT2和AKT3 3种亚型,其中AKT2是蛋白激酶B家族的主要亚型,具有丝氨酸/苏氨酸 (Ser/Thr)激酶的活性[3],是多种细胞过程的关键调控因子[4]。有研究表明,AKT过表达可激活其下游多种效应因子,调节先天性免疫因子的表达而使其发挥抗病毒作用[5-6]。乙型肝炎病毒 (hepatitis B virus ,HBV)的X蛋白(hepatitis B virus X protein,HBX)可激活原代肝细胞中的AKT,抑制HBX介导的细胞凋亡,从而抑制乙型肝炎病毒的复制[7]。在猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)感染的早期,机体AKT被激活,抑制PRRSV介导的细胞凋亡,从而发挥其抗病毒作用[8]。水泡性口炎病毒 (vesicular stomatitis virus,VSV)感染时,机体AKT被活化,进而依赖Toll样受体4(Toll-like receptor 4)途径发挥抗病毒功能[9]。感染仙台病毒(sendai virus,SeV)的宿主通过活化AKT,激活干扰素调节因子3(interferon regulatory factor 3,IRF3)的表达,从而增强β干扰素(interferon-β,IFN-β)的表达而产生抗病毒效应[10]。可见,AKT可以作为一个抗病毒靶标用于抗病毒机制的研究。
目前对于鳜AKT2在ISKNV感染过程中的作用仍不清楚,为此本研究克隆了鳜AKT2的开放阅读框并进行原核表达,制备重组ScAKT2多克隆抗体,构建鳜AKT2过表达的细胞系,研究ScAKT2在ISKNV增殖中的作用,以期为鳜ISKNV防控提供新的靶点。
1 材料与方法
1.1 材 料
1.1.1 细胞、毒株、载体和试验动物 鳜脑组织细胞系(Chinese perch brain cell line,CPB)[11]、 ISKNV毒株(QY20091015)[12]及pET32a和pCMV-EGFP载体,均由中国水产科学研究院珠江水产研究所农业农村部渔用药物创制重点实验室/广东省水产动物免疫技术重点实验室保存;大肠杆菌(E.coli) DH5a和 BL21(DE3),购自TaKaRa(大连)公司。日本大耳兔,购于山东恒远养殖基地。
1.1.2 试 剂 L-15培养基、胰蛋白酶、血清和Hanks液,购于Gibco (美国)公司;Trizol试剂,购于Invitrogen(美国)公司;海洋动物基因组提取试剂盒,购于天根生化科技(北京)有限公司;Titanium One-Step RT-PCR Kit试剂盒、TaqMan Real-time PCR Master Mix和TB Green®Premix ExTaqTMⅡ (Tli RNaseH Plus),购于TaKaRa(大连)公司;胶回收试剂盒,购于OMEGA(美国)公司;Ni-NTA镍离子亲和层析柱(1 mL),购自生工生物工程(上海)股份有限公司;弗氏完全佐剂和弗氏不完全佐剂,购自Sigma(美国)公司;FuGENE®6转染试剂盒和Pure Yield(TM)质粒中提试剂盒,购于Promega(美国)公司;ProteoSpinTM包涵体分离纯化试剂盒,购买于艾美捷科技(武汉)有限公司;G418(Geneticin,遗传霉素)、带FITC标签的荧光二抗和DAPI染料,购自索莱宝生物有限公司(北京);ISKNV-MCP单克隆抗体,由本实验室保存;EcoRⅠ、SalⅠ、KpnⅠ酶和T4 DNA Ligase,购自TaKaRa(大连)公司。
1.2 方 法
1.2.1 鳜核酸的提取与反转录 用Trizol试剂提取CPB细胞总RNA(设3个生物学重复),然后立即用Titanium One-Step RT-PCR Kit 试剂盒将RNA反转录为cDNA,用海洋动物基因组提取试剂盒提取感染ISKNV后的CPB细胞DNA(设3个生物学重复)。
1.2.2AKT2开放阅读框(ORF)的克隆与重组表达载体的构建 (1)AKT2 ORF的克隆。 根据本课题组已测定的鳜转录组结果,设计AKT2引物ScAKT2-F(5′-CCGGAATTCATGAATGAAGTCA-GTGTTGT-3′,其中斜体部分为EcoR Ⅰ酶切位点)和ScAKT2-R(5′-ACGCGTCGACTCATTCCCGTATGCTGGCAGAG-3′,其中斜体部分为SalⅠ酶切位点)。用高保真酶PrimeSTAR®HS DNA Polymerase扩增AKT2的ORF,PCR反应总体系为50 μL:5×PrimeSTAR Buffer (Mg2+Plus) 10 μL,dNTP Mixture (2.5 mmol/L each) 4 μL,ScAKT2-F和ScAKT2-R各1 μL,Template 2 μL,PrimeSTAR®HS DNA Polymerase 0.5 μL,DEPC水31.5 μL。反应条件:98 ℃ 10 s,55 ℃ 5 s,72 ℃ 2 min,共30个循环。PCR产物用1.2%的琼脂糖凝胶电泳后测序,并切胶回收PCR产物。
(2)原核表达载体pET32a-AKT2的构建。用EcoR Ⅰ和SalⅠ同时双酶切AKT2 ORF和pET32a载体(16 ℃酶切12 h),用1.2%的琼脂糖凝胶电泳检测酶切效率,切胶回收目的条带和线性化的pET32a载体,将其以3∶1的比例用T4 DNA Ligase连接,反应体系为:T4 DNA Ligase Buffer 1 μL、目的条带7 μL、线性化载体1 μL和T4 DNA Ligase 1 μL,在16 ℃低温连接仪上连接16 h。将连接产物转入大肠杆菌感受态细胞 DH5α中,取200 μL产物涂板,过夜培养后,挑取单克隆进行菌落PCR鉴定,取阳性菌落测序。
1.2.3 鳜AKT2重组蛋白的诱导表达及纯化 将构建的原核表达载体pET32a-AKT2转化大肠杆菌感受态细胞BL21(DE3),并接种至固体牛肉膏蛋白胨培养基(含氨苄青霉素50 μg/mL)平板中,培养12~18 h后,挑取单克隆测序。将测序正确的含重组质粒的菌液接种至液体培养基(含氨苄青霉素50 μg/mL)中,于37 ℃振荡培养至菌液在600 nm处的吸光度(OD600)约为0.6时,加入IPTG诱导剂(终浓度1 mmol/L),37 ℃振荡培养3 h;超声(功率200 W,工作3 s、暂停4 s)破碎菌体2~3 min;4 ℃、6 000 r/min离心30 min,收集上清及沉淀。分别取菌体沉淀和上清,用 1×Loading Buffer重悬裂解,沸水浴15 min后进行SDS-PAGE检测。证明重组蛋白在沉淀中以包涵体形式表达后,用ProteoSpinTM包涵体分离纯化试剂盒纯化沉淀(包涵体),并通过SDS-PAGE对纯化的重组蛋白进行鉴定。
1.2.4 鳜AKT2多克隆抗体的制备 采集日本大耳兔血液,分离血清作为免疫前血清,备用。以纯化的重组AKT2蛋白为抗原,背部皮下注射免疫日本大耳兔,免疫剂量300 μg/只。一免抗原利用弗氏完全佐剂进行乳化,二免、三免和四免抗原用弗氏不完全佐剂进行乳化,最后一次免疫后2周,于兔耳缘静脉处取血,分离血清。对免疫前、后血清进行1∶2 000,1∶4 000,1∶8 000,…,1∶8 192 000梯度稀释,选择2 μg/mL的抗原包被,采用间接ELISA方法测定多克隆抗体的效价,以免疫后血清OD450值/免疫前血清OD450值>2(P/N>2)为判断标准。利用Ni-NTA镍离子亲和层析纯化抗体,用BCA法测定纯化后抗体的质量浓度,并进行SDS-PAGE鉴定。
采用Western blot法检测抗AKT2多克隆抗体的特异性(蛋白水平)。具体方法如下:利用RIPA裂解液提取CPB细胞总蛋白(设3个生物学重复),经BCA法测定蛋白浓度后, 进行SDS-PAGE分离并转移至0.45 μL PVDF膜上;以制备的兔抗ScAKT2多克隆抗体为一抗,羊抗兔IgG HRP为二抗,进行 Western blot检测。
采用间接免疫荧光法检测AKT2多克隆抗体的特异性(细胞水平)。方法如下:用预冷的甲醇固定CPB细胞,经TritionX-100透化及50 g/L的BSA封闭后,用经50 g/L BSA稀释(1∶50)的ScAKT2抗体(一抗)和经50 g/L BSA稀释(1∶2 000)的带有FITC标签的二抗分别孵育,用DAPI染色后加入少许洗液,镜检。
1.2.5 过表达鳜AKT2细胞系的建立 (1)AKT2 ORF的克隆。根据鳜AKT2序列,设计引物:AKT2-F (5′-CCGGAATTCATGAATGAAGTCAGTGTTGT-3′,斜体部分为EcoR Ⅰ酶切位点)和AKT2-R (5′-CGGGGTACCTCATTCCCGTATGCTGGCAGAG-3′,斜体部分为KpnⅠ酶切位点)。PCR扩增AKT2基因,具体方法同1.2.2(1)。
(2)过表达载体pCMV-EGFP-ScAKT2的构建。利用EcoR Ⅰ和KpnⅠ将AKT2 ORF连接至pCMV-EGFP载体,构建过表达载体pCMV-EGFP-AKT2,具体方法同1.2.2(2)。菌落PCR检测后,测序。
(3)过表达AKT2细胞系的构建。 用Pure Yield(TM)质粒中提试剂盒提取菌液中的质粒,利用FuGENE®6将pCMV-EGFP-ScAKT2载体和pCMV-EGFP空载质粒转染至CPB细胞中,培养24 h后观察荧光表达情况。使用半致死质量浓度为 1 000 μg/mL的G418对转染成功的CPB细胞进行连续加压,直至绿色荧光蛋白充满整个视野且可以稳定传代。
(4)过表达AKT2细胞系的鉴定。以稳定传代的过表达AKT2细胞系为试验组,稳定传代pCMV-EGFP空载的细胞系为对照组,取3个生物学重复,进行转录和蛋白水平上的鉴定。以18S为内参,用荧光定量PCR(qRT-PCR)检测AKT2 m-RNA的表达水平。根据GenBank 中的ScAKT2序列(GenBank 号:KY984992.1),设计引物F(AGCCACAAGTTCTTCACCTCCATC)和R(CGCTGATCTGAATCCTCCGCATC),扩增片段大小为188 bp;以cDNA为模板,18S为内参(所用引物的相关信息见表1),使用TB Green®Premix ExTaqTMⅡ (Tli RNaseH Plus)检测AKT2 mRNA的表达水平。总体系为20 μL:2×SYBR预混剂TaqTM10 μL,正、反引物(10 μmol/L) 0.5 μL,ROX参比染料Ⅱ0.5 μL,cDNA 2 μL,水6.5 μL。PCR反应程序为:95 ℃预变性 30 s;95 ℃ 变性 5 s,56 ℃复性 30 s,共 40 个循环。采集荧光信号,采用2-ΔΔCt法计算AKT2 mRNA的相对表达量。以β-actin蛋白为内参,用Western blot检测过表达AKT2细胞蛋白的相对表达水平。

表1 荧光定量PCR所用的引物及其相关信息Table 1 Related information of the primers used in fluorescence quantitative PCR
1.2.6 过表达AKT2的CPB细胞抗病毒能力分析 (1)过表达AKT2对ISKNV病毒拷贝数的影响。根据ISKNV在CPB细胞上的增殖周期[13],用构建成功的过表达AKT2和空载的CPB细胞分别感染ISKNV (感染复数(MOI)为1),在感染后于ISKNV的增殖早期(36,48 h)提取CPB细胞的DNA,以提取的DNA为模板,用qPCR法[14]测定ISKNVORF007基因的病毒拷贝数,所用的ORF007引物及探针引物ORF007-probe的相关信息见表1。
(2)过表达AKT2对ISKNV-MCP蛋白的影响。在感染ISKNV 48 h后,提取CPB细胞的总蛋白,设置3个复孔,以ISKNV-MCP(1∶500)单抗、β-actin抗体(1∶5 000)(内参)为一抗,用Western blot检测ISKNV-MCP蛋白的表达情况。
(3)过表达AKT2对先天免疫因子在转录水平上相对表达量的影响。以cDNA为模板,18S为内参,用qRT-PCR法检测ScIRF3、ScIRF7、ScIL8、ScMx、ScTRAF2、ScTRAF3等先天免疫因子在转录水平上的表达情况。根据GenBank中公布的相关序列,采用Primer 5.0软件设计引物,引物的相关信息见表1。PCR反应体系和程序同1.2.5(4),采用2-ΔΔCt方法计算各基因mRNA的相对表达水平。
1.3 数据统计与分析
采用GraphPad prime 6.0进行数据整理和制图,使用SPASS 21.0进行数据差异相关性分析。试验数据表示为“平均值±标准误”,n=3,以“*”代表P<0.05,“**”代表P<0.01。
2 结果与分析
2.1 ScAKT2 ORF的克隆及原核表达质粒的构建
经PCR扩增得到约1 400 bp的AKT2 ORF片段(图1-A),与预期大小相符。测序结果表明,鳜AKT2的ORF为1 449 bp。原核表达质粒pET32a-ScAKT2的PCR扩增获得了约1 400 bp的片段(图1-B),测序鉴定获得了1 449 bp的片段,表明原核表达质粒pET32a-ScAKT2构建成功。

A.鳜AKT2 ORF的克隆;B.原核表达质粒pET32a-ScAKT2的PCR鉴定;M.DNA Marker DL15000;1~4.AKT2ORF的克隆;5,9.AKT2 ORF转化失败的样品;6~8.AKT2 ORF转化成功的样品A.Cloning of AKT2 ORF;B.PCR identification of prokaryotic expression plasmid pET32a-ScAKT2.M;DNA Marker DL15000;1-4.Cloning of AKT2 ORF;5,9.Samples failed transfected with AKT2 ORF;6-8.Samples successfully transfected with AKT2 ORF图1 鳜AKT2 ORF克隆及原核表达质粒的鉴定Fig.1 Cloning of AKT2 ORF and identification of prokaryotic expression plasmid
2.2 ScAKT2重组蛋白的诱导表达及纯化
经SDS-PAGE检测,在沉淀中检测到约72 ku(含标签约20 ku)的条带(图2-A),说明ScAKT2重组蛋白以包涵体的形式表达。纯化后,重组蛋白主要集中在72 ku左右 (图2-B),可以进行后续免疫试验。

A.AKT2融合蛋白的SDS-PAGE 分析;B.AKT2融合蛋白的纯化;M.蛋白Marker;1.沉淀;2.上清;3.纯化后的AKT2融合蛋白A.SDS-PAGE analysis of AKT2 fusion protein;B.Purification of AKT2 fusion protein;M.Protein Marker;1.Precipitation;2.Supernatant;3.ScAKT2 fusion protein after purification图2 鳜AKT2融合蛋白的诱导表达及纯化Fig.2 Induction,expression and purification of ScAKT2 fusion protein
2.3 抗ScAKT2多克隆抗体的制备
用纯化的重组AKT2蛋白免疫日本大耳兔,间接ELISA法测定血清免疫效价可达1∶256 000(图3-A)。对纯化的ScAKT2多克隆抗体进行SDS-PAGE检测,结果有两条条带,其中一条为多克隆抗体的重链(约45 ku),另一条为轻链(约25 ku),纯化效果良好(图3-B)。经BCA法测定,纯化后的抗体质量浓度约为10 mg/mL。

A.抗ScAKT2抗体的免疫效价;B.抗ScAKT2抗体的纯化;M.蛋白Marker;1.纯化后的抗体A.The immune titer of anti-ScAKT2 antibody;B.Anti-ScAKT2 antibody purification;M.Protein Marker;1.Purified antibody图3 抗ScAKT2多克隆抗体效价的测定与纯化Fig.3 Determination of anti-ScAKT2 polyclonal antibody titer and purified antibody
制备的多抗经Western blot鉴定,在约60 ku处有1条特异性条带(图4-A),表明制备的多克隆抗体能特异性识别CPB细胞的AKT2蛋白。间接免疫荧光试验证实,所制备的抗ScAKT2多抗可识别CPB细胞,且ScAKT2主要在CPB细胞的细胞质中表达(图4-B)。
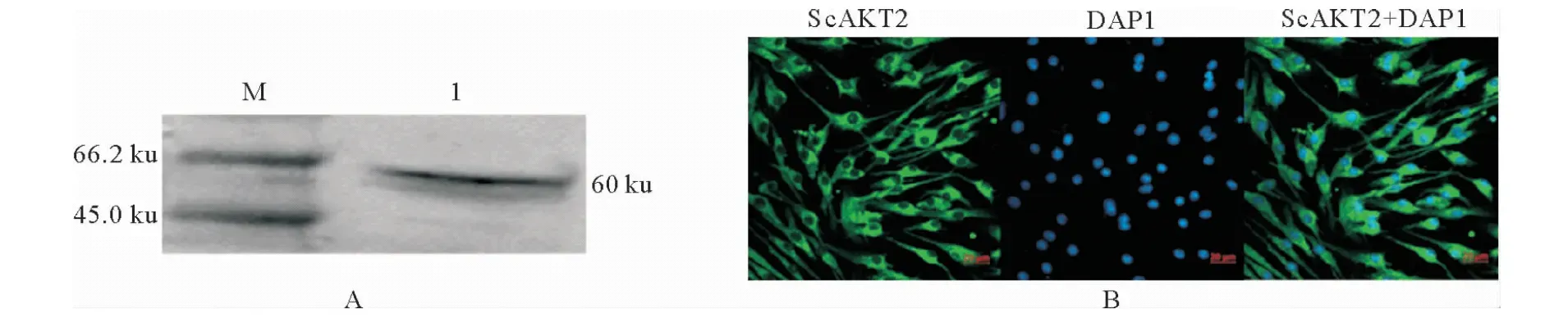
A.Western blot结果;B.间接免疫荧光结果;M.蛋白Marker;1.抗体与CPB细胞特异性结合A.Western blot result;B.Indirect fluorescent immune result;M.Protein Marker;1.Specific binding between antibodies and CPB cells图4 抗ScAKT2多克隆抗体的特异性分析Fig.4 Analysis of specificity of anti-ScAKT2 polyclonal antibody
2.4 ScAKT2过表达CPB细胞系的构建
经PCR扩增得到约1 400 bp的带有酶切位点EcoR Ⅰ、KpnⅠ的ScAKT2 ORF片段(图5-A);测序结果显示,成功克隆到1 449 bp的ORF片段。过表达载体pCMV-EGFP-ScAKT2 PCR扩增获得了约1 400 bp的片段(图5-B),测序结果表明,过表达载体pCMV-EGFP-ScAKT2构建成功。

A.鳜AKT2 ORF的克隆;B.真核表达质粒pCMV-EGFP-AKT2的PCR鉴定;M.DNA Marker DL10000;1~3.AKT2 ORF的克隆;5,10.转化失败的样品;6~9.转化成功的样品A.Cloning of AKT2 ORF;B.PCR identification of eukaryotic expression plasmid pCMV-EGFP-AKT2;M.DNA Marker DL10000;1-3.Cloning of AKT2 ORF;5,10.Samples failed transfected with AKT2 ORF;6-9.Samples successfully transfected with AKT2 ORF图5 鳜AKT2 ORF的克隆及真核表达质粒的鉴定Fig.5 Cloning of AKT2 ORF and identification of eukaryotic expression plasmid
经过G418多次加压筛选,pCMV-EGFP和pCMV-EGFP-ScAKT2 CPB的细胞系约有80%的细胞可稳定表达EGFP(图6-A、B)。qRT-PCR结果表明,在pCMV-EGFP-ScAKT2的CPB细胞系中,ScAKT2 mRNA的相对表达量极显著高于pCMV-EGFP CPB细胞系(图6-C)。Western blot结果显示,在pCMV-EGFP-ScAKT2的CPB细胞系中,ScAKT2蛋白的表达量明显高于pCMV-EGFP细胞系(图6-D)。以上结果表明,已成功获得了ScAKT2过表达CPB细胞系。

A.稳定转染pCMV-EGFP的CPB细胞;B.稳定转染pCMV-EGFP-ScAKT2的CPB细胞;C.ScAKT2 mRNA相对表达量;D.ScAKT2蛋白的表达量。图柱上标**表示与pCMV-EGFP CPB组差异极显著(P<0.01)A.CPB cells stably transfected with pCMV-EGFP;B.CPB cells stably transfected with pCMV-EGFP-ScAKT2;C.Relative expression of ScAKT2 mRNA;D.The expression of ScAKT2 protein.**indicates extremely significant difference from the pCMV-EGFP CPB group (P<0.01)图6 过表达ScAKT2细胞系的构建与鉴定Fig.6 Construction and identification of overexpression ScAKT2 cell lines
2.5 过表达ScAKT2 CPB细胞的抗病毒能力分析
分别于感染ISKNV后36 和48 h提取DNA样品,用qPCR法测定ISKNV含量。结果(图7)显示,pCMV-EGFP-ScAKT2 CPB细胞中的ISKNV含量极显著低于pCMV-EGFP CPB细胞系。同时,于48 h收取总蛋白样品,用Western blot法测定ISKNV-MCP蛋白的表达情况,结果见图8。图8显示,在过表达ScAKT2的CPB细胞中,ISKNV-MCP蛋白的表达被抑制。在感染ISKNV后分别于36和48 h提取细胞总RNA样品,用RT-PCR法检测先天免疫因子的转录水平,结果(图9)显示,ScIRF3、ScIRF7、ScIL8、ScMx、ScTRAF2和ScTRAF3的mRNA均显著上调,且上调效果具时间依赖性。

图柱上“**”表示差异极显著(P<0.01)** on the column indicates an extremely significant difference (P<0.01)图7 过表达ScAKT2对ISKNV增殖的影响Fig.7 Effect of the proliferation of ISKNV with overexpression ScAKT2

图8 过表达ScAKT2对ISKNV-MCP蛋白的影响Fig.8 Effect of ISKNV-MCP protein with overexpression ScAKT2
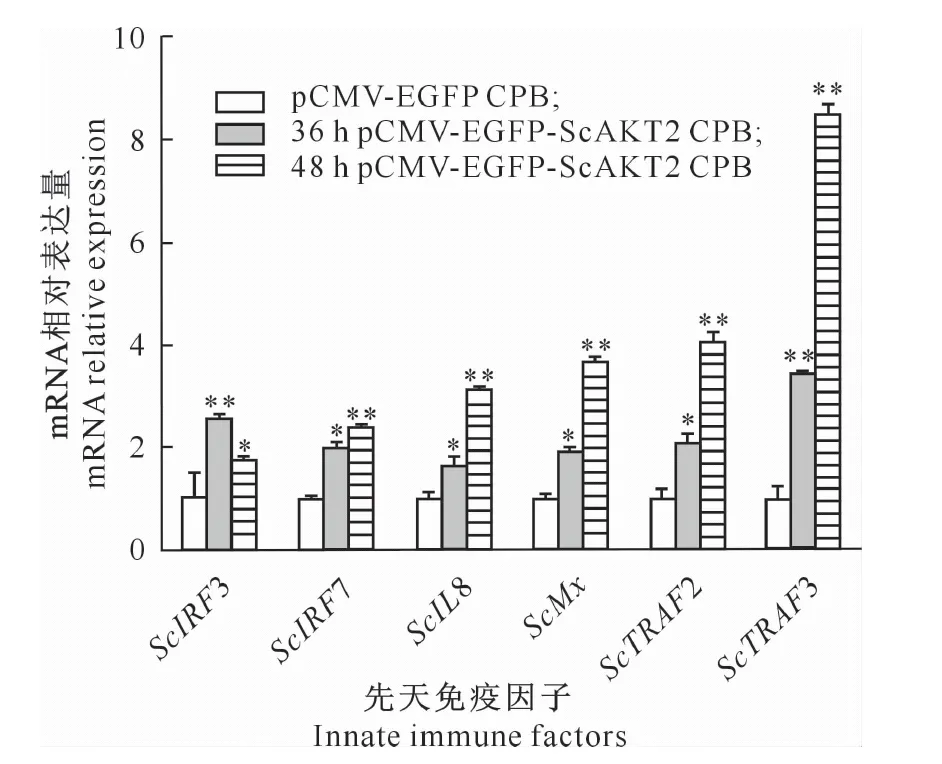
图柱上标*、**表示与pCMV-EGFP CPB转染组相比差异显著(P<0.05))或极显著(P<0.01)*,** on the column indicates a significant difference (P<0.05) or an extremely significant difference (P<0.01) from the pCMV-EGFP CPB group图9 过表达ScAKT2对先天免疫因子mRNA表达的影响Fig.9 Effect of the mRNA expression of innate immune factors with overexpression ScAKT2
3 讨 论
AKT是多种细胞过程的关键调控因子,在细胞存活和凋亡中扮演着重要角色。已有大量研究表明,病毒侵染细胞期间,AKT途径被激活,进而抑制病毒的增殖。本研究结果表明,鳜AKT2可抑制ISKNV复制增殖,这为鳜传染性脾肾坏死病毒病的防控提供了新的靶点。
AKT作为一个抗病毒靶标,对许多病毒的增殖有抑制作用。登革热病毒(dengue virus,DENV) 和日本脑炎病毒(Japanese encephalitis virus,JEV)感染可激活机体的AKT途径,抑制病毒的复制增殖[15]。阻断AKT的激活,可提高血清型3型呼肠孤病毒(the sero-type 3 reovirus)RNA的增殖[16]。在乙型肝炎(HBV)[17]和丙型肝炎病毒(hepatitis C virus,HCV)[18]持续感染的情况下,机体AKT途径被激活,从而抑制病毒复制,促进细胞存活。口蹄疫病毒(foot-and-mouth disease virus,FMDV)的VP1蛋白可抑制AKT途径,从而促进病毒的复制增殖[19]。机体AKT的活化,可抑制肠道病毒71型(enterovirus 71,EV71)的感染,为EV71的防控提供新的靶标[20-21]。在牛流行热病毒(bovine ephemeral fever virus,BEFV)感染后期,机体AKT途径被抑制,进而导致病毒的增殖增强[22]。 寨卡病毒(ZIKV)的NS4A和NS4B蛋白可感染人胚胎神经干细胞,导致AKT被抑制[23],使病毒的复制增强,最终导致神经发生缺陷。为了研究ScAKT2的抗病毒功能,本试验制备了ScAKT2多克隆抗体,间接免疫荧光(IFA)和Western blot试验证实,ScAKT2多克隆抗体可以与ScAKT2蛋白进行特异性反应。本试验进一步构建了ScAKT2过表达细胞系,并用qPCR和Western blot法检测了过表达ScAKT2后ISKNV复制的变化情况,结果显示,ScAKT2过表达可抑制ISKNV的增殖,表明在ISKNV侵染细胞过程中,ScAKT2对ISKNV的复制增殖具有抑制作用。
哺乳动物感染呼肠孤病毒(mammalian reovirus)后,机体AKT被活化从而会激活IFN刺激反应元件(ISRE),并上调IFN刺激基因(ISGs)[24]。Hrincius等[25]研究表明,机体感染流感病毒时,AKT可以通过维甲酸诱导基因Ⅰ(retinoic acid-inducible gene Ⅰ,RIG-Ⅰ)依赖性的信号途径被激活,并促进IRF3激活和Ⅰ型干扰素表达。有报道指出,AKT3的敲除可抑制IRF3的活化,显著降低IFN-β的产生,并提高病毒载量;AKT3的活化可激活IRF3,从而提高IFN-β的产生和增强抗病毒功能[26]。本试验发现,过表达ScAKT2的CPB细胞可通过上调先天免疫因子ScIRF3、ScIRF7和ScTRAF2等的表达来抑制ISKNV的增殖,这为鳜病毒治疗药物的研发提供了一个新的靶点,也为更深入地探讨ISKNV与寄主互作的致病机制提供了新的方向。
——一道江苏高考题的奥秘解读和拓展

