杨梅果渣醇提物降糖活性组分筛选及其功能评价
张加干,唐伟敏,刘 哲,陆胜民*,夏其乐,周裔彬
(1 安徽农业大学茶与食品科技学院 合肥230036 2 浙江省农业科学院食品科学研究所 浙江省果蔬保鲜与加工技术研究重点实验室农业部果品采后处理重点实验室 杭州310021)
糖尿病以慢性高血糖为特征,已成为世界各国的一大健康问题[1-2]。根据世界卫生组织(WHO)统计,2014年全球估计有4.22 亿成人患有糖尿病,其中II 型糖尿病占总数的90%。糖尿病及其并发症的治疗越来越受到关注。二甲双胍、罗格列酮等化学药物被广泛应用于糖尿病的治疗,而其副作用对患者的健康造成很大的损害[2]。大量研究表明从植物中提取的活性成分对糖尿病的治疗效果良好,且无毒副作用[3-6]。
杨梅(Myrica rubra Sieb.et Zucc)原产于中国,口感鲜美,色泽诱人,富含糖、酸、维生素和矿物质等营养物质,在我国南方已经有2 000 多年的种植历史[7]。杨梅成熟期为高温、多雨的6-7月,果实无外果皮包裹,贮藏及运输十分困难[8]。杨梅常被加工成果汁和果酒等产品,产生约占鲜重30%~40%的果渣[9]。目前对杨梅果渣开发利用的研究较少。杨梅富含多酚、黄酮等植物次级代谢产物,前人的研究发现其具有抗氧化[9-11]、抗炎[12]、抑菌[13]、止泻[14]等功能。近期研究表明,杨梅提取物具有抗癌活性[15-17],调节脂质代谢[18]等功能。另外,还发现杨梅中的黄酮类化合物对α-葡萄糖苷酶有较高的抑制活性[19]。目前,对杨梅提取物的化学成分和抗氧化性能、体外降糖活性的研究很多,而对杨梅提取物的体内降糖活性评价相对较少。
本研究以总花色苷、总黄酮和总酚含量以及α-葡萄糖苷酶抑制活性为指标,对AB-8 大孔树脂纯化杨梅果渣醇提物的不同组分进行筛选。采用链脲佐菌素(STZ)诱导的II 型糖尿病小鼠模型,以体重、空腹血糖和血清生化(总胆固醇、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇等)以及病理形态(肝脏和肾脏)为指标,评价其改善II 型糖尿病及其并发症的效果,为将杨梅果渣醇提物开发成为具有降糖功效的天然功能性食品配料提供试验依据。
1 材料与方法
1.1 材料与试剂
杨梅冷冻果渣由浙江杨百利饮品有限责任公司提供。AB-8 大孔树脂,天津允开树脂科技有限公司。链脲佐菌素(STZ),Sigma 公司;罗氏血糖试纸,罗氏诊断产品(上海)有限公司;福林酚、阿卡波糖(Acarbose)和对硝基苯基-α-D-吡喃葡萄糖苷(PNPG),上海源叶生物科技有限公司;其它试剂,国药集团化学试剂有限公司。
1.2 设备与仪器
高速多功能粉碎机(BJ-200),德清拜杰电器有限公司;冷冻干燥机(SCIENTZ-18N),宁波新芝生物科技股份有限公司;数控超声波清洗器(KQ-500DB),昆山市超声仪器有限公司;离心机(LXJHB),上海安亭科学仪器厂;旋转蒸发仪(R1002B),上海申生科技有限公司;层析柱(55 mm×800 mm),上海沪西分析仪器厂有限公司;电子天平(BS200S-WE1),余姚金诺电子天平仪器有限公司;紫外-可见分光光度仪(UV-1800),日本岛津公司;电热恒温水槽(DK-8B),上海精宏实验设备有限公司;多功能酶标仪(ELx800),美国伯腾仪器有限公司;高效液相色谱仪(Waters 2695-2487),美国沃特世公司;飞行时间质谱仪(Agilent 6210),安捷伦科技有限公司;罗氏(rRoche)血糖仪,罗氏诊断产品(上海)有限公司;全自动生化分析仪(AU5800),美国贝克曼库尔特有限公司。
1.3 杨梅果渣醇提物的制备
杨梅果渣经冷冻干燥后粉碎,过60 目筛,于-40 ℃保存备用。预处理后的杨梅果渣按料液比1∶20(m/V)加入95%乙醇进行超声辅助(500 W,30 min)提取,室温离心(4 000 r/min,20 min)后收集上清液。残渣重复提取两次,合并上清液,经减压浓缩制得提取物浓缩液[20]。取浓缩液(50 mg/mL)100 mL 经AB-8 大孔树脂过柱(55 mm×800 mm)纯化,分别用2 床体积(BV)不同体积分数的乙醇(10%,30%,50%,70%和90%)洗脱(2 BV/h),收集各洗脱液,经减压浓缩、冷冻干燥制得不同洗脱组分。
1.4 实验动物与高脂饲料
6 周龄清洁级雌性ICR 小鼠购自上海斯莱克实验动物有限公司,饲养于实验室。自购IVC 独立送风饲养笼具,环境温度为(22±2)℃,昼夜循环12 h。饲喂辐照饲料和水,小鼠适应性饲养1周后开始实验。高脂饲料:猪油10%,蔗糖5%,蛋黄粉5%,胆固醇1%,胆盐0.1%,基础饲料78.9%。
1.5 总花色苷、总黄酮和总酚含量测定
花色苷含量的测定采用pH 示差法[21],结果以相当于mg 矢车菊素-3-O-葡萄糖苷(C3G)/g DW(DW:冷冻干燥后的质量)为单位计算总花色苷含量。总黄酮含量的测定参照硝酸铝络合分光光度法[22],以mg 芦丁(Rutin,RE)/g DW 为单位计算总黄酮含量。总酚含量的测定使用福林酚法[23],以mg 没食子酸(Gallic acid equivalent,GAE)/g DW 为单位计算总酚含量。
1.6 α-葡萄糖苷酶的抑制活性测定
α-葡萄糖苷酶的抑制活性参考Kumar 等[24]方法,并加以修改。将α-葡萄糖苷酶配制成0.4 U/mL 母液,依次在96 孔板中加入0.1 mol/L 磷酸钾液(560 μL)、α-葡萄糖苷酶母液(100 μL)和样品溶液(40 μL),混匀,于37 ℃恒温静置15 min。加入2.5 mol/L PNPG(100 μL),37 ℃恒温反应15 min,加入2.5 mol/L Na2CO3溶液(400 μL)终止反应,用酶标仪测定405 nm 处的吸光值(A1)。以不加样品的为对照(A0),不加α-葡萄糖苷酶的作为空白对照(A2),阿卡波糖作阳性对照。α-葡萄糖苷酶抑制率计算公式:
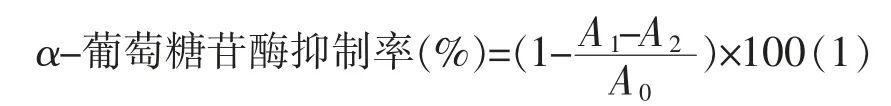
1.7 II 型糖尿病小鼠造模及分组
按照随机数字表法从130 只小鼠中随机选取8 只作为正常对照组给予基础饲料饲养,模型组120 只小鼠给予高脂高糖饲料。两周后,所有模型组小鼠腹腔被注射柠檬酸-柠檬酸钠缓冲液(pH 4.5)稀释的100 mg STZ/kg 体重(BW),1 周后重复注射1 次。同时,正常对照组小鼠腹腔注射等量的柠檬酸-柠檬酸钠缓冲液(pH4.5)。STZ 注射1 周后,用血糖仪测定所有小鼠空腹血糖,至少2 次血糖值大于11 mmol/L 时,建模成功。反之,则剔除试验。
将建模成功的小鼠按照随机数字表法分为B-E 共4 组,A 组为正常对照组,每组各8 只。具体分组情况见表1。
1.8 给药方法
建模成功后,A 组与B 组小鼠灌300 mg/kg BW 生理盐水,C-E 组小鼠每天分别灌胃300 mg/kg BW 二甲双胍、100 mg/kg BW EC30 和300 mg/kg BW 的EC30,连续灌喂3 周。
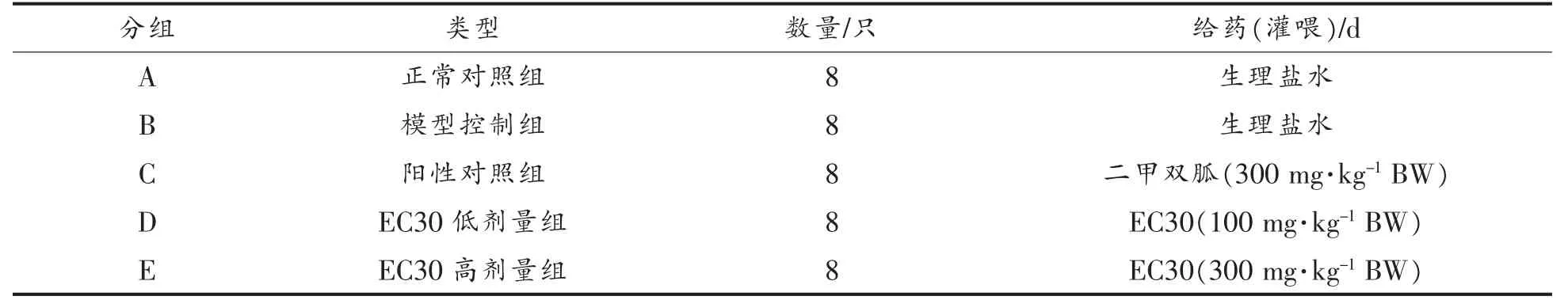
表1 实验分组及给药Table 1 Experimental grouping and administration
1.9 体重和空腹血糖测定
小鼠体重每周测定2 次,空腹血糖每周测定1 次。禁食12 h 后,小鼠尾部取血,用血糖仪测定各组空腹血糖值。
1.10 血清的生化检测
给药3 周后,将小鼠禁食12 h,称重,随后眼眶静脉取血,颈椎脱臼处死,取肾脏和肝脏,快速称重,置4%多聚甲醛溶液中。取血后,室温静置,凝结后离心分离血清,用全自动生化分析仪检测以下指标:①血脂:总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-c)和低密度脂蛋白胆固醇(LDL-c);②肝功能:谷丙转氨酶(GPT/ALT)、谷草转氨酶(GOT/AST);③肾功能:尿素氮(BUN)、血肌酐(Cr);④抗氧化水平:超氧化物歧化酶(SOD)、丙二醛(MDA)。
1.11 病理形态学分析
取部分肾组织和右叶肝组织置于10%多聚甲醛中固定24 h,常规石蜡包埋,10 μm 切片,肾组织和肝组织进行苏木精-伊红(H & E)染色,观察并分析组织的病理形态学改变。
1.12 统计分析
2 结果与分析
2.1 不同浓度乙醇洗脱组分中总花色苷、总黄酮和总酚含量
大孔树脂具有较好的选择性,吸附量大,吸附速度快,可再生等优点,常用于天然化合物的初步分离,如AB-8、D101 等树脂常用于黄酮类化合物的分离纯化。采用AB-8 大孔树脂纯化杨梅果渣醇提物,结果发现在杨梅果渣乙醇粗提物和5 个体积分数乙醇的洗脱组分中,30%乙醇洗脱组分(Elution component 30,EC30)的总花色苷、总黄酮和总酚含量显著高于其它组分(P<0.05)(表2),其总花色苷、总黄酮和总酚含量分别为(289.89 ± 11.92)mg C3G/g DW,(376.34 ±9.94)mg RE/g DW 和(663.92±34.07)mg GAE/g DW。相比于粗提物,EC30 的总花色苷、总黄酮和总酚含量分别提高5.5,12.4 倍和11.4 倍。AB-8 树脂对杨梅果渣醇提物中的花色苷、黄酮和酚类均有良好的富集效果,且用30%乙醇洗脱效果最佳。

表2 不同体积分数乙醇对洗脱组分中总花色苷、总黄酮和总酚含量的影响Table 2 Effect of different ethanol concentrations on total anthocyanin,total flavonoids and total phenol content in elution components
2.2 α-葡萄糖苷酶抑制活性评价
α-葡萄糖苷酶是膳食碳水化合物转化为葡萄糖的关键酶,可通过其抑制活性来筛选降糖活性成分。杨梅果渣粗提物和5 种洗脱组分对α-葡萄糖苷酶活性的半抑制浓度(IC50)在0.006~0.137 mg/mL(图1)。粗提物和5 种洗脱组分对α-葡萄糖苷酶的IC50随乙醇浓度的提高呈先下降后升高的趋势。其中,EC30 对α-葡萄糖苷酶的IC50虽最低,为(0.006±0.001)mg/mL,但仍显著高于阳性对照阿卡波糖(P<0.05)。以上结果表明,采用AB-8 大孔树脂对杨梅果渣提取物进行初步纯化,5 个浓度的乙醇洗脱液中以EC30 对α-葡萄糖苷酶的抑制效果最佳。
2.3 EC30 对小鼠体重、空腹血糖水平的影响
杨梅果渣粗提物和5 个乙醇体积分数的洗脱组分中,EC30 的总花色苷、总黄酮和总酚含量显著高于其它组分(P<0.05),且具有最高的α-葡萄糖苷酶抑制活性。基于以上结果,采用糖尿病小鼠模型来评价EC30 的降糖作用。EC30 对STZ 诱导的小鼠体重的影响如图2a所示。在第1 周,糖尿病小鼠体重显著低于正常对照组(A)小鼠(P<0.05),这是因为注射STZ 导致体重减轻[25]。在接下来的2 周,模型控制组(B)小鼠体重缓慢增加,而EC30 组(D 和E)和正常对照组(A)体重显著增加(P<0.05),表明不同剂量的EC30 对小鼠体重减轻有一定的缓解作用,且当EC30 为100 mg/kg BW时效果最佳。
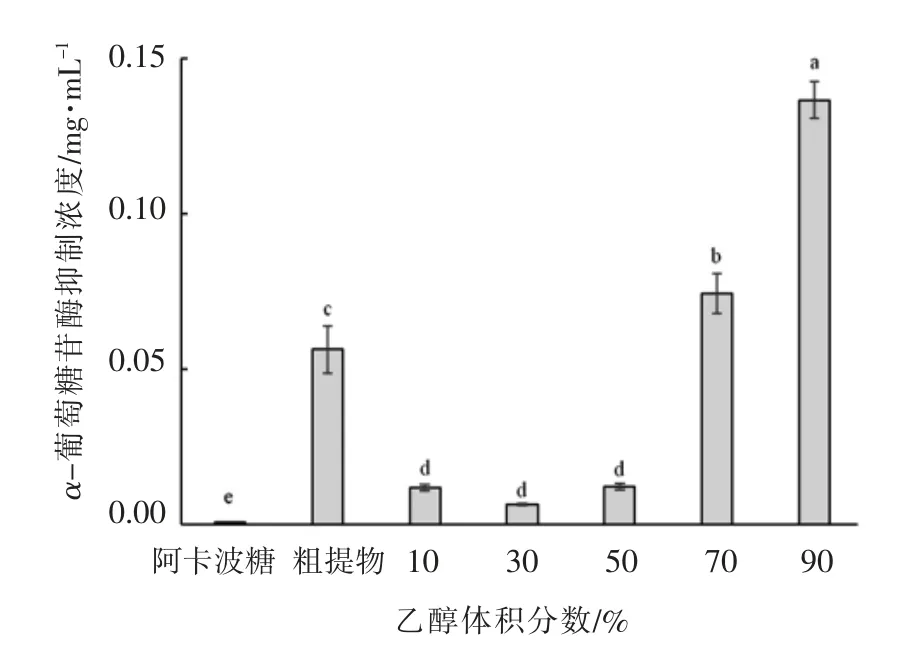
图1 杨梅果渣粗提物和不同浓度乙醇洗脱组分对α-葡萄糖苷酶半抑制浓度的影响Fig.1 Effects of crude extracts of bayberry pomace and different ethanol concentration on the IC50 of α-glucosidase
空腹血糖的升高也是II 型糖尿病的重要特征[26]。使用空腹血糖值来评价EC30 对葡萄糖代谢的影响,如图2b所示。EC30 给药3 周导致STZ 诱导的糖尿病小鼠空腹血糖水平呈剂量依赖性下降,并且两种剂量给药1 周后空腹血糖水平均显著低于模型控制组(B),其降糖作用显著低于二甲双胍(300 mg/kg BW)(P<0.05)。
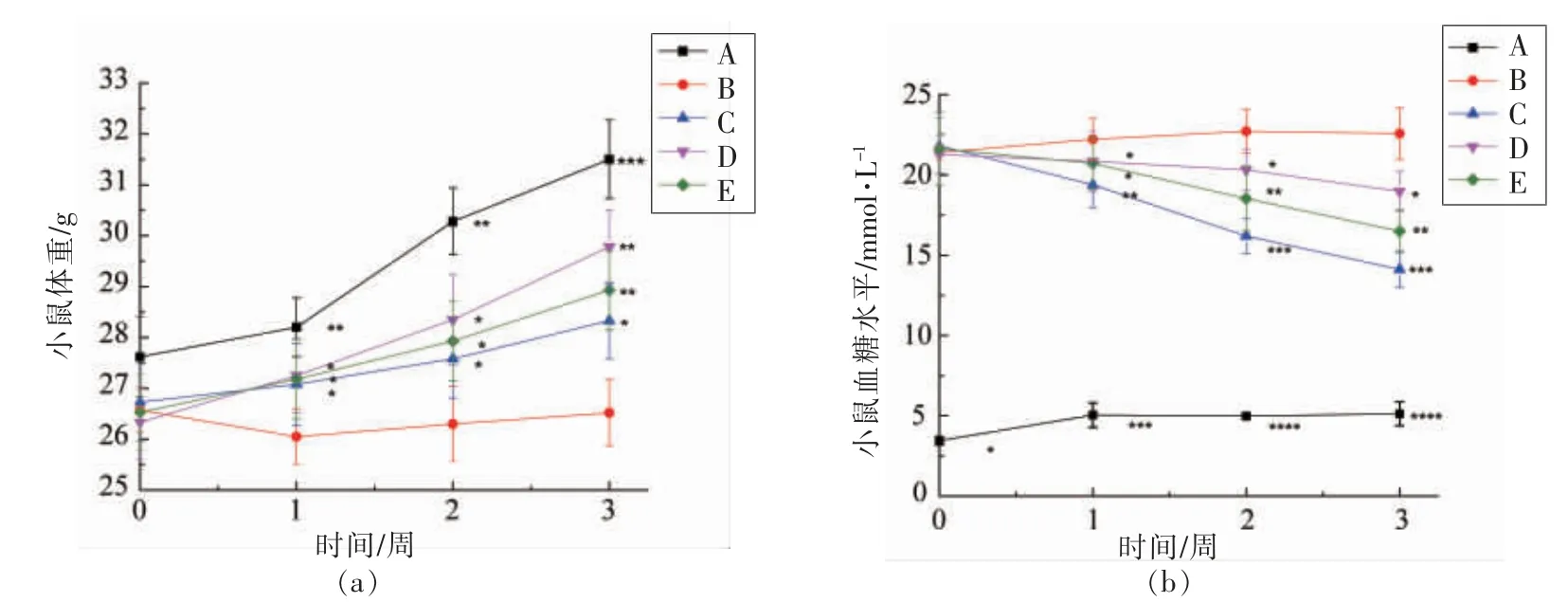
图2 EC30 对小鼠体重(a)和空腹血糖(b)的影响Fig.2 Effect of EC30 on body weight(a)and fasting blood glucose(b)in mice
2.4 EC30 对STZ 诱导的II 型糖尿病小鼠血脂水平的影响
如表3所示,模型控制组(B)小鼠血清的TC、TG 和LDL-c 水平显著高于正常对照组(A),尤其是TC 和LDL-c 水平。给药3 周后,EC30 组(D 和E)的TC、TG 和LDL-c 水平显著低于B 组(P<0.05)。E 组小鼠血清的高密度脂蛋白胆固醇(HDL-c)水平显著低于B 组(P<0.05),而D 组的HDL-c 水平与B 组无显著性差异(P>0.05)。
EC30 对STZ 诱导的II 型糖尿病小鼠血清抗氧化酶和丙二醛(MDA)的影响见表4。模型控制组(B)小鼠血清的超氧化物歧化酶(SOD)活性显著低于正常对照组(A)(P<0.05)。EC30 组(D 和E)小鼠的MDA 含量显著低于其它组,其SOD 活性显著高于B 组(P<0.05),说明EC30 对糖尿病小鼠的抗氧化活性的修复作用显著。与模型控制组(B)相比,EC30 组(D 和E)的谷丙转氨酶(GPT/ALT)、尿素氮(BUN)、谷草转氨酶(AST/GOT)和肌酐(Cr)等指标变化无明显规律。

表3 EC30 对STZ 诱导的II 型糖尿病小鼠血脂水平的影响Table 3 Effect of EC30 on blood lipid levels in STZ-induced type II diabetic mice
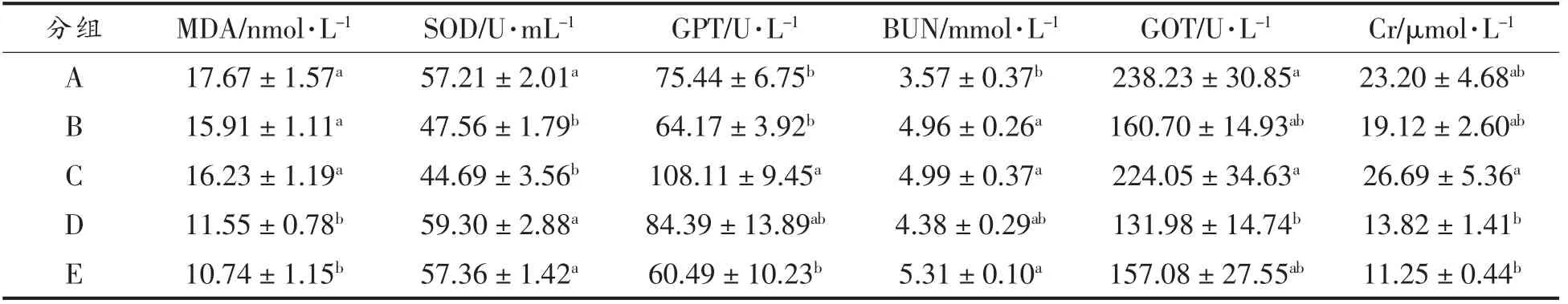
表4 EC30 对STZ 诱导的II 型糖尿病小鼠抗氧化酶和MDA 的影响Table 4 Effect of EC30 on antioxidant enzymes and MDA in STZ-induced type II diabetic mice
2.5 病理形态学观察
肝脏组织形态学观察采用H & E 染色,结果见图3 A。与细胞形态完整、排列有序的正常组小鼠相比(图3 A1),糖尿病小鼠肝脏的大量肝细胞损伤,其特征为细胞缺陷、肝细胞坏死和黏液性肝细胞(图3 A2)。EC30 的灌喂显示出改善组织病理学证据,即坏死区减少和脂滴积聚对STZ 诱导的组织学改变的减弱(图3 A4 和3A5),表明给予低剂量EC30 可改善糖尿病的肝脏组织。

图3 小鼠肝脏、肾脏H & E 染色结果Fig.3 Mouse liver and kidney H&E staining results
肾脏组织H&E 染色结果如图3 B所示。STZ诱导糖尿病小鼠的肝脏比正常小鼠受损明显(图3 B2)。模型控制组小鼠肾小管受损,肾小球部分结合和硬化,系膜细胞增生肥大和淋巴细胞浸润。EC30 明显减轻了肝脏组织学损伤,而以100 mg/kg BW 灌喂剂量效果最佳(图3 B4)。
对细胞毒性敏感的肝脏、肾脏在糖尿病动物的葡萄糖代谢中有重要作用。肝脏和肾脏的组织学结果表明,EC30 对STZ 损伤的器官有一定的修复作用,对于改善糖尿病小鼠细胞酶活性,恢复细胞功能具有重要作用。
3 结论
采用AB-8 大孔树脂筛选杨梅果渣醇提物活性成分,其中EC30 的总花色苷、总黄酮和总酚含量显著高于其它组分(P<0.05),分别为(289.89 ±11.92)mg C3G/g DW,(376.34 ± 9.94)mg RE/g DW 和(663.92±34.07)mg GAE/g DW,相比粗提液分别提高5.5,12.4 倍和11.4 倍。AB-8 大孔树脂对杨梅果渣醇提物中花色苷、黄酮和酚类成分有良好的富集作用,30%乙醇洗脱浓度效果最佳,且EC30 对α-葡萄糖苷酶的半抑制浓度IC50最低,为(0.006±0.001)mg/mL。EC30 可缓解II 型糖尿病小鼠体重减轻症状,降低小鼠空腹血糖水平;显著降低糖尿病小鼠总胆固醇、甘油三酯和低密度脂蛋白胆固醇水平(P<0.05),并通过增加超氧化物歧化酶等抗氧化酶的活性来降低氧化应激反应。此外,组织病理学观察表明,EC30 对糖尿病小鼠肝脏和肾脏细胞有一定的修复作用。以上结果表明,杨梅果渣醇提物有潜力成为具有降糖功效的天然功能性食品添加剂。

