沙门菌核酸检测试剂盒评价
陈赛阁,付 盼,何磊燕,张 蕾,王爱敏,李春玲,王传清
复旦大学附属儿科医院细菌室,上海 201102
感染性腹泻是指各种细菌、病毒、真菌、寄生虫感染引起肠道炎症所致的急、慢性腹泻,是全球最常见的一类疾病,相关调查显示,中国感染性腹泻的年发病频率约为0.9次/人,5岁以下儿童的年发病频率则为2.1次/人[1],因此加强对小儿感染性腹泻的防控显得尤为重要。另有研究表明沙门菌是小儿感染性腹泻的主要病原菌[2]。沙门菌是一种革兰阴性肠杆菌,也是肠杆菌科中最主要的食源性致病菌,蛋、家禽和肉类产品是沙门菌的主要传播媒介[3]。目前,主要通过传统培养法即标本增菌、分离培养、生化及血清学鉴定试验检测临床标本,此方法准确且可靠性高,但它操作复杂、检测周期长,所需试剂繁多,具有一定的局限性[4]。由于沙门菌传染性强,易引起暴发或者流行,个别重症患者病情进展快,尤其是儿童,易发生死亡,因此沙门菌的检测需要向快速检测技术转变[5]。沙门菌和志贺菌检测试剂盒(PCR-荧光探针法)基于PCR原理以及Taqman荧光探针技术,采用三色荧光PCR在全封闭的扩增体系中检测沙门菌和志贺菌的特异性基因片段,从而实现对标本的多重、快速检测;在体系中检测内参基因,对待测标本核酸的提取及扩增进行全程监控,可以防止假阴性的出现;同时使用尿嘧啶DNA糖基化酶(UDG酶)和脱氧尿苷三鳞酸(dUTP),避免扩增产物污染。本研究对此产品的多项性能指标进行了评价,旨在评估产品质量和有效性。
1 材料与方法
1.1标本来源 将2018年5月至2018年11月于本院门诊就诊且临床诊断为感染性腹泻的患者标本纳入研究。感染性腹泻诊断标准参照《诸福棠实用儿科学》相关章节[6]。剔除无法进行溯源的病例标本、非本院来源的病例标本、重复病例的标本。
1.2仪器与试剂 木糖-赖氨酸-脱氧胆酸(XLD)平板、亚硒酸盐磺绿(SBG)沙门菌增菌液、沙门菌显色平板(CAS平板)、Cary-Blair氏运送培养基均购自上海科玛嘉微生物技术有限公司;克氏双糖和肠道发酵管(Ⅱ)为本实验室自配,ABI7500型实时荧光定量PCR仪为美国应用生物系统公司产品,核酸提取试剂盒、沙门菌和志贺菌核酸检测试剂盒为上海速创诊断产品有限公司的产品。
1.2方法
1.2.1肠道沙门菌、志贺菌培养及鉴定 挑取Cary-Blair氏运送培养基中的脓血、黏液样粪便,或直肠拭子,接种于XLD平板上,将平板于35 ℃培养18~24 h后观察菌落。同时将沾有标本的棉签在SBG增菌液中洗脱,增菌液于35 ℃培养18~24 h后观察有无颜色变化,将过夜后变色浑浊的增菌液转种XLD平板,于35 ℃培养18~24 h后观察菌落。沙门菌:挑取XLD平板上中央带有黑心的2个以上菌落,接种于克氏双糖和肠道发酵管(Ⅱ)和CAS平板,35 ℃孵育18~24 h后观察其生化反应和CAS平板上颜色变化;对疑为沙门菌的进行沙门菌血清凝集试验,若A-F多价血清呈阳性,根据O抗原、H抗原凝集结果确定沙门菌名称。志贺菌:挑取XLD平板上无色透明的2个以上菌落,接种于克氏双糖和肠道发酵管(Ⅱ)和CAS平板,35℃孵育18~24 h后观察其生化反应和CAS平板上颜色变化;对疑为志贺菌的,进行志贺血清凝集试验,若4种多价血清呈阳性,根据单价血清凝集结果确定志贺菌名称。
1.2.2沙门菌的血清学检测 首先用可疑菌与沙门菌O多价血清Vi抗原(A-F)进行凝集,若呈明显凝集,提示被检菌株可能属于A-F 6个O群范围之内,可根据本省O因子检出频率的顺序,按O4、O9、O7、O8、O10、O19、O2、O11的顺序进行凝集。再用H因子血清第一相(特定相)定型,最后用H因子第二相(非特异型)辅助定型。若生化反应符合沙门菌的表型,但A-F多价血清不凝集(有可能是伤寒和丙型副伤寒),首先考虑是否存在表面抗原(Vi抗原),因为Vi抗原能阻断O抗原与相应的抗体发生凝集,加热可将其破坏。此时应将细菌制成菌悬液,放入沸水中加热15~30 min,冷却后再做凝集试验。若去除Vi抗原后仍不凝集,此时应考虑Vi抗原是否为A-F以外菌群,应送专业实验室进行鉴定。
1.2.3肠道沙门菌、志贺菌PCR-荧光探针法检测 (1)试剂准备:从(-20±5)℃取出试剂盒,试剂盒中主要包括沙门志贺PCR反应液、沙门志贺酶混合液、沙门志贺内标物、沙门志贺阴性对照(0.9%氯化钠溶液)和阳性对照(含灭活的沙门菌和志贺菌)。将各试剂于室温下溶解,充分混匀并短暂离心后使用。取N个(N=阴性对照数+阳性对照数+待检测样本数)PCR反应管,每管按照要求依次加入沙门志贺PCR反应液19 μL和沙门志贺酶混合液1 μL,总体积20 μL,用于1份标本的检测。(2)标本处理:挑取米粒大小粪便,放置于含有1 mL生理盐水的离心管中,用强力振荡器高速振荡2 min,取200 μL转移至一新的离心管中,12 000 r/min离心2 min后弃上清液,同时取200 μL阴性对照和阳性对照,12 000 r/min离心 2 min后弃上清液;往各标本以及阴性对照、阳性对照的沉淀中加入200 μL核酸提取液(使用前充分振荡混匀)、10 μL沙门志贺内标物以及1管提取固形物,用强力振荡器高速涡旋振荡5 min;瞬时离心,100 ℃干浴5 min,然后12 000 r/min离心2 min,取5 μL上清液用于PCR扩增。(3)加样:在准备好试剂的PCR反应管中分别加入待测标本、阴性对照和阳性对照上清液各 5μL,盖紧管盖后,瞬时低速离心。(4)PCR扩增:根据标本类型设置标本编号、阴性对照和阳性对照,每个标本选择沙门菌检测通道(FAM),志贺菌检测通道(ROX)和内参检测通道(JOE)3个通道。反应条件设定:UDG酶处理37 ℃ 5 min;预变性95 ℃ 5 min;95 ℃ 10 s,60 ℃ 45 s,共40个循环。进行扩增检测,待检测结束后,记录结果。

1.2.5交叉反应 取一定浓度轮状病毒或诺如病毒病原体加入标本保存液中,与常规标本一样处理,重复3次。
1.2.6抗干扰能力 本试验根据临床需求,评估标本运送培养基对检测结果的影响。试验组为弱阳性标本;对照组加入等量的运送培养基,与常规标本一样处理;重复测定3次。
1.3统计学处理 采用SPSS20.0软件进行统计分析,得出受试者工作特征曲线(ROC曲线)的曲线下面积(AUC),计算诊断灵敏度、特异度、约登指数、Kappa值。
2 结 果
2.1入组患者基本信息 共随机入组196例患者,留取其粪便标本共196例,其中女86例、男110例,年龄0~16岁,中位年龄为2岁。196例粪便标本中沙门菌或志贺菌培养阳性75例(本院志贺菌阳性极少,试验期间未收集到志贺菌阳性标本,因此此试验中阳性标本均为沙门菌阳性),沙门菌和志贺菌培养阴性121例。
2.2沙门菌血清型分布 75株沙门菌中鉴定到种占86.70%,共监测到9种血清型,其中鼠伤寒沙门菌、肠炎沙门菌占72.00%,见表1。

表1 75株沙门菌血清型分布
2.3PCR-荧光探针法检测结果及效果评价 粪便培养法阳性率为38.26%(75/196),核酸检测试剂盒阳性率为37.24%(73/196),两种方法符合率为92.86%(182/196)。沙门菌核酸检测试剂盒诊断灵敏度为89.33%,诊断特异度为95.04%,约登指数为84.37%,Kappa值为0.85,ROC曲线下面积为0.93,与培养结果有极好的一致性。见表2。
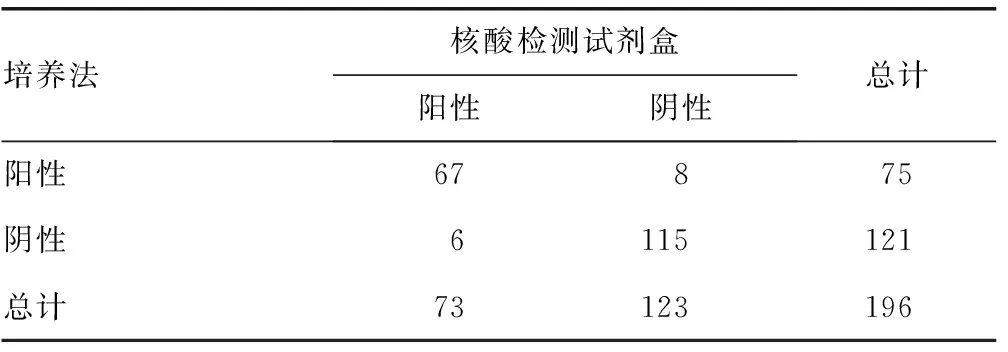
表2 试剂盒检测沙门菌与培养法的比较(n)
2.4精密度分析结果 试验结果显示CV值为10.11%,精密度良好。
2.5交叉反应结果评价 加入轮状病毒或诺如病毒病原体的样本检测结果为阴性,此试剂盒与轮状病毒和诺如病毒无交叉反应。
2.6抗干扰能力结果评价 弱阳性样本检测仍为弱阳性结果,对照组结果为阴性,此结果显示此试剂盒抗干扰能力强,其检测结果不受运送培养基的影响。
3 讨 论
沙门菌属分肠道沙门菌和邦戈沙门菌两种,肠道沙门菌有鞭毛,不产生芽孢,无荚膜,为兼性厌氧的革兰阴性肠道杆菌[7]。沙门菌也是引起我国食源性疾病和食物中毒的主要病原菌之一[8],每年我国大约有3亿人因感染沙门菌而患病,其引起的疾病达到我国食源性疾病总数的70%~80%[9]。儿童细菌性腹泻是比较常见的一种消化道综合征,其发病原因与多种因素有关,其中最主要的是病原菌感染,主要临床症状为大便性状变化、大便次数增多等,腹泻严重时可能导致患儿营养不良,从而影响到患儿的生长发育甚至可引起死亡。在我国,多项研究表明引发儿童细菌性腹泻的最主要病原菌就是沙门菌属[10-12]。为此,建立快速、有效的检测方法对预防和控制沙门菌感染非常重要。
目前沙门菌的检测方法包括传统检测方法、免疫学检测方法、分子生物学方法等[13]。传统检测法通过对标本分步增菌以达到提高病原菌检出率的目的,主要步骤有标本增菌、分离培养、生化及血清学分型鉴定。此方法准确且可靠性高,但它操作复杂、检测周期长,鉴定至少需要4 d[14],所需试剂繁多,在敏感性、特异性和检测速度等方面有自身的局限性。免疫学检测方法一般是应用抗体或抗原与相应的抗原和抗体特异性结合的原理检测待测标本是否含有待测物质[15]。已经建立的沙门菌免疫学检测方法包括:酶联免疫吸附测定(ELISA)法、免疫荧光法、免疫层析技术等。这些检测方法具有操作简便、特异性高、检测成本低、分析容量大等优点,缺点是灵敏度低、不易定量,并且会出现假阳性、假阴性等问题。沙门菌分子生物学检测方法有PCR、环介导等温扩增技术(LAMP)、核酸探针技术(NAP)、基因芯片技术等。这四种方法具有简便快速、灵敏度高、特异性强等优点,现已广泛应用于微生物检测等诸多领域。但是,由于这些方法技术含量高,对仪器和操作人员的要求较高,因此很难在基层广泛推广。
本试验使用的沙门菌核酸检测试剂盒与“金标准”培养法比较,无须标本增菌、分离培养、生化及血清学鉴定等步骤,只需挑取标本,用配套核酸提取试剂提取核酸,进行PCR扩增即可,1.5~2.0 h即可判断是否有沙门菌感染。本试验结果显示,与“金标准”培养法相比,沙门菌核酸检测试剂盒诊断灵敏度为89.33%,诊断特异度为95.04%,精密度良好,约登指数为84.00%,Kappa值为0.85,ROC曲线下面积为0.93,与培养结果有极好的一致性。与轮状病毒、诺如病毒不会发生交叉反应,Cary-Blair氏运送培养基也不会干扰本试剂盒的检测。
但此试剂盒也存在着一定的局限性:不能对沙门菌进行血清分型鉴定;标本采集、转运或保存不当可能会导致假阴性结果;沙门菌、志贺菌待测靶序列的变异可能会导致假阴性结果;未经验证的其他干扰或PCR抑制因子可能会导致假阴性结果。实验室环境污染、试剂污染、标本交叉污染可能会出现假阳性结果。
综上所述,本研究中使用的沙门菌和志贺菌核酸检测试剂盒(PCR-荧光探针法)能准确检测沙门菌感染,可作为诊断沙门菌感染以及流行病调查的一种方法。

