巴尔通体MALDI-TOF MS数据库的建立与鉴定方法的评价
栗冬梅,徐爱玲,杜小莉,宋秀平,崔志刚,刘起勇
中国疾病预防控制中心传染病预防控制所/传染病预防控制国家重点实验室/感染性疾病诊治协同创新中心,北京 102206
巴尔通体是一群寄生于哺乳动物体内的营养要求苛刻、革兰染色阴性需氧杆菌,其宿主范围广泛、全球分布,部分种类对人和动物具有致病性,分类学上属于α-变形菌纲、根瘤菌目、巴尔通体科。目前有37种(包括亚种)巴尔通体被正式命名,与其近源的致病菌有引起人布鲁氏菌病的布鲁氏菌和植物致病菌根癌土壤杆菌。巴尔通体侵袭哺乳动物,在其体内复制繁殖,可持续感染红细胞形成菌血症,通过动物间打斗、抓咬行为或者吸血节肢动物在宿主与宿主、宿主与人之间传播[1],引起猫抓病、战壕热、心内膜炎和卡瑞恩病等多系统疾病,临床表现复杂多样。巴尔通体是苛养菌,生长缓慢,生化反应不活泼、没有特征性的菌落形态和染色鉴定方法,只能依靠DNA序列进行分类鉴定,增加了实验室操作难度,使得诊断更为困难[2-3]。
质谱技术是20世纪发展起来的生物大分子分析技术,主要用于蛋白质、肽分子鉴定。近年,基质辅助激光解吸电离飞行时间质谱技术(MALDI-TOF MS)已广泛应用于革兰阴性/阳性菌、需氧/厌氧菌以及分枝杆菌、酵母菌和真菌的鉴定,成为微生物鉴定最成功的生物技术之一[4-5]。不同种属微生物各自具有特定的蛋白质组成,经MALDI-TOF MS检测可以获得不同强度的质荷比(m/z),形成肽/蛋白指纹质谱图,与标准库中的图谱进行比对可以实现细菌的种属鉴定。该技术操作简单方便,鉴定准确快速,高通量和低成本也是其主要优势,除了可鉴定常见细菌和真菌,还极大地提高了临床微生物实验室对苛养菌及分枝杆菌等难鉴定的病原微生物的识别效率和能力[6],目前已快速成为临床微生物实验室常规配备的检测技术[7-8]。
MALDI-TOF MS技术用于巴尔通体鉴定,无疑是其鉴定方法的重要补充和发展。到目前为止,国际上仅FOURNIER等[9]报道了应用17种、17株巴尔通体参考菌株和39株盲测菌株进行了有关巴尔通体质谱鉴定方法的研究。国内尚无对于巴尔通体质谱鉴定方法的研究,且进口和国产的微生物MALDI-TOF MS仪的数据库中均无巴尔通体的参考质谱图,在疾病预防控制系统和临床实验室均无法应用该技术进行巴尔通体鉴定,限制了该技术在巴尔通体相关疾病诊断和控制中的应用和发展。在本研究中,课题组应用21种、200株巴尔通体菌株,涵盖了全部重要致病种,建成巴尔通体质谱鉴定基础数据库,并应用173株多宿主多地区来源的野生菌株对样品处理方法和该数据库进行测试,证实MALDI-TOF MS用于巴尔通体菌株鉴定准确、快速,适用于今后临床微生物实验室相关病原菌的检测鉴定。
1 材料与方法
1.1实验菌株 选取21种/亚种巴尔通体,包括汉赛巴尔通体、杆菌样巴尔通体、五日热巴尔通体、伊丽莎白巴尔通体、文森巴尔通体伯格霍夫亚种、格拉汉姆巴尔通体、科勒巴尔通体、克氏巴尔通体、道志巴尔通体、文森巴尔通体文森亚种、文森巴尔通体阿鲁潘亚种、特利波契巴尔通体、日本巴尔通体、黑瞎子巴尔通体、昆州巴尔通体、森林巴尔通体、库珀巴尔通体、非洲跳鼠巴尔通体、丽松鼠巴尔通体、泰勒巴尔通体和地松鼠巴尔通体,200株巴尔通体菌株用于建立MALDI-TOF MS标准数据库(表1)。应用173株巴尔通体野生分离菌株用于验证评价所建质谱数据库和鉴定方法的可信度(表1)。这些菌株包含12株巴尔通体ATCC标准菌,其他为北京、山东、河南、青海、西藏和新疆等地的野生菌株,分别分离自猫、犬、猕猴和多种啮齿动物。其他菌株包括牛种布鲁氏菌人用疫苗株104M、犬种布鲁氏菌RM6/66、根癌土壤杆菌ATCC33970、金黄色葡萄球菌ATCC29213和大肠埃希菌ATCC25922。本研究全部菌株由中国疾病预防控制中心传染病预防控制所提供。
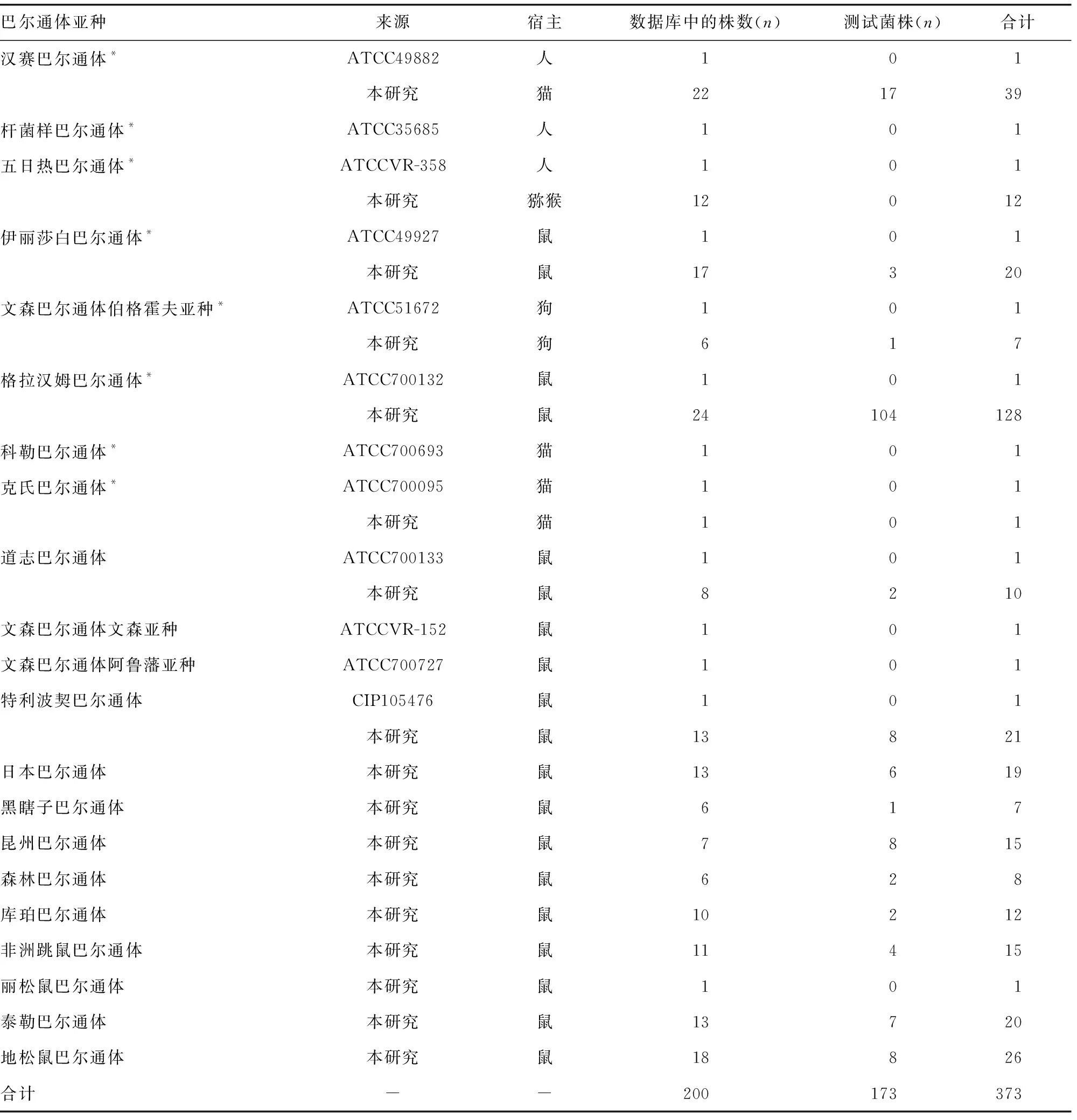
表1 用于建立和评价巴尔通体菌MALDI-TOF MS数据库的菌株信息
1.2仪器与试剂 Autof ms1000全自动微生物质谱检测系统(郑州安图实验仪器有限公司)、371型CO2培养箱(Thermo公司)、NU-425-600E生物安全柜(Nuaire公司)、LabCycler PCR仪(SensoQuest公司)、台式离心机(Sigma公司1-14型)、胰酶大豆琼脂(BD公司)、三氟乙酸(质谱级,Fluka公司)、α-氰基-4-羟基肉桂酸(CHCA,质谱级,Sigma公司),质谱样本预处理试剂盒(包括裂解液1、裂解液2、缓冲液和基质)、微生物质谱鉴定仪用校准品和样品靶板(郑州安图实验仪器有限公司),其中裂解液1、裂解液2和缓冲液分别为含甲酸、乙腈和三氟乙酸的溶液;基质溶液为α-氨基-4羟基肉桂酸(CHCA)的饱和溶液,在基质中加入裂解液2和缓冲液各60 μL充分混匀而成。
1.3方法
1.3.1巴尔通体菌株培养和鉴定 巴尔通体菌株在含有5%脱纤维羊血TSA上复苏培养,置于37 ℃、5% CO2培养箱,潮湿环境中培养。杆菌样巴尔通体在28 ℃条件下,用10%脱纤维羊血TSA培养。按菌落生长速度收获培养第4~7天新鲜菌体。应用引物BhCS.781p-BhCS.1137n扩增巴尔通体属的特异性基因枸橼酸合酶基因(gltA)进行分类鉴定[10]。
1.3.2样品预处理及靶板制备 在1.5 mL离心管中加入300 μL去离子水,取适量(5~10 mg)巴尔通体菌株新鲜培养物,漩涡震荡,再加入900 μL无水乙醇充分混匀,检测前置于-40 ℃保存。将上述含样品的保存液10 000 r/min离心2 min,重复离心弃上清液,室温干燥沉淀2~3 min,加50 μL裂解液1漩涡震荡混匀,再加50 μL裂解液2混匀,10 000 r/min离心2 min,取1 μL上清液,滴加到样品靶上,晾干至样品点无明显水迹,再取1 μL基质溶液(CHCA饱和溶液)覆盖在样品点上,晾干至样品点无明显水迹。
将同一菌株的样品蛋白溶液滴加到8个不同靶位,同时选择1个靶位滴加仪器校准品(图1),干燥后加基质溶液,结晶形成后放入质谱仪,每株菌建库前先进行校准,再进行样品质谱图采集。校准峰值为3 637.772、4 365.343、5 096.776、5 381.446、6 255.444、7 274.467、10 300.032、13 683.173和16 952.332,按照仪器校准要求进行自动校准,达到4个峰值符合即为校准成功。

图1 巴尔通体MALDI-TOF MS数据库建库靶板制备示意图
1.3.3MALDI-TOF MS参数设置及数据采集 在Autof Acquirer软件中选择Microbe方法,线性正离子模式,加速电压20 kV,激光源波长355 nm,延迟提取时间250 ns,相对激光强度为44%,频率为60 Hz,累加数40,分子质量检测范围2 000~20 000,容差300 ppm;每个靶位采集3张谱图,每张谱图由3次累加组成,峰强度4 000~10 000,最终每个菌株获得24张图谱。在Autof Analyzer软件中设置建库参数,谱图匹配容差200 ppm,最大峰数目70个。
1.3.4重复性验证 选择8种不同宿主、地域来源的巴尔通体,每种包含建库菌株和测试菌株各1株进行MALDI-TOF MS鉴定的重复性实验。每株菌每次采集6个重复靶点质谱得分,共计重复6次实验。
1.3.5野生菌株实测 应用173株经测序鉴定为巴尔通体的菌株(表1)对所建立巴尔通体质谱数据库进行验证。每株用于验证的菌株均采用直接涂抹法(简称“直涂法”)[6]和上述提取法准备样品靶板,自动采集谱图。直接涂抹法即用接种针挑取新鲜的单菌落1~2个,在靶板上涂抹均匀,干燥后覆盖1 μL的基质溶液,晾干至样品点无明显水迹,将样品靶放入质谱仪进行鉴定。依据系统自动搜库结果进行判定,鉴定总分为10分,9.500~10.000分为精确鉴定,9.000~<9.500分为可靠鉴定,6.000~<9.000分为可参考鉴定,<6.000分为无效(不可靠)鉴定。用建库相同的参数条件对细菌进行检测,数据分析系统将会用分值的形式给出被测细菌与质谱库中细菌的匹配情况。
1.3.6巴尔通体MALDI-TOF MS鉴定的特异性验证 选用牛种布鲁氏菌人用疫苗株104M、犬种布鲁氏杆菌RM6/66、根癌土壤杆菌、金黄色葡萄球菌和大肠埃希菌各1株,对新建巴尔通体数据库进行特异性验证。每株菌每次鉴定时涂布6个重复靶点,采集6个重复靶点鉴定结果,观察质谱得分及匹配情况。
1.4统计学处理 两种样品处理方法的质谱得分比较采用两样本Wilcoxon(Mann-Whitney)秩和检验,P<0.05为差异有统计学意义。
2 结 果
2.1巴尔通体MALDI-TOF MS数据库建立 应用标准建库方法采集了200株巴尔通体的蛋白指纹图谱,包含汉赛、五日热、杆菌样和伊丽莎白巴尔通体等主要致病性巴尔通体,建立了拥有21种(包括3个亚种)巴尔通体MALDI-TOF MS数据库。
这200株来自不同地区的巴尔通体菌株在种水平的主要离子峰一致,每株菌24次采集峰谱数据稳定,最终形成每个种的巴尔通体标准蛋白指纹图谱,图2以汉赛巴尔通体标准菌株为例展示单次质谱图和24次叠加图。建库后,每株菌按照样品模式进行谱图采集打靶验证,总得分为(9.631±0.156)分,得分范围为9.019~9.863分(表2),全部大于9.000分,属于“可靠”或“精确鉴定”。
2.2不同样品处理方法对巴尔通体MALDI-TOF MS鉴定结果的影响 应用2种不同方法处理60株(13种)巴尔通体菌株,质谱鉴定得分均大于9.000分,符合“可靠”或“精确鉴定”。乙醇-甲酸提取法处理细菌培养物再涂板,全部菌株得分为9.067~9.775分,直接涂靶得分为9.016~9.689分,准确率均为100%。两种处理方法的质谱得分比较,差异有统计学意义(P<0.05),见表3。有44株乙醇-甲酸提取法处理后的菌株质谱得分高于直接涂靶法得分(图3)。

注:纵坐标为样品编号;横坐标为差值(分)。

表3 不同样品处理方法的巴尔通体MALDI-TOF MS鉴定结果(分)
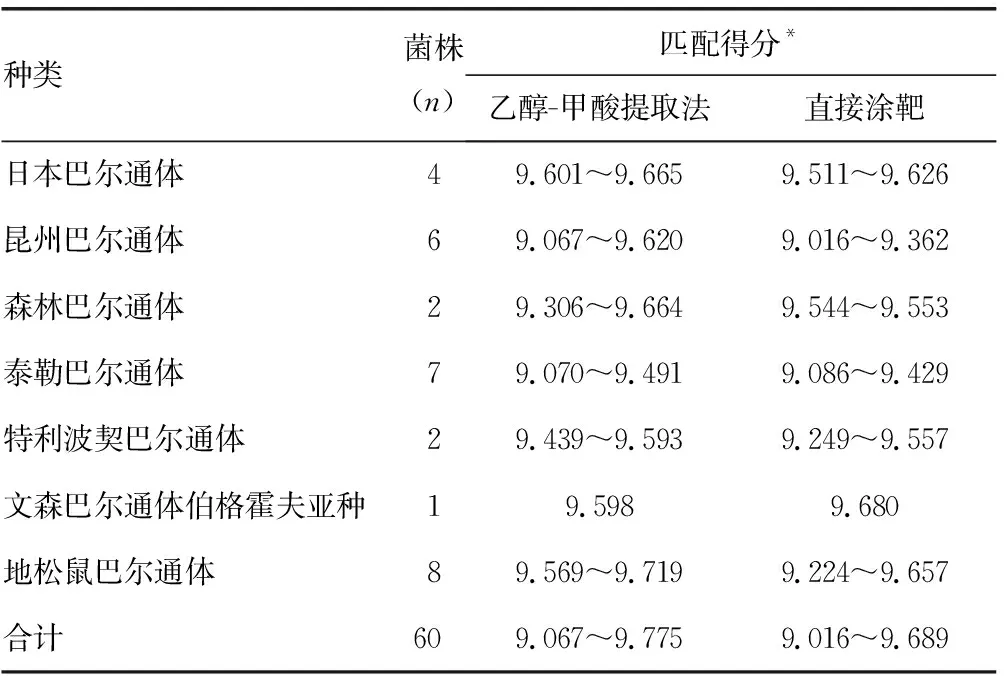
续表3 不同样品处理方法的巴尔通体MALDI-TOF MS鉴定结果
2.3重复性实验 8种、16株巴尔通体菌株在各自的组内及组间重复实验中质谱得分均>9.000分,均值为(9.078±0.031)~(9.776±0.006)分,均鉴定正确;组间CV值在0.06%~1.12%,实验结果重复性好,质谱得分稳定(表4)。

表4 MALDI-TOF MS鉴定巴尔通体菌株的重复性
2.4巴尔通体MALDI-TOF MS数据库验证 将14种、173株巴尔通体菌株培养后用乙醇-甲酸提取法处理,基于新建的巴尔通体数据库进行质谱鉴定。这173株菌已通过gltA基因扩增、测序鉴定到种水平。173株测试菌株全部鉴定到巴尔通体种水平,总得分为9.014~9.796分,平均(9.462±0.195)分,全部菌株得分均>9.000分(图4),准确率为100%。以菌株M59SHD为例,质谱鉴定结果前10位均为数据库中的汉赛巴尔通体菌株,得分为9.505~9.642分,匹配最高分为ATCC标准菌株(图5)。
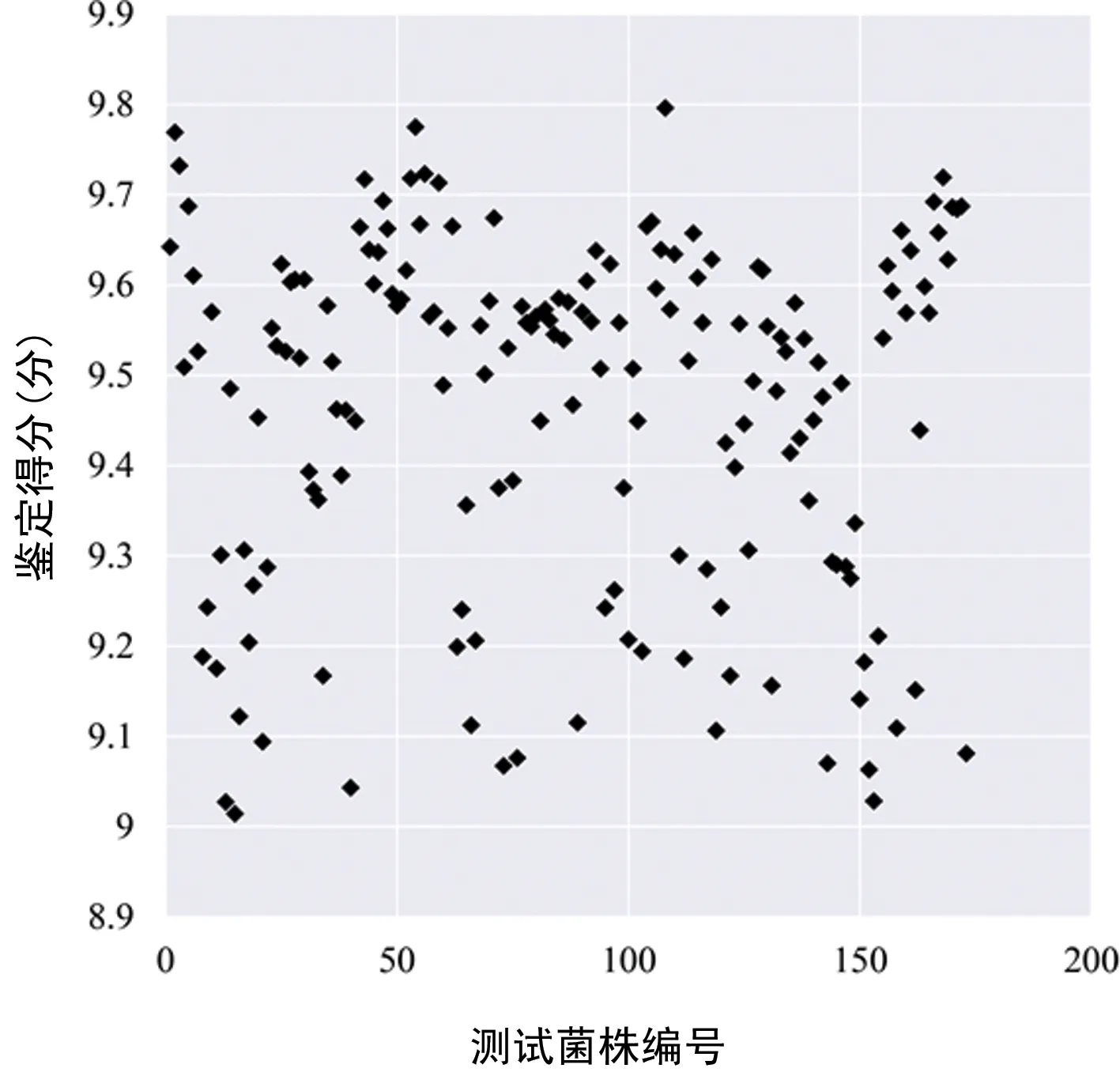
图4 173株巴尔通体测试菌株质谱得分图

注:水平轴上下分别为测试菌株M59SHD和新建数据库中汉赛巴尔通体的ATCC标准菌株。
2.5巴尔通体MALDI-TOF MS鉴定的特异性验证 牛种布鲁氏菌人用疫苗株104M的质谱得分为6.136~7.809分,平均(6.705±0.662)分,匹配第1位菌株为犬种布鲁氏菌;犬种布鲁氏菌RM6/66的质谱得分为6.162~7.633分,平均(7.104±0.592)分,匹配第1位菌株为犬种布鲁氏菌;根癌土壤杆菌质谱得分结果为6.123~8.215分,平均(6.751±0.764)分,匹配第1位菌株为放射根瘤菌;金黄色葡萄球菌质谱得分为9.018~9.372分,平均(9.103±0.135)分,大肠埃希菌的质谱得分为9.214~9.598分,平均(9.453±0.135)分。在这5种细菌每个重复靶点的匹配结果中,前10位均未出现巴尔通体属细菌。
3 讨 论
MALDI-TOF MS无疑是近年在临床实验室应用于诊断感染性疾病最成功的生物化学技术之一。MALDI-TOF MS主要用来鉴定已培养出的细菌和真菌,某些生物样品如尿液等不经培养简单预处理后也可直接进行质谱检测。从1975年ANHALT等[11]首次提出用质谱技术鉴定细菌,到1999年HOLLAND等[12]首次报道应用无须预处理的全菌蛋白进行质谱分析,实现了复杂技术简单化、快速化和结果读取“傻瓜化”的转变,奠定了该技术快速普及的基础。此后,大量相关研究陆续开展,并于21世纪开始将此项技术应用于临床实验室。FREIWALD等[13]的“细菌质谱系统发育分类和鉴定”的实验手册提供了详尽的操作流程和说明,CLARK等[14]详细综述了MALDI-TOF MS用于各种革兰阳性和阴性细菌、厌氧菌、苛养菌和各种真菌鉴定的研究,他们都指出这一技术将替代部分传统方法,皆归因于其特异、快速、稳定和低成本的优点。
操作简便、快速和准确使得MALDI-TOF MS技术在临床应用上很受欢迎,只需把菌培养出来,菌量无须过多、单个菌落即可,直接涂抹在靶面上,装载到仪器中,简单按几次鼠标,1 min内结果就展示出来。对于巴尔通体这种苛养菌,没有表型特征、没有生化代谢特异反应,目前只能通过PCR测序进行鉴定,建立质谱鉴定方法将极大推动临床实验室对这类细菌的识别能力。
MALDI-TOF MS识别细菌体内稳定且丰富的核糖体蛋白,相对分子质量在2 000~20 000[15-16],因此,相较于其他化学分类法如细胞壁脂肪酸法,不易受培养条件的影响,全菌蛋白质谱峰信号稳定,有利于鉴定和比较。依据常规方法,本课题组选取了统一培养条件下平板上稳定生长期的菌落,通常为培养4~6 d,但有些种类如杆菌样巴尔通体生长更为缓慢,这也使得一切基于菌落培养的鉴定方法检测速度降低,成为MALDI-TOF MS鉴定巴尔通体的限速步骤,也是该方法的局限性所在。不过一旦平板上开始出现菌落就可以快速完成鉴定。
对于一般生长在固体琼脂平板上的细菌,直接涂靶是常规做法,有效地节省了中间步骤、试剂和操作过程中增加污染的可能性,是最简单、快速有效的方法,在临床实验室中广泛应用。但是,在某些细菌或特殊菌株的鉴定时,乙醇-甲酸或者乙酸-乙腈等提取法可以增加细菌蛋白的裂解质量,提高鉴定准确率[5]。巴尔通体菌落小但是形态多样,有些干燥,有些向琼脂平板下陷生长,还有些黏滑不易挑取,一次直涂操作不易成功,这种情况下采用提取法是较好的解决办法。
准确的诊断要求鉴定方法的稳定性,除了稳定的设备、优化的实验条件和良好的操作技术,MALDI-TOF MS技术对参考菌株库的需求是这一技术的特点之一[17]。在MALDI-TOF MS微生物数据库中不同来源的流行菌株越多,在临床诊断中对未知菌株的命中率越高,否则可能因匹配得分低导致鉴定失败。本课题组建立的巴尔通体MALDI-TOF MS数据库菌种和菌株数量多、来源广泛,不同来源地和不同宿主来源没有影响巴尔通体在种属水平上的准确鉴定。应用8种、16株巴尔通体进行的重复性实验获得良好测试效果,符合率达到100%,表明MALDI-TOF MS技术可以稳定、准确地在种水平鉴定巴尔通体。野生菌株的鉴定结果是评价数据库质量最有说服力的数据,与FOURNIER等[9]的研究相比,本研究的建库菌株不仅更多(21种/亚种vs. 17种,200株vs. 17株),而且用于测试的野生菌株数量增加了4倍(173株vs. 39株),可以更有效地验证和评估所建巴尔通体质谱数据库和技术方法的可靠性。经重复性实验测试,质谱得分均>9.000分,CV值显示组内和组间测量值变异非常小,实验组内和组间上样进行谱图采集均不会影响鉴定结果,方法稳定。Autof ms1000全自动微生物质谱检测系统中已有细菌4 000余种,没有巴尔通体属细菌。在建库前,为观察是否存在非特异性鉴定结果的情况,本课题组进行了巴尔通体菌株打靶搜库,未发现非特异鉴定的高分结果,表明原始库中4 000余种细菌对巴尔通体鉴定无干扰,不存在非特异性鉴定可能。进一步对近源菌包括布鲁氏菌和根癌土壤杆菌的鉴定结果表明,用MALDI-TOF MS方法鉴定巴尔通体不会发生非特异性的识别错误,基于新建巴尔通体数据库可以特异性地辨别巴尔通体属细菌。限于巴尔通体菌种、菌株资源有限,本研究未能将目前已知的全部巴尔通体种类涵盖进去,而且有些种类菌株数量较少,该数据库并不完善,在未来使用过程中可能导致某些巴尔通体种类鉴定不到种水平,或者种水平鉴定错误。这种情况实际上是质谱技术用于细菌鉴定时的共同问题,这一局限性有待通过不断向数据库中补充菌种和菌株数据来解决。
本课题组完成了21种/亚种巴尔通体标准质谱图,构建了巴尔通体标准质谱数据库,可用于巴尔通体菌株的种属水平鉴定。最后,为便于有关专业实验室研究人员和临床检验医师参考和交流,笔者提出“巴尔通体质谱鉴定标准化操作流程”的建议,包括菌株分离培养、样品处理和自动化质谱分析(图6)。简述如下,第1步:在37 ℃、5%CO2、湿度>70%培养条件下,复苏培养巴尔通体菌株,4~6 d;第2步:直涂法或者乙醇-甲酸提取法制备质谱样品,1~10 min;第3步:靶板上样并装载到质谱仪,3 min;第4步:设置参数、编辑样品表单、采集图谱鉴定并输出结果,<1 min。

图6 巴尔通体质谱鉴定标准化操作流程示意图

