阿托伐他汀对LI-PILO癫痫大鼠模型的影响*
冯俊祥,李 杰,2
(1.新乡医学院,河南 新乡 453000;2.新乡医学院第一附属医院,河南 卫辉 453100)
阿托伐他汀(Atorvastatin, ATV)是一种常用的他汀类药物,能降低脂蛋白和胆固醇.越来越多的证据表明,他汀类药物在缺血等神经系统疾病治疗中有显著的保护作用[1-2].他汀类药物除了具有抗炎作用以外,目前一些临床数据也支持其具有潜在的抗癫痫作用[3-4].
炎症过程中炎症因子表达增加在癫痫发展中起着重要作用[5-6].IL-1β,IL-6,TNF-α等细胞因子被认为是癫痫发作后病理过程中的关键成分[7].由癫痫发作所引起的脑内炎症反应是导致脑组织病理改变,特别是海马区损伤的主要原因之一.目前关于他汀类药物治疗能降低癫痫炎性因子表达水平以及对神经细胞具有保护作用已有相关报道,但对于作用机制研究较少.
基于此,本研究以LI-PILO诱导的SD大鼠为癫痫动物模型,通过探讨ATV对SD大鼠的行为学、炎性因子水平以及神经细胞的影响,进一步对相关的作用机制作出分析,以期为筛选减轻癫痫发作症状和减少癫痫发作次数用药提供理论参考.
1 材料与方法
造模前1周,ATV组分别给予不同剂量阿托伐他汀钙连续1周灌胃处理,对照组给予等量生理盐水;随后均给予LI-PILO诱导癫痫发作,同时用闭路视频监测并记录SD大鼠在急性期癫痫发作的不同时间点、癫痫发作级别及IV或V级SE发作的潜伏时间;继续在静止期记录癫痫终止到第1次出现自发性癫痫发作的潜伏期;在慢性期,第7周给予连续1周的视频监测癫痫发作,第8周进行炎性因子检测,同时行大脑海马区尼氏染色,观察神经元受损情况.
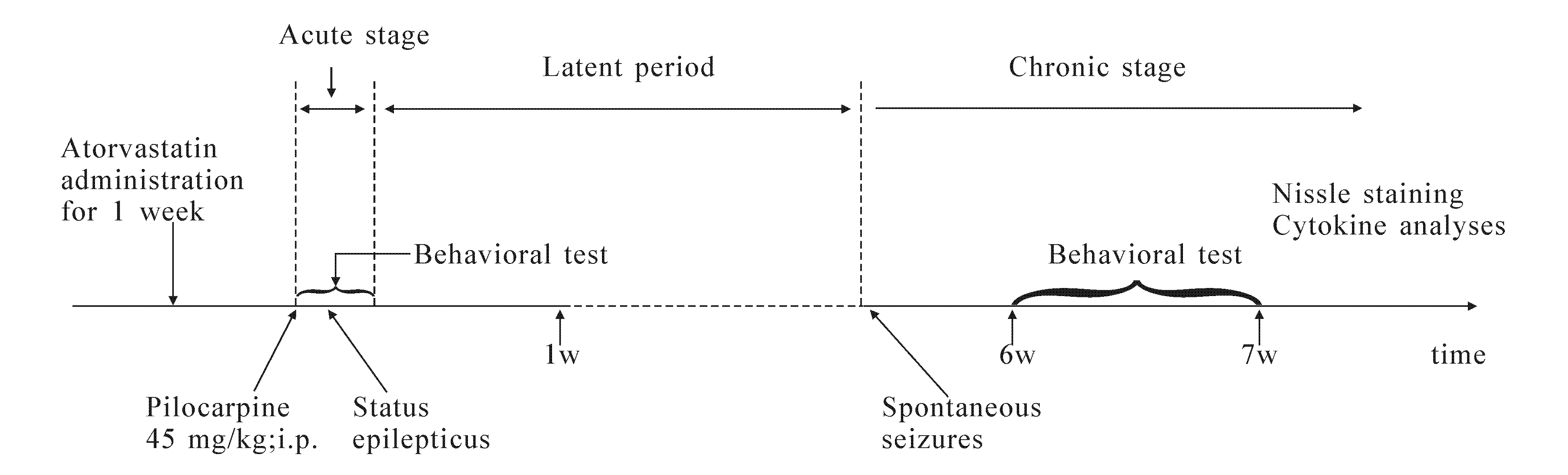
图1 实验方案示意
1.1建立动物模型
1.1.1 实验动物及分组 选取由北京维通利华实验动物技术有限公司提供的健康成年雄性SD大鼠,体重180~200 g.实验前饲养1周,随机分为3组,每组各10只.10 mg ATV和50 mg ATV处理组(n=10):分别给予 10 mg/kg ATV和50 mg/kg ATV灌胃.每天1次,连续1周.生理盐水对照组(n=10):给予同ATV处理组等量(2 mL)生理盐水灌胃.每天1次,连续1周.
1.1.2 建立SE动物模型 按大鼠体重,分别给予腹腔注射127 mg/kg氯化锂(美国Amresco公司).18 h后再给予腹腔注射45 mg/kg匹罗卡品(美国MCE公司).腹腔注射匹罗卡品前半小时,预先给SD大鼠腹腔注射1 mg/kg的硫酸阿托品以减轻匹罗卡品可能引起的外周症状.可根据Racine分级标准[8]来对大鼠进行癫痫发作程度的评估.具体标准如下:
0级:正常进食或活动状态,无惊厥发生;
I级:静止或伴咀嚼,触须微动或头部微颤;
II级:节律性点头或抖动;
III级:单侧前肢阵挛;
IV级:伴站立的全身强直阵挛;
V级:除IV级表现外,伴有失衡或者摔倒.
给予SD大鼠匹罗卡品应用后,观察并记录大鼠的行为及癫痫发作出现的时间.持续全身阵挛或每隔数分钟接连出现全身阵挛发作称为SE.当SD大鼠癫痫发作达到IV级或V级,即造模成功.在SE后1 h给予地西泮(10 mg/kg)腹腔注射终止发作.成功造模生理盐水对照组(n=6),成功造模10 mg ATV组(n=6)和成功造模50 mg ATV组(n=6).
1.2 动物行为学研究
为了观察ATV对SD大鼠在急性期癫痫发作程度的影响,腹腔注射匹罗卡品后(10,20,30,40,50 min),用24 h视频监控系统观察并记录大鼠癫痫发作水平以及首次IV或V级SE发作的潜伏时间.癫痫程度评分与Racine标准相同;同时用视频监控系统观察并记录从SE发作终止到大鼠第一次出现自发性癫痫发作的潜伏期;在慢性期(腹腔注射匹罗卡品诱发SE后第6周至第7周),用24 h视频监控系统连续观察1周,记录每只大鼠IV级或V级自发性发作次数.自发性发作时的评分标准与急性期发作标准相同.
1.3 炎性因子的检测
1.3.1 大鼠动脉血浆制备 按1.2 g/kg剂量给予SD大鼠腹腔注射20%乌拉坦溶液进行麻醉.仰卧位固定SD大鼠,用右手食指确定SD大鼠股动脉的位置和走行,沿股动脉方向于SD大鼠皮肤上行纵向切口.右手持注射器沿股动脉走行方向,往近心端穿刺取大鼠股动脉血.3 000 r/min离心10 min后,提取上清液并避光置于-70 ℃冰箱中储藏备用.
1.3.2 ELISA法检测血清IL-1β,IL-6,TNF-α水平 取出所需板条放置在框架内,设置标准孔、样品孔、本底校正孔.在酶标包被板上准确加样标准品50 μL,待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL.洗板5次,加入生物素化抗体工作液(100 μL/孔).用封板胶纸封住反应孔,室温孵育60 min.然后再洗板(同上).每孔加入酶标试剂50 μL,用封板膜封住反应孔,避光室温孵育20 min.最后再洗板(同上),每孔先后加入显色剂A和B各50 μL,轻轻震荡混匀,37 ℃避光显色15 min.然后每孔加入终止液50 μL,以空白孔调零,450 nm波长依序测量各孔的吸光度(OD值).ELISA试剂盒由美国明尼阿波利斯研发系统公司提供.
1.4 免疫组化染色
1.4.1 脑片制备 对SD大鼠进行麻醉,方法同上.随后研究人员对SD大鼠进行暴露并游离心脏,用吸有预冷过的生理盐水的注射器从心尖部扎入左心室,同时用血管钳固定针头,然后用眼科剪剪开右心耳,灌注生理盐水,直至从右心耳流出清亮液体.然后改为灌注预冷过的4%多聚甲醛,直至SD大鼠全身僵直即说明活体灌注固定完成.断头取出大鼠脑组织,置于4%多聚甲醛固定过夜,然后分别在15%和30%的蔗糖溶液中依次进行梯度脱水,用冷冻包埋机将脑组织切割成5 mm的连续切片,然后贴附于载玻片上于37 ℃温度下过夜,再置于-80 ℃冰箱中储藏备用.
1.4.2 尼氏染色 取含有海马区的脑冠状切面组织,在其周围滴加OCT,冷冻后切片.然后分别移入含有PBS(磷酸盐缓冲盐溶液)的孔板中进行漂洗.随后放置于PBS缓冲液中,再放置防脱片.然后取出玻片,室温下干燥过夜后再用水湿化,随后置于45 ℃的Nissl染液中浸泡20 min.用水清洗5 min后再用90%的乙醇分化数秒.在此期间用显微镜观察到Nissl小体分化终止时,用95%和100%乙醇进行梯度脱水,再进行二甲苯透明处理,最后用中性树胶封固.在海马CA1,CA3,DG区分别用40倍物镜随机取5个视野计数正常结构神经元,取均数作为此切片该区域的得数.每组随机取5张切片,采用Case Viewer软件统计海马CA1,CA3,DG区0.1 mm2区域内阳性细胞数,取其平均值.Nissl染色液由Bioswamp提供.
1.5 统计分析
所有数据均用均值±标准差(Mean±SD)描述.运用SPSS 23.0来统计分析,t检验评估两组间的显著性.运用单因素方差分析(ANOVA),然后进行Bonferroni校正后检验比较各组间的差异.P<0.05被认为差异具有统计学意义.
2 结果
2.1 SD大鼠行为学分析
预先给予10,50 mg/kg ATV应用后,在不同时间点(20,30,40 min)SD大鼠急性期癫痫发作的级别均显著低于对照组(P<0.001和P<0.001),表明给予ATV预处理能显著减轻急性期癫痫发作级别(图2(a)).10,50 mg/kg ATV组的SE发作潜伏时间较对照组显著延长(P<0.05和P<0.01),其中50 mg/kg ATV组SE发作潜伏期最长,表明给予ATV预处理能明显延长急性期SE发作潜伏时间(图2(b)).
与对照组相比,10,50 mg/kg ATV组自发性癫痫发作潜伏期显著延长(P<0.05和P<0.05),其中50 mg/kg ATV组自发性癫痫发作潜伏期最长,表明给予ATV预处理能明显延长慢性期癫痫发作潜伏期(图2(c)).与对照组相比,10,50 mg/kg ATV组自发性癫痫发作(SRSs)次数均显著降低(P<0.05和P<0.001),其中50 mg/kg ATV组自发性癫痫发作次数最少,表明给予ATV预处理能明显减少慢性期自发性癫痫发作次数(图2(d)).
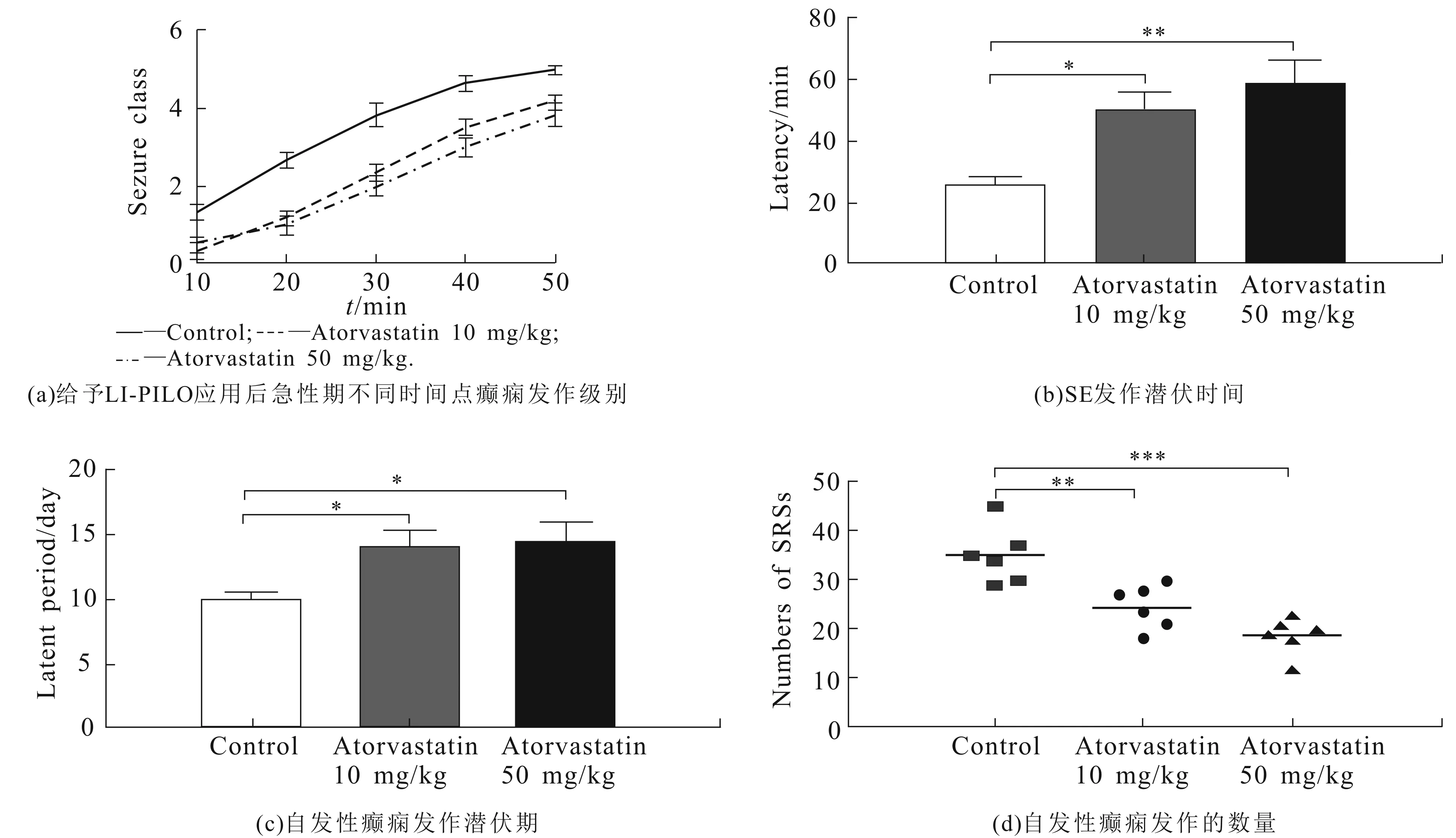
图2 大鼠癫痫行为发作分析
2.2 炎性因子表达分析
10,50 mg/kg ATV组IL-1β,IL-6,TNF-α炎性因子表达均明显低于对照组(P<0.01和P<0.001).与10 mg/kg ATV组相比,50 mg/kg ATV组IL-1β的表达显著增加(P<0.01);IL-6,TNF-α的表达增加,无统计学意义(P>0.05)(图3).以上结果提示ATV可能通过降低IL-1β,IL-6,TNF-α炎性细胞因子在海马区中的表达来延迟癫痫发作,降低癫痫发作级别.
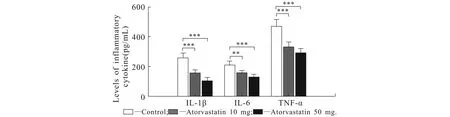
图3 SD大鼠血浆中炎性因子水平
2.3 尼氏染色分析
对海马CA1,CA3,DG区神经元进行尼氏染色及海马锥体神经元计数,尼氏染色结果显示ATV组SD大鼠的海马CA1,CA3,DG区有更多神经元存活(图4(a)),与对照组相比,10,50 mg/kg ATV组的阳性细胞总数均显著增加(P<0.01和P<0.001),同时50 mg/kg ATV组相比10 mg/kg ATV组阳性细胞总数明显增加(P<0.01)(图4(b)),以上结果提示ATV对SD大鼠癫痫模型的海马区神经元具有保护作用.
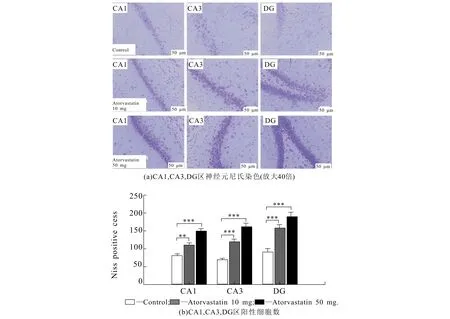
图4 大鼠海马区神经元染色及阳性细胞数
3 讨论
癫痫发作促使脑神经元损害的关键作用机制之一是癫痫后的炎性神经反应,IL,TNF-α等炎性因子在此过程中发挥着关键作用.IL-1β,IL-6,TNF-α等炎性因子通过多种机制为癫痫发作提供微环境,使癫痫发作易感性增加[9].通过对SD大鼠在急性期癫痫发作的行为学观察发现,ATV组癫痫发作的潜伏时间显著延长,同时癫痫发作级别显著降低,这与Wang等[10]的研究一致,提示ATV能缩短潜伏时间,同时能使癫痫发作级别显著降低.而在LI-PILO应用10,50 min后ATV组癫痫发作级别较对照组无统计学意义(P>0.05),可能与样本数量、动物模型和个体差异有关.Citraro等[11]研究发现,他汀类药物可使大鼠促炎症因子下降进而抑制氧化应激反应和脑部炎症,在癫痫发作时他汀类药物发挥脑保护功能,减少癫痫发作.ATV组癫痫发作潜伏期延长,慢性期自发性癫痫发作的次数明显减少,提示ATV影响癫痫发作形成与以上机制有关.
在正常机体脑细胞中,IL-1β,IL-6,TNF-α炎症因子的表达保持在很低的水平.在癫痫发作的半小时内,IL-1β,IL-6,TNF-α炎症因子的含量会迅速增加[12].他汀类药物可减少IL-1β,IL-6,TNF-α炎症因子的释放,进而达到抗炎、抗氧化的作用.同时他汀类药物可通过上调GABA活性和下调谷氨酸活性,使神经元免受兴奋性毒性的损伤.他汀类药物通过上述炎症因子及活性物质的共同作用发挥保护血脑屏障的功能[13-14].同时IL-6,TNF-α介导了IL-1β在中枢神经系统中的诸多病理过程[15].ATV通过降低癫痫SD大鼠IL-1β,IL-6,TNF-α炎症因子的表达,进而影响癫痫的发生发展过程,阻止癫痫的发生.在慢性期的尼氏染色中,ATV组的阳性细胞总数显著增加与前人研究结果类似[2,16],表明ATV对癫痫动物模型的神经元具有保护作用.ATV组中海马CA1,CA3,DG区的神经元数目均明显高于对照组,同时50 mg/kg ATV组比10 mg/kg ATV组提升效果更好.以上结果提示ATV可通过降低癫痫发生发展过程中炎症因子引起的炎症级联反应而保护神经元,且ATV剂量大小与保护效应成正相关.
综上,在SD大鼠癫痫的发生发展过程中,ATV可通过抑制海马区中IL-1β,IL-6,TNF-α炎症因子的生成,延长癫痫发作潜伏时间和降低癫痫发作频率等方式来减轻急性期及慢性期癫痫发作.虽然ATV在动物实验中已被证实能够减轻癫痫发作症状,但在临床上的疗效仍需进一步的试验证实.

