新疆维吾尔自治区阿克苏地区猪源巴氏杆菌的分离鉴定
王 岚,赵 静,孙鹏亮,塔·赛日吉玛,李莲瑞*
(1.塔里木大学动物科学学院,新疆 阿拉尔市843300;2.新疆生产建设兵团塔里木动物疫病诊断与防控工程实验室,新疆 阿拉尔843300)
猪巴氏杆菌病是指多杀性巴氏杆菌引起的急性流行性或散发性以及继发性传染病,该细菌一般侵袭猪的口腔、鼻咽和上呼吸道[1]。当病原菌大量繁殖导致内源性感染时,可引起猪发生呼吸系统疾病、局灶性感染及败血症[2]。近年来,猪群中流行的多杀性巴氏杆菌血清型为A、B和D型[3-4],主要引发猪肺疫和进行性萎缩性鼻炎等呼吸困难综合征。巴氏杆菌病原菌常与多种病原混合感染动物机体,从而导致猪群患呼吸道疾病的概率提高,对养猪产业造成极大的经济损失。通过流行病学调查发现,巴氏杆菌引起的猪呼吸系统疾病在规模化养殖场和散养户中普遍存在,冬季发病率较高,病猪生长发育受到严重影响[5]。本试验对南疆阿克苏地区病料进行细菌分离培养,通过菌落形态观察、16S rRNA基因测序对分离得到的菌株进行鉴定,进而确定引起猪出现呼吸困难症状的病原菌的种属,为该地区由巴氏杆菌引起的猪呼吸系统疾病的防治提供参考。
1 材料与方法
1.1 试验材料
病料样品采自新疆阿克苏地区阿克苏宏盛牧业猪场病死仔猪的心脏、肝、脾、淋巴等。
试验试剂:1%氢氧化钠溶液、核酸染料、DNA maker、无菌水、结晶紫溶液、碘溶液、95%乙醇溶液等。
试验仪器:GHP-9080恒温培养箱(上海一恒科学仪器有限公司)、HVE-50高压锅(平山制作所株式会社)、Eppendorf 5453小型台式高速离心机(德国艾本德)、Galanz G80F23CN3P-Q5CR0小型微波炉(美的集团)、SW-CJ-2ED洁净工作台(赛默飞世尔科技有限公司)、ECLIPSE Ci-L显微镜(尼康仪器有限公司)、Thermo sciencific KZ04273/KZ01448/JZ35758微量移液器(德国艾本德)、DK-8D水浴锅(上海博讯实业有限公司)、ZWY-2102C摇床(上海智城分析仪器制造有限公司)。
1.2 试验方法
1.2.1 细菌分离培养
将采取的病料放入500μL生理盐水中,制成组织悬液,吸取200μL滴加在LB固体培养基上,置于37℃恒温培养箱内倒置培养24~48 h。长出菌落后,在琼脂平板上进行划线分离纯化培养24~48 h,观察菌落形态。
1.2.2 染色镜检
取清洁的载玻片,将25μL无菌生理盐水滴在载玻片上,取分离纯化的单菌落均匀涂于生理盐水中使其分散,待晾干之后酒精灯外焰固定。细菌涂片革兰氏染色,结晶紫染色1 min,水洗;碘溶液处理1 min,水洗;95%乙醇脱色30 s,水洗;沙黄复染15 s,水洗。烘干,油镜下观察并记录菌体特征。
1.2.3 基因组DNA的提取
将筛选出来的菌珠接种到含150 mL液体培养基的锥形瓶中,并将其置于摇床中培养过夜。
细菌DNA提取方法按照北京全式金生物技术有限公司DNA提取试剂盒(M10208)说明书操作。
1.2.4 16S rDNA扩增
用通用引物扩增16S rDNA全长序列。
PCR扩增体系:DNA模板1μL、上下游引物各1μL、EasyTaq Super Mix 25μL、加入ddH2O 23μL后共组成50μL体系。用1%琼脂糖凝胶电泳分析PCR产物。
PCR扩增程序:95℃预变性5 min,95℃变性30 s,56℃退火30 s,72℃延伸90 s,72℃再延伸10 min,35个循环。
1.2.5 16S rDNA鉴定巴氏杆菌16S rDNA克隆与pMD-19T载体自连克隆。PCR产物切胶回收按照北京全式金生物技术有限公司胶回收试剂盒(L41118)的说明进行操作。
目的基因与pMD-19T连接反应体系:16S rDNA片段0.5µL、pMD-19T Vector 3.5µL、Solution I 6µL。pMD-19T载体自连反应体系:ddH2O 0.5µL、pMD-19T Vector 3.5µL、Solution I 6µL。
芽孢杆菌16S rDNA与pMD-19T载体自连转化。
1.2.6 提取质粒
按照高纯度质粒小提试剂盒的说明进行操作。
1.2.7 测序将鉴定后为阳性的质粒送测序(生工生物工程(上海)股份有限公司)。
1.2.8 序列分析测序所得的序列在NCBI BLAST上进行核苷酸比对,鉴定该细菌的种属[6]。
2 结果与分析
2.1 分离菌株菌落形态结果(见图1)
由图1可知,菌株经48 h培养后,培基上出现光滑、圆形突起、浅白色半透明、边缘整齐的菌落。用接种环挑取菌落,牵拉成丝。
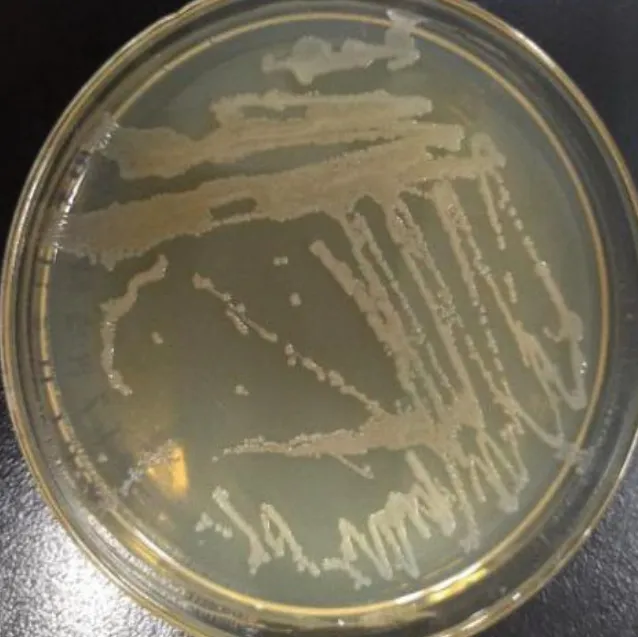
图1 分离菌株菌落形态Fig.1 Colony morphology of isolated strains
2.2 分离菌株染色镜检结果(见图2)
由图2可知,分离菌株细胞呈杆状、无芽孢、革兰氏染色阴性。

图2 分离菌株染色镜检(HE 10×100)Fig.2 Staining microscopic examination of isolated strains(HE 10×100)
2.3 16S rDNA电泳结果(见图3)
由图3可知,使用通用引物序列扩增出的细菌基因大小约为1 500 bp,与预期大小一致。

图3 16S rDNA电泳结果Fig.3 Result of 16S rDNA electrophoresis
2.4 16S rDNA克隆质粒鉴定结果(见图4)
由图4可知,扩增的基因片段大小约为1 500 bp,与预期的基因片段大小一致,该克隆为阳性克隆。

图4 16S rDNA克隆质粒的鉴定结果Fig.4 16 s rDNA cloned plasmid of appraisal results
2.5 BLAST分析结果(见图5)
由图5可知,该菌株的16S rDNA长度为1 500 bp,将其结果提交到NCBI数据库进行核酸比较,该菌株为猪源巴氏杆菌。

图5 16S rDNA测序结果Fig.5 Sequencing result of 16S rDNA
2.6 同源性分析(见图6、图7)
由图6、图7可知,将其结果提交到NCBI数据库进行核酸比对,建立进化树后分析表明,该菌株(PA)与登录号为AF139584、AY465371、AY465373、NR_026032、AF139577、U66492、KM555273的巴氏杆菌处于同一分支,且根据同源性分析,该菌株与其他巴氏杆菌菌株同源性均为99%以上。根据以上结果可以确定该菌株为巴氏杆菌。
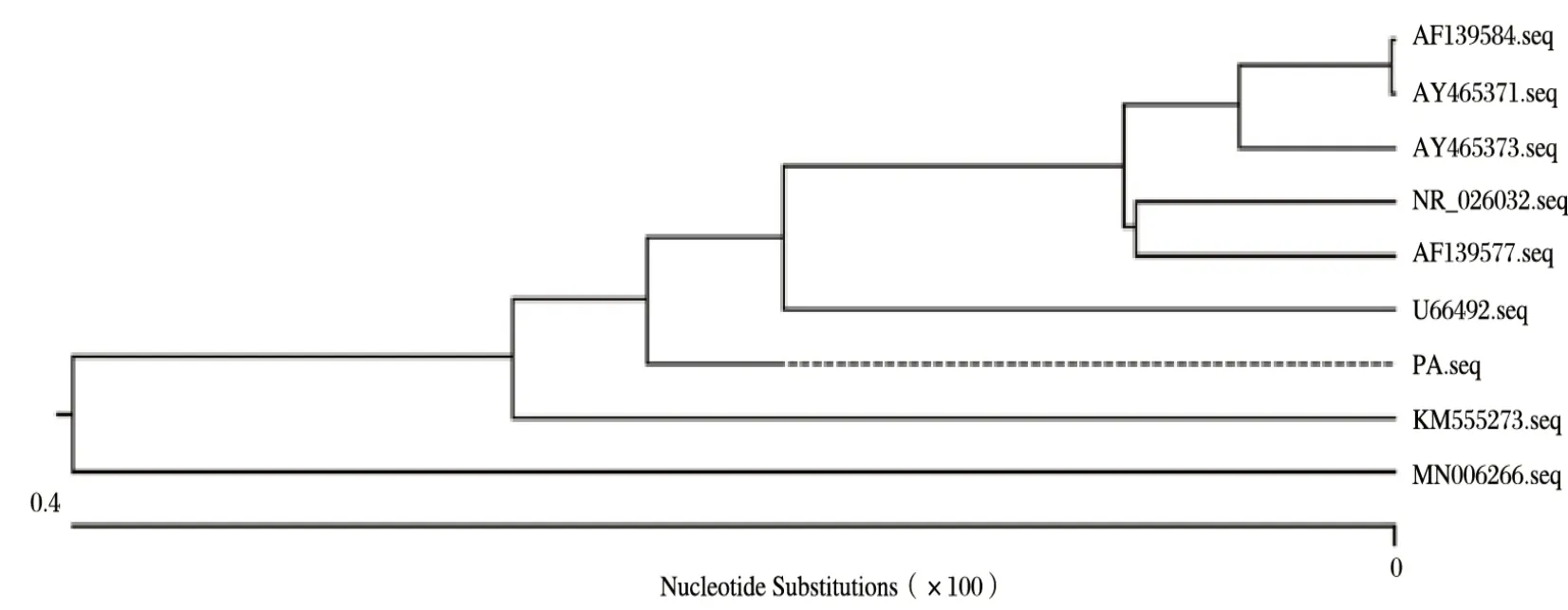
图6 进化树分析Fig.6 Evolutionary tree analysis

图7 同源性比较Fig.7 Homology comparison
3 讨论
巴氏杆菌病是养猪业中一种重要的传染性疾病。一般情况下,动物在发病前体内已经存在致病菌,当畜禽机体抵抗力下降时,致病菌便乘虚侵入体内,引发内源性感染最终导致死亡。巴氏杆菌常与多种病原发生混合感染,在气候变化剧烈等多种因素的共同作用下,猪群抵抗力降低,病原菌在其体内大量繁殖,进而导致继发性感染[7]。猪群发病后难以治疗并且治疗后容易复发,造成仔猪大量死亡。
近年来,由细菌感染引起动物发病的病例越来越多,给养殖业造成巨大损失[8]。目前,疫苗免疫仍是预防巴氏杆菌病的重要措施之一[9],因此,在日常养殖中,根据自身养殖场的实际情况,制定科学的疾病防控措施,始终以预防为主,防重于治的思维进行科学化养殖;同时,养殖户应每年对猪巴氏杆菌疾病预防性的接种两次,可有效预防或减少该病的流行,避免给养殖者带来经济损失。
本研究通过从病料中分离到的一株细菌,根据菌落培养和染色镜检的特点,初步鉴定该菌株为革兰氏阴性菌。采用分子生物学方法对菌株进行鉴定,并用16S rDNA通用引物对16S rDNA基因进行扩增和序列测定,结果表明,该菌株为巴氏杆菌,说明新疆阿克苏地区存在巴氏杆菌感染的情况。该养殖场应及时进行治疗或淘汰,彻底清扫消杀后再重新饲养仔猪,制定合理的免疫程序,科学进行防控;同时,要加强饲养管理,营造良好环境,减少疾病的发生,坚持以防控为主的综合防治措施,以免造成不必要的经济损失。
4 结论
本试验对出现呼吸异常的仔猪的病料进行细菌分离培养、染色镜检、16S rDNA分子生物学鉴定出该病料中有巴氏杆菌,证明该养殖场中出现呼吸困难的猪受到巴氏杆菌的感染。本试验为猪巴氏杆菌的分离鉴定及进一步研究致病机理提供参考。

