PPRV、RVFV、SBV三重普通及实时荧光定量RT-PCR检测方法的建立及其初步应用研究
赵文华,李富祥,杨仕标
(云南省畜牧兽医科学院云南省热带亚热带动物病毒病重点实验室,云南 昆明650224)
小反刍兽疫(peste des petits ruminants,PPR)是一种以被感染动物发热、口炎、腹泻和肺炎为临床特征的亚急性或急性烈性动物传染病,其致病病原体是副黏病毒科的小反刍兽疫病毒(peste des petits ruminants virus,PPRV)。小反刍兽疫因快速传播和较高的病死率,被世界动物卫生组织(OIE)列为必须报告的动物疫病,在我国为一类动物疫病[1-2]。2007年7月我国在西藏阿里地区首次发现小反刍兽疫疫情[3]。2013年底PPR再次沿河西走廊从新疆向全国范围快速传播,至今仍有零星散发[4-5]。PPR已成为严重威胁我国畜牧业生产安全的动物疫病之一。
裂谷热(rift valley fever,RVF)是一种由蚊子传播的人、畜共患疾病,其致病病原体是布尼亚病毒科白蛉病毒属的裂谷热病毒(rift Valley fever virus,RVFV),该病严重威胁人、畜健康[1,6]。最易感染RVF的宿主动物是绵羊、山羊、羔羊、牛、老鼠和一些野生动物。RVF最早于30年代初在肯尼亚东部裂谷省因导致感染羊的高流产率而被发现报道。近年来,已有30多个国家发现RVF,大部分位于非洲[7-8]。中国首例RVFV输入性人感染病例于2016年6月确诊,该病对我国也存在很大的威胁[9-10]。裂谷热已被OIE列为必须报告的疫病。目前,我国尚无动物感染该病的报道。
施马伦贝格病毒(schmallenberg virus,SBV)是一种正布尼亚病毒,于2011年11月在德国通过宏基因组检测首次被发现,此后在欧洲迅速传播[11-12]。SBV由库蠓传播,多种家畜和野生动物均易感染。感染的牛、羊会发热、腹泻、产奶量减少流产、后代畸形。2013年9月下旬,共有27个欧洲国家被认为是SBV感染区。2016~2017年,英国和法国仍然在爆发施马伦贝格病(SB)[13]。目前,我国尚无该病的报道。
PPR、RVF和SB是牛、羊等反刍动物重要的外来动物疫病。为了有效地防控3种外来动物疫病入侵,在边境地区外来动物疫病日常监测、海关进口活体牛、羊及其制品检验检疫中,需要对3种病原实施检测。
上述3种病毒均为RNA病毒,本研究通过设计、筛选不同引物及探针配对组合,优化反应条件,初步建立起PPRV、RVFV、SBV三重常规RT-PCR及实时荧光三联定量RT-PCR检测技术,以期能实现同步快速检测3种病毒并可鉴别诊断,从而提高疫病检测效率。
1 材料与方法
1.1 试验材料
1.1.1 阳性样本
PPRV-M阳性pMDTM18-T质粒样本为本实验室先前课题研究制备;RVFV-S片段阳性pMDTM18-T质粒样本为委托宝生物工程(大连)有限公司人工合成;SBV-S片段阳性pMDTM18-T质粒样本为昆明海关技术中心艾军博士馈赠;PPRV疫苗株为本课题组贮存;羊痘、羊口疮、口蹄疫、阿卡斑、蓝舌病及鹿流行性出血热等阳性病料为本实验室贮存。
1.1.2 临床样本
620份PPRV抗体阳性样本采自云南不同地区,258份鼻拭子及血凝块样本随机采自昆明辖区某大型牲畜交易市场及某规模化奶牛养殖场,47份野生及家养野生动物拭子样本或新鲜粪便样本采自迪庆藏族自治州。
1.1.3 引物及探针
根据参考文献[14-15]及GenBank相关序列,设计相关病毒检测引物及探针见表1和表2。
HPLC级探针及引物均由大连宝生物公司合成。用无RNAase酶的PCR级水将引物/探针干粉进行溶解,制备贮存引物/探针浓度为100µm/L、工作浓度为10µm/L探针、引物工作浓度为20µm/L。
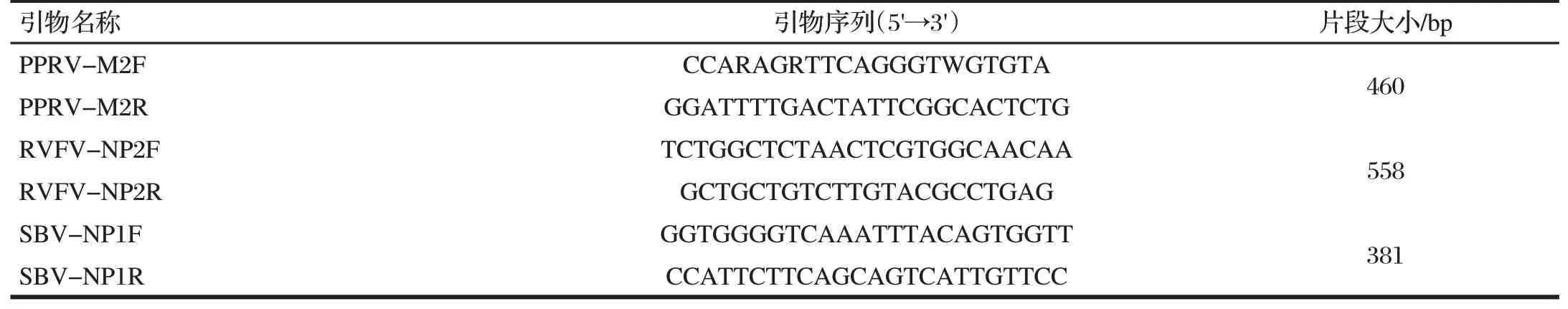
表1 PPRV、RVFV、SBV三重常规RT-PCR扩增引物情况Tab.1 Primers of triplex routine RT-PCR for Amplification of PPRV,RVFV,SBV
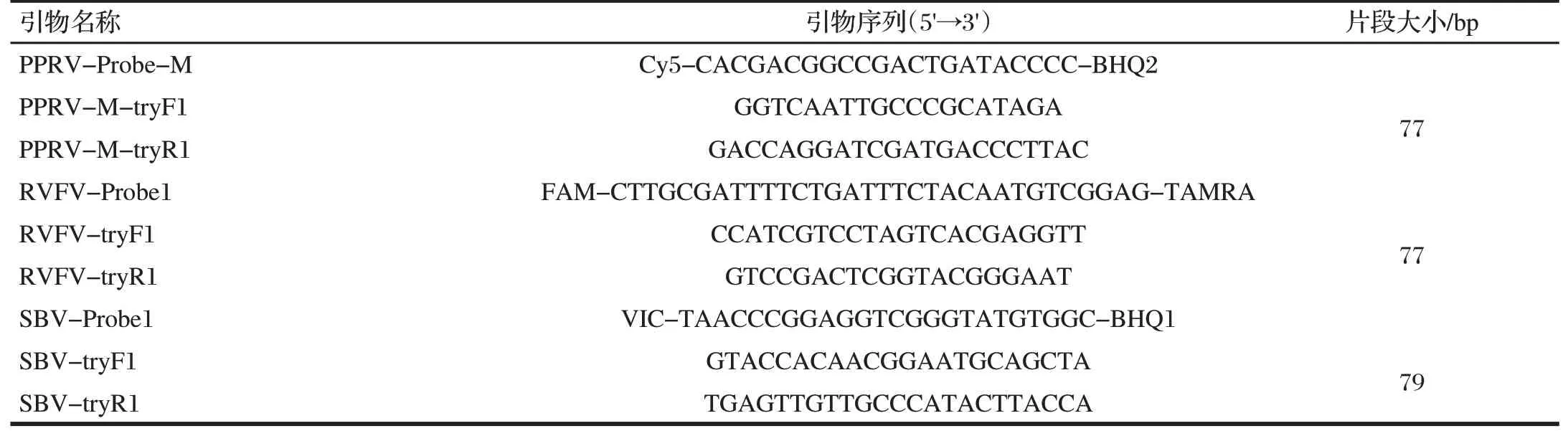
表2 PPRV、RVFV、SBV三重实时荧光定量RT-PCR扩增探针引物情况Tab.2 Probes and Primers of triplex real-time RT-PCR for detection of PPRV/RVFV/SBV
1.1.4 试剂、耗材及仪器设备
试剂盒耗材:0.85%无菌生理盐水为实验室配制,用于采集鼻拭子样本及样本浸泡;病毒核酸(DNA/RNA)的抽提用TaKaRa MiniBest Viral RNA/DNA Extraction kit;质粒样品的抽提用TaKaRa MiniBest Plasmid Purification Kit(9760);普通PCR扩增用TaKaRa Ex Taq(RR001A);普通RT-PCR扩 增 用TaKaRa One Step RNA PCR Kit(RR024A);实时荧光定量RT-PCR所用试剂盒为One Step PrimeScript TM RT-PCR(Perfect Real Time,RR064A);DNA片段胶回收选用型号为9762的TaKaRa MiniBest Agarose Gel DNA抽提试剂盒;T载体构建用pMDTM18-T Vector Cloning试剂盒;Marker DL2000、核酸染色剂GoldviewII分别为分子量标记和染色剂,上述试剂均购自宝生物工程(大连)有限公司。
仪器设备:ABI 7500 Fast荧光定量PCR仪、荧光定量PCR反应管、GeneAmp PCR SYSTEM 9700普通PCR仪为ABI公司产品;用于核酸定量测定的Nanovue Plus微量分光光度仪为GE公司产品;Blowest Agarose琼脂糖购自上海生工公司。
1.2 试验方法
1.2.1 病毒基因组DNA、RNA提取
采集的鼻拭子样本加入5~8 mL生理盐水浸泡过夜,各取200µL待用。采集的血液样本,取凝结后的血块加适量生理盐水研磨各取200µL待用。血清样本直接取200µL备用。然后按照试剂盒说明书提取病毒基因组DNA/RNA。
1.2.2 反应体系与反应程序
PPRV/RVFV/SBV三重常规RT-PCR反应液配制50µL。反应体系:10×One Step RNA PCR buffer 5.0µL、MgCI210.0µL、dNTP Mixture 5.0µL、RNase Inhibitor 1.0µL、AMV Reverse Transcriptase XL 1.0µL、AMVOptimized Taq 1.0µL、Primer PPR-M2F 1.0µL、Primer PPRV-M2R 1.0µL、Primer RVFV-NP2F 1.0µL、Primer RVFV-NP2R 1.0µL、Primer SBV-NP1F 1.0µL、Primer SBV-NP1R 1.0µL、质粒DNA(样品RNA或阳性对照RNA、阴性对照H2O)2.0µL、PCR级H2O 19.0µL。将上述各反应组分加入PCR反应管混匀,在ABI 9700普通PCR仪中进行扩增反应。反应程序:42℃、30 min,95℃、2 min,35×(94℃、30 s,55℃、30 s,72℃、1 min),72℃、10 min。反应完成后取适量反应液跑2.5%琼脂糖凝胶,然后于紫外成像仪上检测扩增结果。
PPRV/RVFV/SBV三重实时荧光定量RT-PCR反应液配制20μL。反应体系:2×One Step RT-PCR BufferⅢ10.0µL、TaKaRa Ex Taq HS 0.4µL、PrimeScript RT Enzyme MixⅡ0.4µL、RoxⅡ0.4µL、Primer PPRV-MtryF1 0.2µL、Primer PPRV-M-tryR1 0.2µL、PPRVProbe-M 0.4µL、Primer RVFV-tryF1 0.2µL、Primer RVFV-tryR1 0.2µL、RVFV-Probe1 0.4µL、Primer SBVtryF1 0.2µL、Primer SBV-tryR1 0.2µL、SBV-Probe1 0.4µL、样品RNA 6.0µL(或PPRV、RVFV、SBV阳性对照质粒DNA各2.0µL、阴性对照H2O 6.0µL)、PCR级H2O 0.4µL。将上述各反应组分加入PCR反应管并振荡混匀,在7500 Fast荧光定量PCR仪上进行反应和荧光信号的检测,反应程序:42℃、5 min,95℃、20 s,43×(95℃、5 s,60℃、35 s)。荧光信号检测在每个循环反应的60℃进行。
2 结果与分析
2.1 PPRV、RVFV、SBV三重普通常规RT-PCR方法的建立(见图1~图3)
经反复试验组合,最后筛选出PPRV-M2F/R、RVFVNP2F/R、SBV-NP1F/R引物对组合,可实现对PPRV、RVFV、SBV的特异性三重普通RT-PCR检测。当将3种引物对同时加入反应体系中时,同时存在3种病毒质粒DNA时有3条预期条带扩增出,分别是RVFV的558 bp条带、PPRV的460 bp条带和SBV的381 bp条带。由图1可知,加入两两组合的病毒质粒DNA有对应的2种特异片段;而仅有一种病毒质粒DNA存在时,只有一条特异条带。由图2、图3可知,三重常规RT-PCR对临床相似病毒羊痘、羊口疮、口蹄疫、阿卡斑、蓝舌病及鹿流行性出血热等病毒未有扩增,检测敏感度可达103copies/µL DNA。最优反应条件为:42℃、30 min,95℃、2 min,35×(94℃、30 s,55℃、30 s,72℃、1 min),72℃、10 min。

图1 PPRV-M2、RVFV-NP2、SBV-NP1引物对组合三重常规RT-PCR扩增结果Fig.1 The result of triplex routine RT-PCR amplified with PPRV-M2,RVFV-NP2,SBV-NP1 primer sets

图2 PPRV-M2、RVFV-NP2、SBV-NP1引物对组合三重常规PCR敏感性试验Fig.2 Sensibility test of the triplex routine PCR for PPRV-M2,RVFV-NP2,SBV-NP1 primer sets

图3 PPRV-M2、RVFV-NP2、SBV-NP1引物对组合三重常规RT-PCR特异性试验Fig.3 Specificity test of the triplex routine RT-PCR for PPRV-M2,RVFV-NP2,SBV-NP1 primer sets
2.2 PPRV、RVFV、SBV三重实时荧光定量RT-PCR方法的建立
以上述已经构建好的PPRV-M、RVFV-NP、SBV-NP的pMDTM-18T载体质粒标准品为模板,分别10倍系列稀制备109copies/µL~100copies/µL的质粒模板,然后按照最优反应条件用表2所示探针和配套引物对对标准品进行扩增,依据扩增曲线进行PPRV-RVFV-SBV三联标准曲线的构建,见图4。由图4可知,在102~107copies/µL浓度之间各质粒标准品浓度的对数与Ct值之间存在良好的线性关系,PPRV-M-Cy5探针标准曲线的方程式:Y=-3.399 639X+39.519020,R2=0.9991扩增效率为96.86%;RVFV-NP-FAM探针标准曲线的方程式:Y=-3.122288X+41.300 491,R2=0.999 1,扩增效率为109.06%;SBV-NP-VIC探针标准曲线的方程式:Y=-3.482 866X+42.405 140,R2=0.999 1,扩增效率为93.70%。上述方程式中Y为Ct值,X为拷贝数的对数(Log copy number),R2表示相关系数。
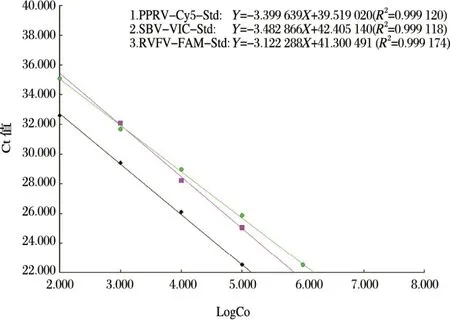
图4 PPRV、RVFV、SBV三重荧光定量RT-PCR标准曲线Fig.4 Standard curve of PPRV,RVFV,SBV triplex real-time RT-PCR
不同稀释度的质粒标准品出现梯度扩增曲线,见图5~图7。由图5~图7可知,若以Ct值35为阳性样品临界值来计算,则PPRV-M-Cy5探针的样本理论上的检测敏感性可低至101.33copies/µL,SBV-NP-VIC探针对样本的理论检测敏感度可达102.13copies/µL,RVFV-NP-FAM探针对样本的理论检测敏感度可达102.02copies/µL;较普通常规RT-PCR的敏感性均高近10倍。以优化的反应条件选取104、105、106、107copies/µL的质粒标准模板分别连续扩增3次进行荧光信号的检测,检测结果显示PPRV、RVFV、SBV每个梯度的样本重复性均很好。统计学分析结果见表3。由表3可知,组内重复性试验中变异系数均小于2.5%,表明所构建的方法具有较好的重复性与稳定性。
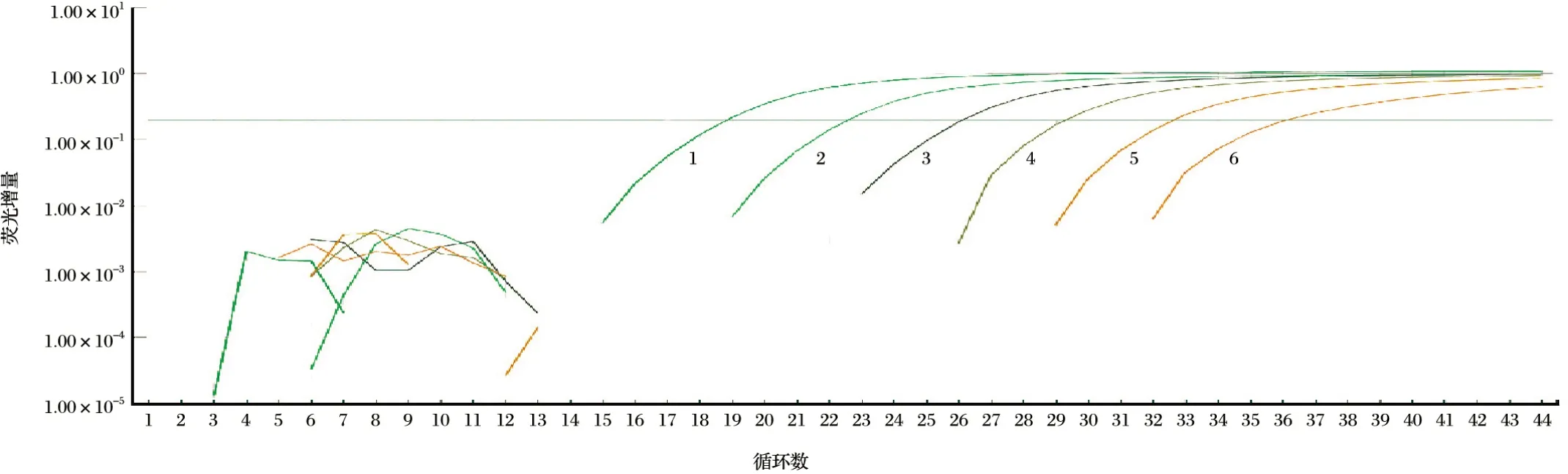
图5 质粒标准品PPRV-M动力学扩增曲线Fig.5 Dynamic curve of PPRV-M standard plasmid

图6 标准品质粒RVFV-NP动力学扩增曲线Fig.6 Dynamic curve of RVFV-NP standard plasmid
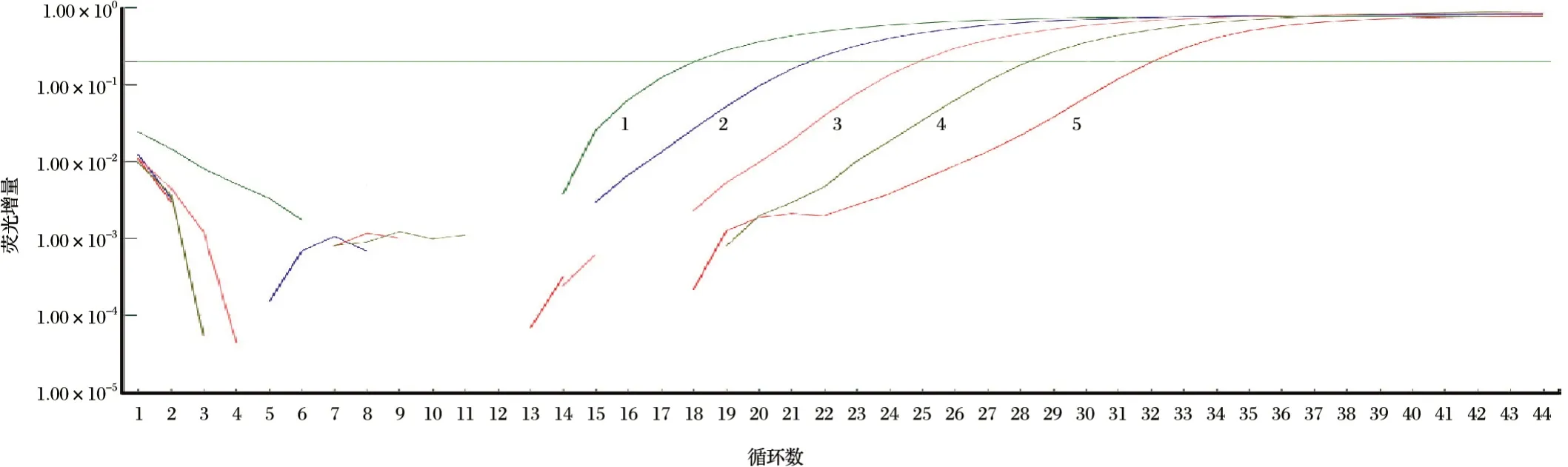
图7 标准品质粒SBV-NP动力学扩增曲线Fig.7 Dynamic curve of SBV-NP standard plasmid
2.3 三重实时荧光定量检测方法特异性测定及其初步临床应用(见图8)
用上述已经建立的PPRV、RVFV、SBV三重荧光实时定量RT-PCR方法对620份PPRV抗体阳性血清样本、258份鼻拭子和血凝块样本及47份野生动物拭子样本或新鲜粪便样本,抽提DNA、RNA后进行检测。
由图8可知,上述样本中均未检测到RVFV及SBV核酸阳性样本,在鼻拭子样本中检测出一例羊PPRV核酸阳性样本(该阳性样本经普通RT-PCR扩增和序列测定Blast比对后确定为PPRV谱系IV型)。
表3 PPRV、RVFV、SBV三重实时荧光定量RT-PCR标准品重复性试验Tab.3 Repeatability test of triplex real-time RT-PCR for PPRV,RVFV,SBV standard plasmids
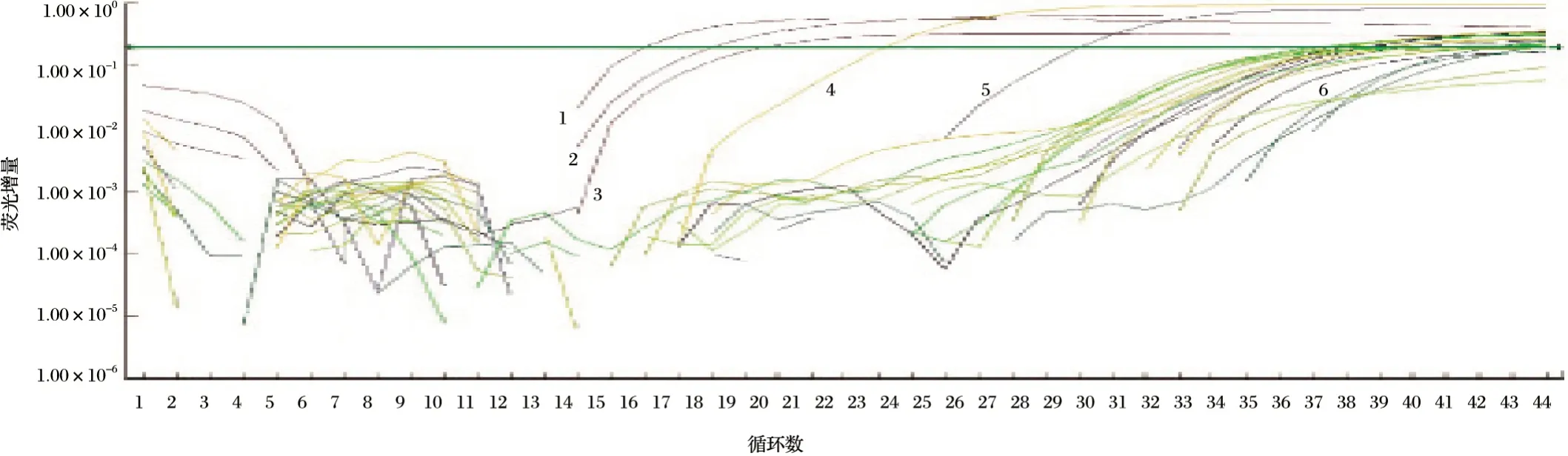
图8 临床样本PPRV、RVFV、SBV三重荧光定量RT-PCR特异性检测荧光曲线Fig.8 Fluorescence curve of PPRV,RVFV,SBV triple fluorescencequantitative RT-PCR in clinical samples
3 讨论
实时荧光定量PCR/RT-PCR一种快速定性并可定量的新型检测技术。检测仪器的荧光检测一般有4个通道,第1通道检测波长为515~530 nm,可用荧光素及染料为FAM、SYBR Green I;第2通道检测波长为560~580 nm,可用荧光素及染料为VIC、HEX、JOE、TAMRA、TET或Cy3;第3通道检测波长为610~650 nm,可用荧光素及染料为ROX、TEXAS-Red;第4通道检测波长为675~730 nm,可用荧光素及染料为Cy5。选用不同检测通道的标记物对探针进行差异荧光标记可实现两病或更多病的同步快速检测。
本实验室所用的ABI 7500 Fast荧光定量PCR仪,因为选择“ROX”染料作为背景参照,所以对于该仪器来说是不能选择第3通道的荧光染料来标记探针的,该仪器最多只能同时进行三联探针的检测。本研究即通过用“Cy5-BHQ2”、“FAM-TAMRA”及“VIC-BHQ1”分 别 标 记PPRV-M探针、RVFV-NS探针及SBV-NP探针,来实现对PPRV、RVFV及SBV的同步三重快速检测。
三重反应时较单独反应会有竞争试剂的些许相互影响,即扩增效率较单独扩增反应会有些许的变化,但这在大规模检测时会大大降低诊断、检测试剂成本,较适合高通量检测。
本研究所建立的PPRV、RVFV、SBV三联探针实时荧光定量RT-PCR检测方法可特异性地对PPRV、RVFV和SBV进行同步快速检测,现已经进行初步的临床应用,但仍需进行大批量临床样本的验证和进一步的优化。而本研究中所的构建PPRV、RVFV、SBV的特异性三重普通常规RT-PCR检测方法,亦可实现对该三种病毒的同步检测,具有一般PCR仪的普通基层实验室即可推广使用。
4 结论
本研究初步建立可同步特异性检测PPRV、RVFV和SBV的三重普通RT-PCR方法和三重实时荧光定量RTPCR方法,并进行初步临床应用。PPRV、RVFV、SBV三重普通RT-PCR方法检测敏感度可达103copies/µL DNA;PPRV、RVFV、SBV三重实时荧光定量RT-PCR方法检测敏感度可达101.33~102.13copies/µL DNA。PPRV、RVFV、SBV三重普通常规RT-PCR检测方法及三联实时荧光定量RT-PCR方法为PPRV、RVFV和SBV的高通量快速检测以及鉴别诊断提供参考。

