转录组学解析茉莉酸甲酯对双孢蘑菇个体大小的影响机制
宋 媛,胡秋辉,苏安祥,裴 斐,马高兴,马 宁,杨文建
(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023)
双孢蘑菇(Agaricus bisporus)又称白蘑菇、洋蘑菇、纽扣蘑菇等,富含维生素、甘露醇等营养物质,具有低脂肪、低能量、高蛋白的特征,是一种典型的菌类保健食品[1-2]。双孢蘑菇是世界上种植最广泛的食用菌,也是市场上最常见的食用菌,在我国双孢蘑菇的消费量和出口量较大,经济收益十分可观[3]。通过适宜的栽培条件,可提高双孢蘑菇品质,增加经济效益。赵志顺等[4]的研究证明泥炭覆土可改善双孢蘑菇品质,由于改变栽培条件操作复杂,增加了原料成本及劳动力,寻找一种新型、简便、经济的提高双孢蘑菇品质的方法并研究其作用机理具有重要意义。
近年来,外源喷施茉莉酸甲酯(methyl jasmonate,MeJA)成为一种新兴的改善作物品质的方式。MeJA是植物体内广泛存在的天然化学物质,其外源应用能调节植物的生长发育[5],也能激发防御植物基因的表达[6]。MeJA作为新型植物调节物质,近年来被广泛用于园艺作物和农作物的品质优化中。外源喷施MeJA可增大香蕉李的果实大小和质量[7],可提高不同灌溉条件下的2 个面包小麦品种的穗粒数、千粒质量和籽粒产量[8],以及增加香雪兰的小花数和提高植株高度[9]。对于双孢蘑菇品质的提高,过去主要采取改良覆土层的方式实现,通过外源喷施MeJA的方式鲜见报道。在前期MeJA外源喷施处理对双孢蘑菇采后保鲜的研究中[10],发现菇蕾期喷施MeJA提高双孢蘑菇采后保鲜品质的同时还能促进双孢蘑菇个体增大,因此MeJA可作为双孢蘑菇的新型品质优化剂,探究MeJA促进双孢蘑菇个体增大的机理具有重大意义。
转录组学技术因其具有低成本、高通量、重复性好、精确度高以及操作简单等优点,被广泛用于差异表达基因的研究。张艳艳等[11]利用转录组测序技术揭示了西瓜噬酸菌2 个不同菌株与寄主甜瓜幼苗互作在转录水平上的表达差异,明确了CaM、Rboh、CDPK、FLS2等基因在西瓜噬酸菌与寄主之间早期互作的重要性。吴小梅[12]利用转录组学测序技术,对3 个不同发育时期的双孢蘑菇子实体进行测序和Pathway功能富集分析,筛选得到的差异基因主要富集在核苷酸代谢、脂类代谢、能量代谢、碳水化合物代谢和氨基酸代谢这5大代谢通路中,包括激酶蛋白、信号受体蛋白以及一些转录调控活性蛋白等酶类蛋白,表明双孢蘑菇子实体发育形成需要一系列代谢反应协同调控以及各类转录因子基因的表达调控。边小禹等[13]通过转录组学分析挖掘了3 个不同发育时期的猪苓菌核中有关防御、跨膜运输、极性生长、形态发育、细胞壁合成、黑色素合成、药效成分麦角甾醇和猪苓多糖合成功能的差异表达基因,根据差异表达基因通路富集注释进一步推测出猪苓菌核的发育成熟机制。因此,利用转录组学测序技术研究探索MeJA促进双孢蘑菇个体增大的基因具有重要的意义。
本研究以双孢蘑菇为材料,采用不同浓度的MeJA溶液采前喷施处理,筛选得到能使双孢蘑菇个体增大的MeJA浓度,并结合转录组学分析研究MeJA处理促进双孢蘑菇个体增大的作用机制,为MeJA促进双孢蘑菇的个体增大提供理论依据。
1 材料与方法
1.1 材料与试剂
本研究选用的双孢蘑菇栽培、采摘于江苏紫山生物股份有限公司(江苏淮安)。
MeJA(纯度95%) 美国Sigma公司;无水乙醇(分析纯) 南京化学试剂有限公司;细胞色素P450氧化酶ELISA检测试剂盒、木葡聚糖内转糖苷酶/水解酶ELISA检测试剂盒、内切-β-1,4-葡聚糖酶ELISA检测试剂盒 南京立奥生物科技有限公司。
MeJA溶液配制:向2%乙醇溶液分别添加MeJA,配制浓度分别为10、50、100、150、200 μmol/L的MeJA溶液。
1.2 仪器与设备
HWS-280恒温恒湿培养箱 宁波江南仪器设备有限公司;CS501-SP数显恒温振荡水浴锅 重庆四达试验仪器有限公司;M2E型多功能酶标测试仪 美国BioTek公司;Allegra系列冷冻离心机、Allegra 64R台式离心机美国Beckman Coulter公司;Gel DOCXR凝胶成像分析系统 美国Bio-Rad公司。
1.3 方法
1.3.1 样品处理
设置超纯水为空白组、2%乙醇溶液为乙醇组,不同浓度的MeJA溶液为处理组,每组处理设置3 床双孢蘑菇。当双孢蘑菇处于出菇期第4天(菇蕾直径=(9.77f 0.16)mm)时,将不同处理组的溶液以30 mL/m2均匀喷洒于双孢蘑菇表面。自喷菇之日起,每天采摘双孢蘑菇,连续采收4 d,直至达到双孢蘑菇采收期(喷施处理后第3天)。选择菇体完整、无机械损伤和病虫危害的双孢蘑菇,随机取同一处理组双孢蘑菇10 个左右分离菌伞、菌柄,将菌伞和菌柄分别混合作为一组样品,再进行相同操作2 次,每种处理取3 组样品作为平行样。将所有样品液氮冷冻,置于-80 ℃冰箱中保存备用。
1.3.2 指标测定
1.3.2.1 双孢蘑菇大小及质量测定
从各个处理组样品中随机取10 个双孢蘑菇,测量菌伞直径、厚度,并称质量。筛选出最佳促双孢蘑菇个体增大的MeJA浓度,并选用个体增大最显著的处理组进行后续研究。
1.3.2.2 细胞色素P450氧化酶、木葡聚糖内转糖苷酶/水解酶及内切-β-1,4-葡聚糖酶活力测定
分别采用细胞色素P450氧化酶ELISA检测试剂盒、木葡聚糖内转糖苷酶/水解酶ELISA检测试剂盒和内切-β-1,4-葡聚糖酶ELISA检测试剂盒对双孢蘑菇菌伞进行酶活力测定。
1.3.2.3 总RNA的提取与测序文库的构建
选择第0天和第1天的双孢蘑菇菌伞进行转录组学测序。用Trizol试剂提取总RNA,取双孢蘑菇样品0.1 g,在液氮中充分研磨至粉末后置于1.5 mL离心管中,加入1 mL Trizol抽提液。室温下放置5~10 min后,12 000 r/min离心15 min,取上清液并加入1/5体积的氯仿,剧烈振荡15 s后在冰上放置5 min;12 000 r/min离心15 min,取上清液于另一离心管中,加入等体积异丙醇并上下颠倒混匀,在冰上放置15~20 min;12 000 r/min离心15 min后弃去上清液。将沉淀用1 mL 75%乙醇溶液清洗2 次,并于4 ℃、7 500 r/min离心10 min,弃去上清液,室温下干燥1~2 min即得样品总RNA。利用凝胶成像系统和酶标仪检测RNA的质量。完整的RNA具有3 条明显的条带,28S、18S和5S rRNA,且28S条带是18S条带亮度的2 倍。测定RNA的浓度和OD260nm/OD280nm值,RNA的OD260nm/OD280nm值介于1.8和2.1之间[14]。样品检测合格后,由上海欧易生物医学科技有限公司完成cDNA文库的构建及高通量测序。
1.3.2.4 转录组学数据分析
高通量测序中产生的原始数据(raw reads)为fastq格式序列。为了得到可进行后续分析的高质量reads,需进一步对raw reads进行质量过滤。采用Trimmomatic[15]软件进行质控并除去接头,在此基础上过滤掉低质量的碱基和N碱基,得到高质量的数据。使用hisat2[16]将clean reads比对到物种的参考基因组,软件参数为默认参数,通过基因组的比对率评估样本的情况(双孢蘑菇基因组网址:ftp://ftp.ncbi.nlm.nih.gov/genomes/all/GCF/000/300/575/GCF_000300575.1_Agabi_varbisH97_2/GCF_000300575.1_Agabi_varbisH97_2_genomic.fna.gz)。
Clean reads与参考基因组比对的结果,以二进制binary文件进行储存。基因FPKM表达量值采用cufflinks[17]软件定量。在计算基因表达量的差异时,利用htseqcount[18]软件得到落到各个样本中基因的reads数目,使用DESeq(2012)R package[19]的estimateSizeFactors函数对数据进行标准化,并使用nbinom Test函数计算差异比较的P值和Fold Change值。挑选出Fold Change大于2、P值小于0.05的差异基因,并进行差异基因的基因本体(gene ontology,GO)[20]富集分析,以判定差异基因的功能。
1.4 数据处理
双孢蘑菇个体大小及质量测定设置10 组平行,其余指标的测定设3 组平行,在荧光定量结果分析时,设内参基因的表达值为1。采用Origin 8.5.1软件进行数据处理和作图,JMP 10软件进行数据统计分析,利用Duncan法进行多重分析,P<0.05,差异显著。
2 结果与分析
2.1 MeJA处理对双孢蘑菇个体大小的影响
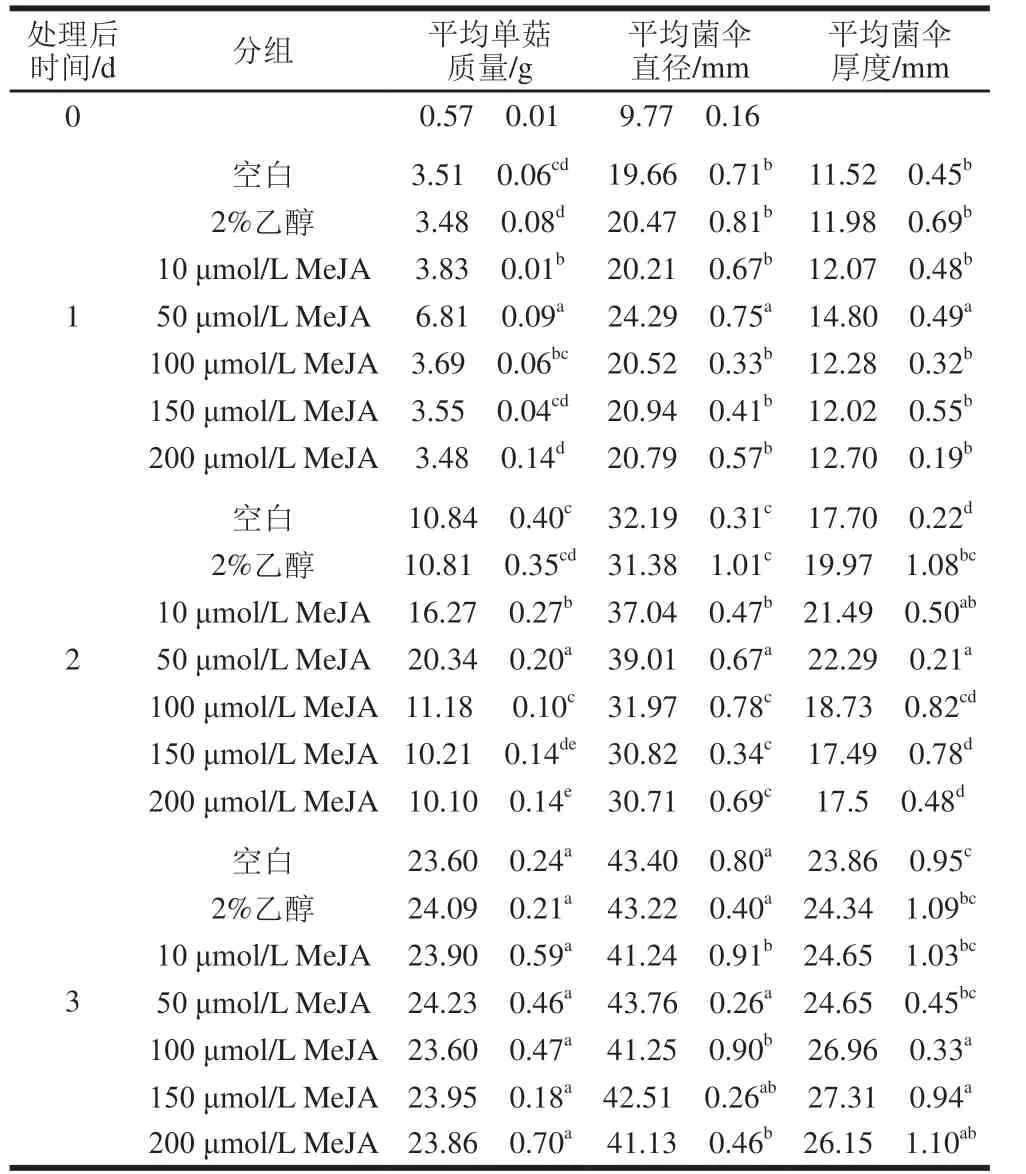
表1 不同处理对双孢蘑菇个体大小的影响Table 1 Effect of different treatments on the size of A.bisporus
由表1可知,与对照组相比,50 μmol/L MeJA能显著促进双孢蘑菇个体增大。在喷施MeJA后的第1天,经50 μmol/L MeJA处理的双孢蘑菇平均单菇质量、菌伞直径和菌伞厚度均显著高于其他组(P<0.05),其中平均单菇质量约为其他组双孢蘑菇的2 倍。处理后第2天,50 μmol/L MeJA处理的双孢蘑菇平均单菇质量和大小仍显著高于其他组(P<0.05),且基本达到采收期的大小。处理后第3天,各组双孢蘑菇均达到采收期大小,无显著差异。结果表明50 μmol/L MeJA能促进双孢蘑菇的个体增大,使双孢蘑菇提前1 d生长至采收期大小。因此本研究促进双孢蘑菇个体增大的最佳MeJA浓度为50 μmol/L,后续结果分析中的MeJA处理均指代50 μmol/L MeJA处理。
2.2 MeJA处理对双孢蘑菇生长相关酶活力的影响

图1 不同处理对双孢蘑菇细胞色素P450氧化酶(A)、木葡聚糖内转糖苷酶/水解酶(B)和内切-β-1,4-葡聚糖酶(C)活力的影响Fig.1 Effect of different treatments on the activities of cytochrome P450 oxidase (A), xyloglucan endotransglucosylase/hydrolase (B) and endo-β-1,4-glucanase (C) in A.bisporus
由图1可知,经50 μmol/L MeJA喷施处理后,双孢蘑菇中细胞色素P450氧化酶活力在第1、3天显著增加(P<0.05),第2天酶活力与其他组相比无显著差异。MeJA处理对双孢蘑菇中木葡聚糖内转糖苷酶/水解酶活力并无明显的调控趋势。3 组双孢蘑菇样品中内切-β-1,4-葡聚糖酶活力在处理后第1天无显著差异,第2天处理组酶活力显著高于空白组和乙醇组(P<0.05)。因此,MeJA可能通过诱导增加细胞色素P450氧化酶、内切-β-1,4-葡聚糖酶的活力促进双孢蘑菇的个体增大。
2.3 转录组学测序数据统计
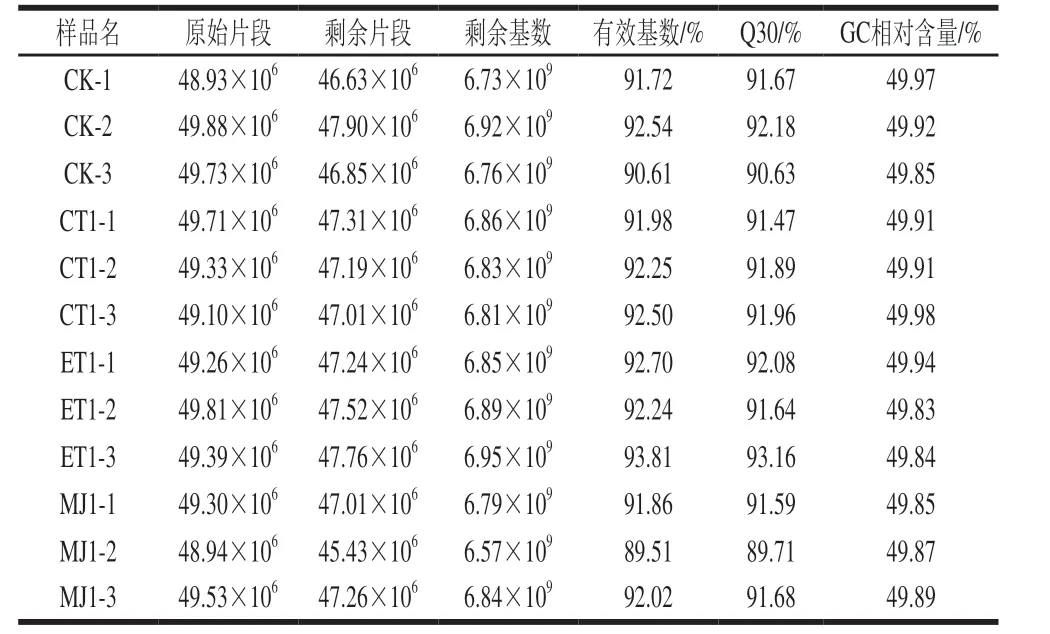
表2 样品测序产出数据质量评估情况Table 2 Quality assessment of sequencing output data of samples
由表2可知,对双孢蘑菇不同处理的样本进行转录组学测序,获得的原始片段均高于48×106,对原始数据进行质量预处理后,对整个质控过程中的reads数进行统计汇总得到超过45×106的剩余片段,且有效基数均高于89%。4 组样本的平均Q30值分别为91.49%、91.77%、92.29%和90.99%,平均GC相对含量分别为49.91%、49.93%、49.87%和49.87%。由此可见,转录组测序得到的数据数量和质量都较高,达到标准,可用于后续研究分析。
2.4 与参考基因组比对分析
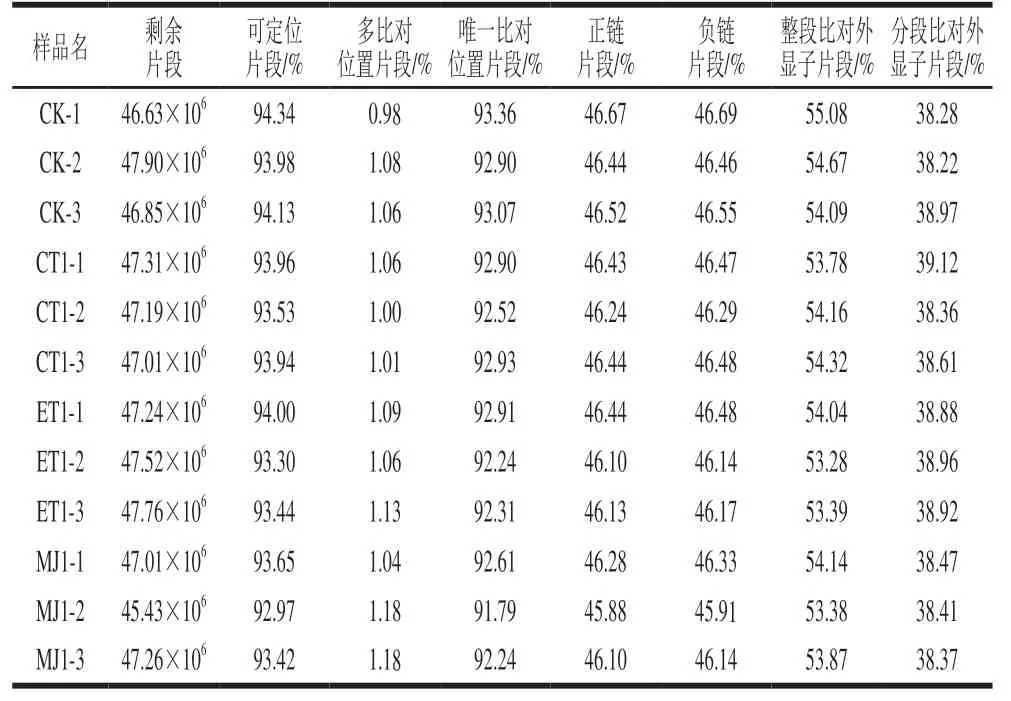
表3 Reads与参考基因组比对情况Table 3 Results of reads mapping to the reference genome
为了检查测序得到的基因文库是否满足后续基因表达的计算,将有效序列与指定的参考基因组进行序列比对,获取在参考基因组或基因上的位置信息,以及测序样品特有的序列特征信息。由表3 可知,转录组测序获得的有效序列中,能定位到基因组上的序列片段占比均在92.97%~94.34%范围内。在参考序列上,具有多个比对位置的序列片段占比均在0.98%~1.18%范围内;具有唯一比对位置的序列片段占比在91.79%~93.36%范围内;比对到基因组上正链的序列片段占比在45.88%~46.67%范围内,比对到负链上的序列片段占比均在45.91%~46.69%范围内。定位到基因组上的序列片段中,能整段比对到外显子占比在53.28%~55.08%范围内,分段比对到外显子占比在38.22%~39.12%范围内。该结果表明所有文库基本检测到了组织内所有表达的基因,满足后续基因的表达计算。
2.5 差异基因整体分布情况分析

图2 CT1 vs CK(A)、ET1 vs CK(B)、MJ1 vs CK(C)差异基因表达MA图Fig.2 MA plots of differentially expressed genes in CT1 vs CK (A),ET1 vs CK (B) and MJ1 vs CK (C)
通过MA图[21]可以了解差异表达基因的整体分布情况。如图2所示,在3 个对比处理组中,MJ1 vs CK组的显著差异基因最多。CT1与CK比较,共筛选得到267 个差异基因,其中上调基因134 个,下调基因133 个;ET1与CK比较,共筛选得到243 个差异基因,其中上调基因93 个,下调基因150 个;MJ1与CK比较,共筛选得到525 个差异基因,其中上调基因212 个,下调基因313 个。结果表明经50 μmol/L MeJA处理后,双孢蘑菇中基因变化差异最大,这种变化可能与双孢蘑菇更快速的生长活动相关,说明MeJA通过影响基因的差异表达促进双孢蘑菇的个体增大。
2.6 差异基因GO富集分析
GO富集分析可以为基因产物提供三类描述,即生物过程、细胞成分和分子功能,通过差异基因的GO富集分析,可研究基因的功能,如图3所示,在3 个对比处理组中,CT1 vs CK、ET1 vs CK和MJ1 vs CK中的总上调和下调差异表达基因数分别为64和46、44和53、95和126。在生物过程这一功能分类中,3 组处理中大多数差异表达基因都富集在细胞过程条目,其中,MJ1 vs CK组中有52 个上调基因和54 个下调基因,显著多于CT1 vs CK组中的38 个上调基因、18 个下调基因和ET1 vs CK组中的21 个上调基因和21 个下调基因。在细胞成分分类中,MJ1 vs CK组中有59 个上调基因和68 个下调基因富集在细胞这一条目,而CT1 vs CK组中只有43 个上调基因和23 个下调基因、ET1 vs CK组中25 个上调基因和27 个下调基因富集在该GO条目。分子功能中催化活性这一GO条目包含了大多数差异表达基因,其中MJ1 vs CK组中有69 个上调基因和84 个下调基因,多于CT1 vs CK组中48 个上调基因和32 个下调基因以及ET1 vs CK组中32 个上调基因和38 个下调基因。这些基因功能都与双孢蘑菇的生长代谢相关,说明MeJA可以通过影响以上GO条目中基因的差异表达促进双孢蘑菇的个体增大。
2.7 双孢蘑菇个体增大相关基因筛选
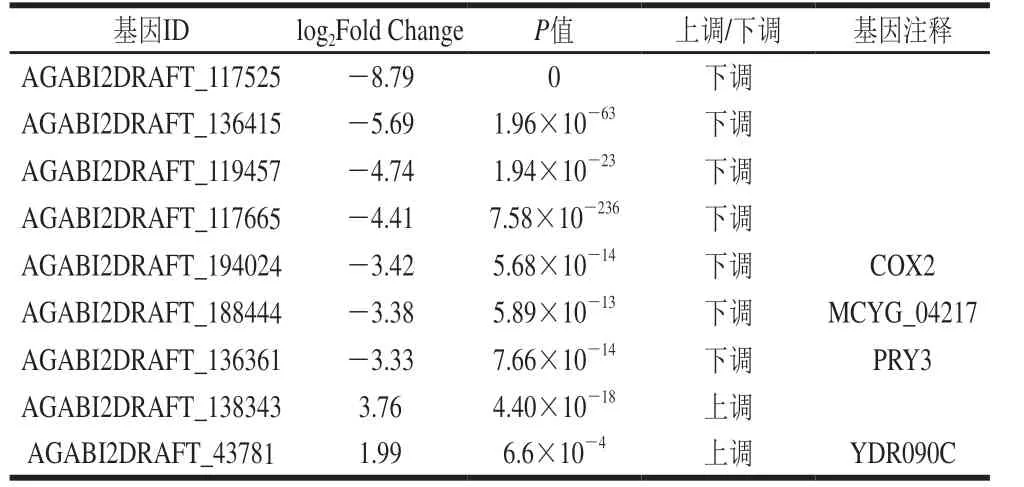
表4 双孢蘑菇个体增大相关基因筛选结果Table 4 Screening results of genes related to the size of A.bisporus
从基因文库中筛选表达差异最显著的部分基因,见表4。筛选得到的基因多为未注释的基因,且多为下调表达,仅基因AGABI2DRAFT_43781和A G A B I 2 D R A F T_1 3 8 3 4 3 上调表达。其中基因AGABI2DRAFT_136361与疏水蛋白的形成有关;基因AGABI2DRAFT_188444与锌金属蛋白酶的编码相关;基因AGABI2DRAFT_194024参与编码细胞色素P450单加氧酶;基因AGABI2DRAFT_43781与非特异膜蛋白形成相关。该筛选结果表明MeJA可以通过影响以上基因的差异表达来促进双孢蘑菇的个体增大。
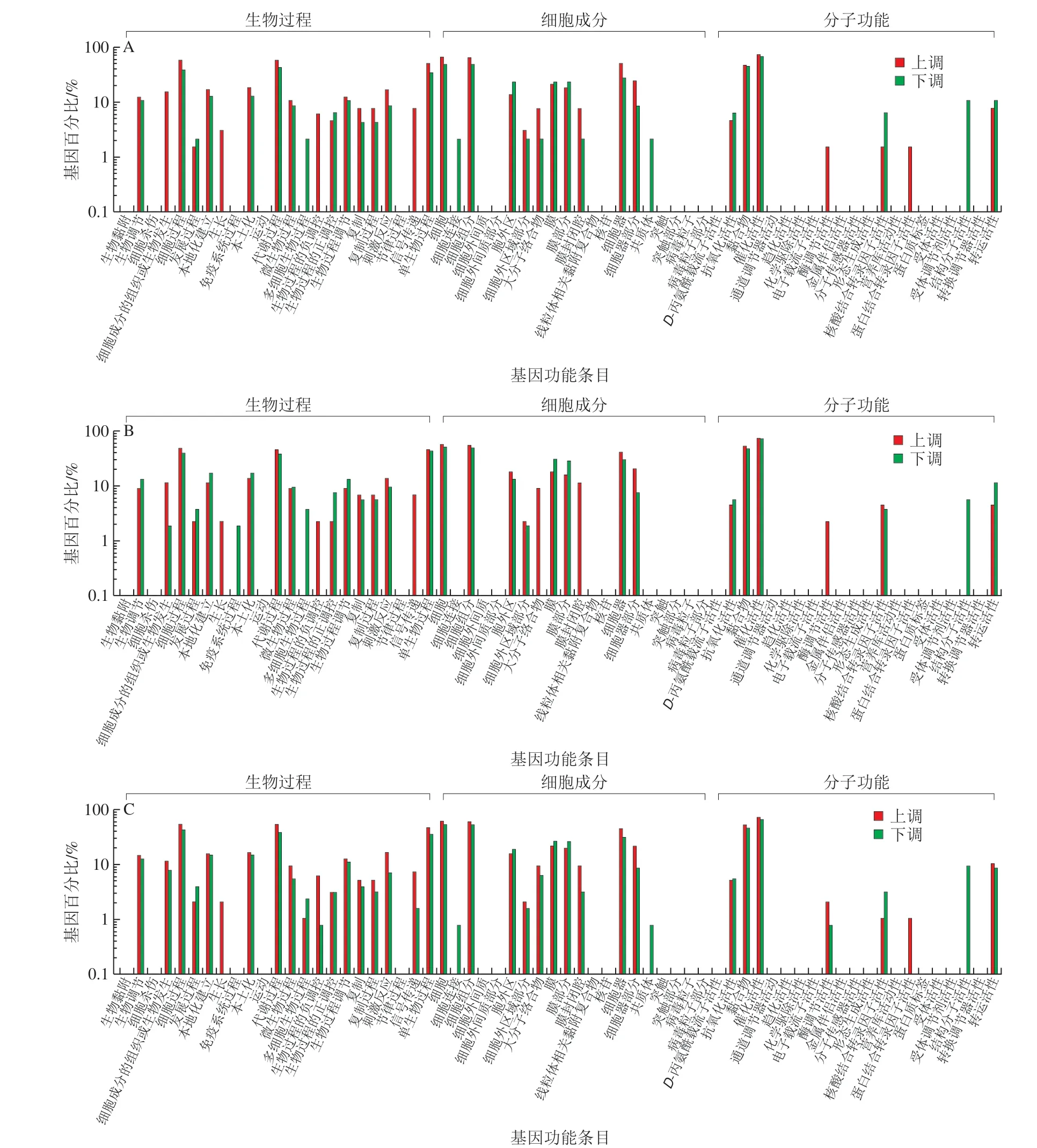
图3 CT1 vs CK(A)、ET1 vs CK(B)、MJ1 vs CK(C)差异基因GO富集结果Fig.3 GO enrichment analysis of differentially expressed genes in CT1 vs CK (A), ET1 vs CK (B) and MJ1 vs CK (C)
3 讨论与结论
本研究结果表明50 μmol/L MeJA能促进双孢蘑菇个体增大,提前1 d达到采收期大小。与以往在覆土层中添加一定量的豆粕[22]、石灰石[23]或恶臭假单胞菌[24]等提高双孢蘑菇品质的方式相比,外源喷施MeJA简化了生产过程,同时,每1 m2菇床只需要喷施0.327 μL MeJA,减少了原料投入,提高了经济效益。
双孢蘑菇生长过程中,处理组细胞色素P450氧化酶活力在第1、3天显著高于空白组和乙醇组,内切-β-1,4-葡聚糖酶活力在第2天显著高于其他组。杨杰等[25]指出细胞色素P450单加氧酶(CYP450)是植物代谢过程中最大的酶家族,参与三萜和甾醇骨架结构的多样化以及功能修饰,三萜类化合物和甾醇在植物的生长发育过程中发挥着重要作用。戴永国等[26]研究表明细胞色素P450家族酶参与很多与发育相关的内源性物质的代谢,进而影响机体的生长发育。内切-β-1,4-葡聚糖酶是一种纤维素酶,可以从多种材料中消化纤维素,如纤维素、β-1,4-葡聚糖[27]。张新富等[28]研究发现,内切-β-1,4-葡聚糖酶与茌梨果实生长发育有关。内切-β-1,4-葡聚糖酶能够促进组织的快速生长以及果实的成熟[29]。因此MeJA可能通过诱导增加细胞色素P450氧化酶、内切-β-1,4-葡聚糖酶活力,促进双孢蘑菇的个体增大。
双孢蘑菇的生长由很多基因决定。有研究表明hypB基因、ATP合成酶亚基编码基因AtpD和隔膜蛋白编码基因SepA对双孢蘑菇子实体的良好发育具有重要作用[30];翻译延长因子1a基因对维持双孢蘑菇成熟细胞的形态具有重要作用,C2H2型锌指蛋白、真菌特异性转录因子、热激蛋白转录因子hsf1[12];疏水蛋白基因hypA、脲酶基因及起渗透调节作用的甘露醇脱氢酶基因参与了双孢蘑菇子实体的形成过程[31-32]。本研究采用转录组学技术研究50 μmol/L MeJA对双孢蘑菇个体的促增大作用,检测到双孢蘑菇生长过程中富集在细胞过程、细胞、催化活性等GO条目中的上调和下调表达基因数目均显著增加,这些功能条目均与生长发育相关,结果表明MeJA通过影响这些GO条目中基因的差异表达促进双孢蘑菇的个体增大。从差异基因中筛选的差异最显著部分基因中,有功能注释的基因AGABI2DRAFT_136361、AGABI2DRAFT_188444、AGABI2DRAFT_194024和AGABI2DRAFT_43781分别与疏水蛋白、锌金属蛋白酶、细胞色素P450单加氧酶和非特异膜蛋白的形成相关。疏水蛋白参与真菌许多形态发生过程,包括分生孢子萌发、子实体发育[33]。含锌金属蛋白酶可参与调控多种细胞内物质的活动,如调节纤维素的沉积[34],进而影响机体组织等的发育[35]。细胞色素P450单加氧酶可在植物发育过程中发挥着特异性调节作用[36]。膜脂结构存在许多膜蛋白,包括各种酶、蛋白转位酶复合物以及许多转运蛋白,在生物体细胞的增殖和分化、能量转换、信号转导及物质运输等许多生命活动中起着非常重要的作用[37]。这些基因都参与双孢蘑菇的生长发育,均与双孢蘑菇的生长发育相关,说明MeJA可能通过调控这些差异基因的表达促进双孢蘑菇的个体增大。通过转录组学技术能更深入、全面地从整体水平上研究细胞中基因转录的情况及转录调控规律,这也为后续进一步差异基因的功能验证、差异基因受MeJA调控在双孢蘑菇生长期间的功能解析及MeJA促进双孢蘑菇个体增大调控网络的精确描绘提供了理论依据。
因此,50 μmol/L MeJA能促进双孢蘑菇的个体增大,导致双孢蘑菇个体增大的原因可能是50 μmol/L M e J A 处理后,双孢蘑菇生长过程中一些基因的表达、生长代谢活动以及一些酶活力受到调控。其中与生长相关的基因A G A B I 2 D R A F T_1 3 6 3 6 1、AGABI2DRAFT_188444和AGABI2DRAFT_194024下调表达,基因AGABI2DRAFT_43781上调表达;富集在细胞过程、细胞、催化活性等与生长发育相关的GO条目中的上调和下调表达基因数目显著增加;与生长发育相关酶细胞色素P450氧化酶和内切-β-1,4-葡聚糖酶活力显著增加。
——记上海志磊食用菌种植专业合作社

