腹腔镜下保留脾脏的胰体尾切除术在临床中的治疗效果
潘伟华,黄腾钦
近年来,临床研究提出脾脏功能在患者术后恢复中起到重要作用,提高人们对脾脏功能的认知水平,同时也提高保留脾脏胰体尾切除术应用率[1]。胰腺解剖位置较深,难以充分暴露,使保留脾脏的胰体尾切除术难度加大[2]。也有研究提出将腹腔镜应用于胰体尾切除术中,既能解决暴露困难的问题,又能提高保留脾脏胰体尾切除术的操作便捷性[3]。但是,关于是否保留脾脏对胰体尾病变患者术后的影响,许多研究抱有不同看法,仍未得到统一结论。基于此,本研究对在腹腔镜下保留胰脏的胰体尾切除术治疗胰体尾病变中的临床效果进行观察,报道如下。
1 资料与方法
1.1 临床资料 回顾性分析2018年8月-2020年9月龙岩市第二医院行胰体尾切除术的胰体尾病变患者58例为研究对象,根据患者不同治疗方法分为保留组28例和未保留组30例。保留组男15例,女13例;年龄43~83(53.55±7.47)岁;病变直径1~6(3.63±0.47)cm;合并糖尿病13例,合并高血压12例,合并糖尿病与高血压3例。未保留组男14例,女16例;年龄40~82(53.24±7.23)岁;病变直径1~6(3.52±0.39)cm;合并糖尿病14例,合并高血压13例,合并糖尿病与高血压3例。2组患者临床资料比较差异无统计学意义(P>0.05),具有可比性。本研究已获得医院医学伦理委员会审核批准,患者及家属知晓研究内容并签署知情同意书。
1.2 纳入及排除标准 纳入标准:确定胰体尾实性占位病变者;符合腹腔镜切除术指征者;术后病理组织检查显示肿瘤良性者。排除标准:既往行腹部手术者;中转开腹手术者;肿瘤晚期者;临床资料不完整者;术后随访失访者。
1.3 方法 未保留组行腹腔镜下不保留脾脏的胰体尾切除术:行气管插管及全身麻醉,患者取头高脚低位,于脐部建立腹壁操作孔,采用腹腔镜探查腹腔,并在胰腺上缘寻找和夹闭脾动脉,于胰腺后方建立隧道,病灶近端2 cm处使用切割闭合器切除胰腺且连同脾静脉离断,游离脾周韧带,顺时针和逆时针切除胰体尾与脾脏,将引流管分别置于脾窝、胰腺断端。术后,待患者清醒,拔除尿管与胃管,采用头孢菌素类抗生素抗感染,同时补液治疗,静脉泵入生长抑素,控制血糖、血压;术后3 d引流液淀粉酶明显减少,引流液无浑浊,腹部CT未见积液,符合拔除引流管指征。
保留组行腹腔镜下保留脾脏的胰体尾切除术:麻醉和体位与未保留组一致。首先,建立切口10 mm于脐部,气腹针穿刺建立气腹,腹腔镜倾斜30°置入腹腔探查,做切口(12 mm)于左锁骨中线肋下5 cm,连线剑突和脐,建立切口(5 mm)于中点。其次,超声刀离断脾结肠韧带、脾胃韧带、胃结肠韧带,充分暴露胰腺体尾部,超声定位肿块位置及周围组织,解剖脾动脉,切除胰腺下缘腹膜,分离脾静脉,如无法分离,结扎脾动脉、脾静脉,离断胰体部,提起远端胰腺,夹闭脾动静脉,切除远端胰腺。操作中发生皮血管损伤出血,应及时用纱布条压迫止血,阻断动静脉损伤部位远近段血供,减少出血量,再用可吸收缝合线妥善缝合出血点;若无法分辨出血血管,应切断血管,观察脾脏颜色,若缺血影响,需切除脾脏。手术完成后,将引流管放置胰腺断端。术后处理与未保留组一致。
1.4 观察指标 (1)比较2组患者手术指标,包括手术时间、手术出血量、住院时间、肛门排气时间;(2)术后1、5 d实验室指标,采用自动生化分析仪检测2组患者白细胞计数、血小板计数、C反应蛋白,比较2组术后客观指标变化情况;(3)采用健康状况调查简表(SF-36)[4]评价2组患者术后3个月的生活质量,该调查简表包括生理健康(PCS,包含生理功能、生理职能、躯体疼痛和总体健康4个维度)和心理健康(MCS,包含情感智能、精神健康、社会功能、精力4个维度)2个方面,评分越高表示生活质量越高;(4)术后并发症发生率,包括术后出血、术后胰漏、肺部感染等。
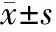
2 结 果
2.1 手术指标比较 2组患者手术时间、手术出血量、住院时间、肛门排气时间比较差异均无统计学意义(P>0.05)。见表1。
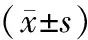
表1 2组患者手术指标比较
2.2 术后实验室指标比较 术后1、5 d保留组患者白细胞计数、C反应蛋白水平低于未保留组,血小板计数高于未保留组,差异均有统计学意义(P<0.01)。见表2。
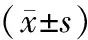
表2 2组患者术后实验室指标比较
2.3 术后生活质量评分比较 保留组术后PCS、MCS、生活质量总评分均高于未保留组,差异有统计学意义(P<0.01)。见表3。
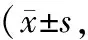
表3 2组患者术后生活质量评分比较分)
2.4 术后并发症比较 2组患者术后并发症总发生率(10.71% vs.23.34%)比较差异无统计学意义(χ2=1.616,P=0.204)。见表4。

表4 2组患者术后并发症发生情况比较 [例(%)]
3 讨 论
随着临床医学对脾脏功能的不断深入研究和认识,研究学者认为在治疗胰腺体尾部病变中应尽量保留脾脏,但也有学者对其产生质疑,认为肿瘤性质不明确时,保留脾脏可能会受到肿瘤细胞浸润,进而影响淋巴结清扫和病灶切除[5]。有研究指出,50%左右传统切除术的脾脏并未出现恶变[6]。还有研究提出,增加保留脾脏的操作程序会延长手术时间,而且胰体尾与脾动静脉血管分支较多,游离血管难度较高,切除胰体尾组织时可能会损伤血管,可增加手术风险[7]。本研究结果显示,未保留组与保留组的手术时间、手术出血量、住院时间、肛门排气时间比较差异均无统计学(P>0.05),与罗家庆等[8]研究报道具有相似性,说明保留脾脏并不会影响腹腔镜胰体尾切除术,也不会对患者术后排气和康复造成负面影响,治疗效果与未保留脾脏切除术一致。这是因为采用腹腔镜下保留脾脏的胰体尾切除术治疗不仅需要严格把控患者手术适应证,还需要手术团队的良好配合,这样可以更好地判断患者脾动静脉与病变是否相邻、能否顺利分离,同时在手术中有腹腔镜辅助,能更好观察脾动静脉分支,有利于手术医师精细、准确进行手术操作,既保证手术效率,又减少手术损伤,可显著减少手术出血量,也不会影响患者肠胃功能,有利于患者术后康复。
有研究表示,脾脏切除后,患者免疫系统出现异常,术后易出现炎性反应,引发术后感染,而保留脾脏可以最大限度减轻上述情况[9]。白细胞计数、C反应蛋白是临床监测患者炎性反应的实验室指标,可有效反映患者炎性反应程度,血小板计数变化情况还可反映患者的血小板功能亢进情况。
本研究结果显示,腹腔镜下保留脾脏胰体尾切除术治疗患者术后1、5 d白细胞计数、C反应蛋白水平低于未保留组,血小板计数高于未保留组,与厉学民等[10]研究相符。说明腹腔镜下脾脏保留的胰体尾切除术治疗胰体尾病变患者可减少对免疫系统、血液循环的影响。这是因为脾脏具有抗感染、调节免疫功能和维持血液循环的作用,保留脾脏可更好地预防患者术后感染炎性反应的发生,也能减轻门静脉血流改变,因此保留脾脏切除术患者的炎性反应与凝血功能亢进反应较轻微。结果还显示,保留脾脏患者术后生活质量总评分为(90.25±3.26)分,高于未保留脾脏患者的(68.42±3.22)分,差异显著有统计学意义(P<0.01),与蔡正华等[11]研究结果相似。说明采用腹腔镜下脾保留的胰体尾切除术治疗可有效提高患者生活质量。这是因为保留脾脏胰体尾切除术患者具有完整的脾脏功能,可维持血液系统功能稳态,能促进患者术后快速康复,减少术后不适和并发症对日常生活的影响,进而有效提高患者术后生活质量。结果显示,2组患者术后并发症总发生率(10.71% vs. 23.34%)比较差异无统计学意义,保留脾脏与未保留脾脏患者术后并发症发生率相近,说明腹腔镜下脾保留胰体尾切除术具有一定的安全性。
综上所述,腹腔镜下保留脾脏的胰体尾切除术对患者手术时间、手术出血量、术后肛门排气时间、住院时间无显著影响,可显著调节其免疫功能和凝血功能,患者术后炎性反应较轻微,血液循环恢复良好,提高患者生活质量。

