扇脉杓兰实时荧光定量PCR内参基因的筛选
段国敏 李田园 田 敏 王彩霞 张 莹
(1中国林业科学研究院亚热带林业研究所,浙江 杭州 311400;2南京林业大学风景园林学院,江苏 南京 210037)
实时荧光定量 PCR (real-time fluorescence quantitative PCR,RT-qPCR)是研究基因表达的常用方法,该技术具有耗时短、定量准确、灵敏度高、重复性好、高通量等特点[1-3],但表达分析的结果经常受不同样品RNA 提取质量、反转录效率等影响。为了消除这些偏差,有必要选择合适的内参基因进行校正和标准化[4]。理想的内参基因在不同的试验条件下都会稳定表达,其表达水平与目标基因的表达水平相近[5-7]。在前基因组时代,研究者认为维持生物体生命活动或参与生物体基本代谢的蛋白基因(ACT)、微管蛋白基因(TUB)、多聚泛素酶基因(UBC)和3-磷酸甘油醛脱氢酶基因(GAPDH)等基因产物,能在不同的细胞中或不同生理状态下稳定表达,适合作为内参基因[8-10]。然而,根据近几年的研究表明,在不同的试验条件下看家基因表达稳定性会有所变化[11-14]。因此,在特定的试验条件下有必要筛选合适的内参基因。
扇脉杓兰(Cypripedium japonicum) 为兰科(Orchidaceae)杓兰属(Cypripedium)多年生草本植物,是我国一级保护植物[15],为东亚地区特有种,其花大色艳,根状茎可入药,用于调经、祛风镇痛等[16],具有较高的观赏和药用价值。扇脉杓兰种子败育严重,自然状态下种子萌发率较低,种群生存状态较差[17-18]。随着分子生物学的迅速发展,利用分子生物学技术揭示扇脉杓兰种胚发生的关键基因并对其进行开发利用,对推动扇脉杓兰分子育种具有重要意义,但目前鲜见有关扇脉杓兰内参基因的研究,可能会影响RTqPCR 基因表达分析的准确性。
为了揭示扇脉杓兰种子败育的分子机理,本研究在前期获得扇脉杓兰不同发育时期种子的转录组数据基础上,筛选了ACT3、EF1、RPL26B、TIF3I1、SAMDC、CYP22、PP2A3、TUBB3、RPS4、UBC2、UPL1、RAN1 共12 个看家基因作为候选内参基因,并利用geNorm[19]、NormFinder[20]和BestKeeper[21]软件进行内参基因稳定性分析,旨在找出能够在扇脉杓兰不同组织和不同发育阶段的种子中稳定表达的内参基因,提高扇脉杓兰RT-qPCR 表达分析的准确性,同时为其他杓兰属植物内参基因的筛选提供理论依据。
1 材料与方法
1.1 材料
试验材料为浙江省西天目山国家级自然保护区内海拔1 120 m 处林下的野生扇脉杓兰,2019年4月对其野生居群进行人工授粉后,分别采取扇脉杓兰幼根、茎、叶、唇瓣以及5 个不同发育时期的果实(授粉后0、20、40、60、80 d),用小刀沿果实纵向切开,用刀背将胎座上正在发育的种子迅速刮到冻存管。每个样品设3次生物学重复,将冻存管中的样品迅速放入液氮,置于-80℃冰箱备用。
1.2 总RNA 的提取及cDNA 合成
采用DP441 RNAprep Pure 多糖多酚植物总RNA提取试剂盒(北京天根生化科技有限公司)提取各样品的总RNA,使用Q6000-美国Quawell 超微量可见分光光度计(北京鼎国昌盛生物技术有限责任公司)进行RNA 浓度和纯度的测定,通过1%琼脂糖凝胶电泳检测RNA 的完整性。将符合要求的RNA 用于cDNA的合成。
根据反转录试剂盒NovoStart® Plus All-in-one 1st Strand cDNA Synthesis SuperMix(上海近岸蛋白科技有限公司)的操作步骤,以各样品中1 μg 总RNA 为模板,将各样品的RNA 反转成cDNA 第一链,反应获得的产物可直接用于PCR 或-20℃储存备用。
1.3 内参基因的选择及RT-qPCR 引物的设计
根据本研究前期对扇脉杓兰不同发育时期种子的转录组测序结果,选取ACT3、EF1、RPL26B、TIF3I1、SAMDC、CYP22、PP2A3、TUBB3、RPS4、UBC2、UPL1、RAN1 基因作为候选内参基因。根据RT-qPCR 引物设计原则,利用Primer 3.0 分别对这12 个内参基因进行引物设计。所有引物均由杭州有康生物技术有限公司合成。
1.4 引物特异性检测
以各个样品等量混匀的cDNA 为模板进行PCR 扩增。反应体系为25 μL,包括2 ×Taq Master Mix 12.5 μL、上下游引物各1 μL、模板1 μL、ddH2O 9.5 μL。反应程序:94℃预变性90 s;94℃变性20 s,57℃退火20 s,72℃以每60 s 延伸1 kb,共30 个循环;72℃延伸5 min。用1.5%琼脂糖凝胶电泳检测扩增产物的特异性。
1.5 RT-qPCR 及扩增效率检测
将各样品的cDNA 等量混匀后,稀释10 倍作为模板,用上海近岸蛋白科技有限公司的NovoStart®SYBR qPCR SuperMix Plus 荧光定量试剂盒以及实时荧光定量PCR 仪进行RT-qPCR 试验。反应体系为20 μL,包括2×NovoStart® SYBR qPCR SuperMix Plus 10 μL、上下游引物各1 μL、模板1 μL、ROX 0.4 μL、Rnase Free Water 6.6 μL。按照两步法进行PCR 扩增,每个样品3 次技术性重复。扩增程序:95℃预变性1 min;95℃变性20 s,60℃退火30 s,共40 个循环;65~95℃溶解曲线分析。
将等量混匀的cDNA 稀释成5 个浓度梯度,以10倍稀释,稀释后的浓度分别为10-1、100-1、1 000-1、10 000-1、100 000-1,用不同浓度的cDNA 为模板进行RT-qPCR,制作标准曲线,并利用E =(10-1/slope-1)×100%计算候选内参基因引物的扩增效率。用R2估测标准曲线回归方程的可靠程度。
1.6 内参基因的RT-qPCR 扩增与数据处理和分析
用稀释10 倍的各样品混合物cDNA 为模板,对12个内参基因进行RT-qPCR 扩增,通过统计各内参基因在不同组织和不同发育时期种子的Ct 值来检测各内参基 因 的 表 达 量。利 用 geNorm、 NormFinde 和BestKeeper 3 个软件分别对12 个候选内参基因在扇脉杓兰不同组织和不同发育时期的种子中表达的稳定性进行分析,筛选表达相对稳定的内参基因。
1.7 内参基因稳定性验证
为进一步验证所筛选内参基因的稳定性,在不同发育时期种子中,用稳定性较好的内参基因对2 个目的基因SERK2 和ASK1 进行相对表达量分析。
2 结果与分析
2.1 RNA 样品质量的检测
检测所有样品RNA 浓度和纯度发现,所测样品的A260/A280 均在2.0 左右。1%琼脂糖凝胶电泳显示(图1),扇脉杓兰每个组织的RNA 电泳图谱清晰,且28S rRNA 比18S rRNA 的亮度高。表明所提取的RNA 纯度高、完整性好,可用于后续试验。
2.2 引物特异性和扩增效率检测
根据扇脉杓兰转录组的测序结果,在NCBI 对12个候选内参基因以及2 个目的基因的序列进行TBLASTX 分析,结果如表1 所示,这些基因与小兰屿蝴蝶兰[Phalaenopsis equestris(Schauer) Rchb. f.]中相关同源基因有很高的相似性和一致性。如TUBB3 的序列与小兰屿蝴蝶兰同源基因XP_020586417 的相似性高达100%、一致性为98.36%,这些基因中序列相似性最低的是RAN1(71%),但RAN1 序列一致性最高,达98.84%。其他10 个候选基因与相关基因的相似性、一致性分别为88%~99%、80.43%~97.61%。
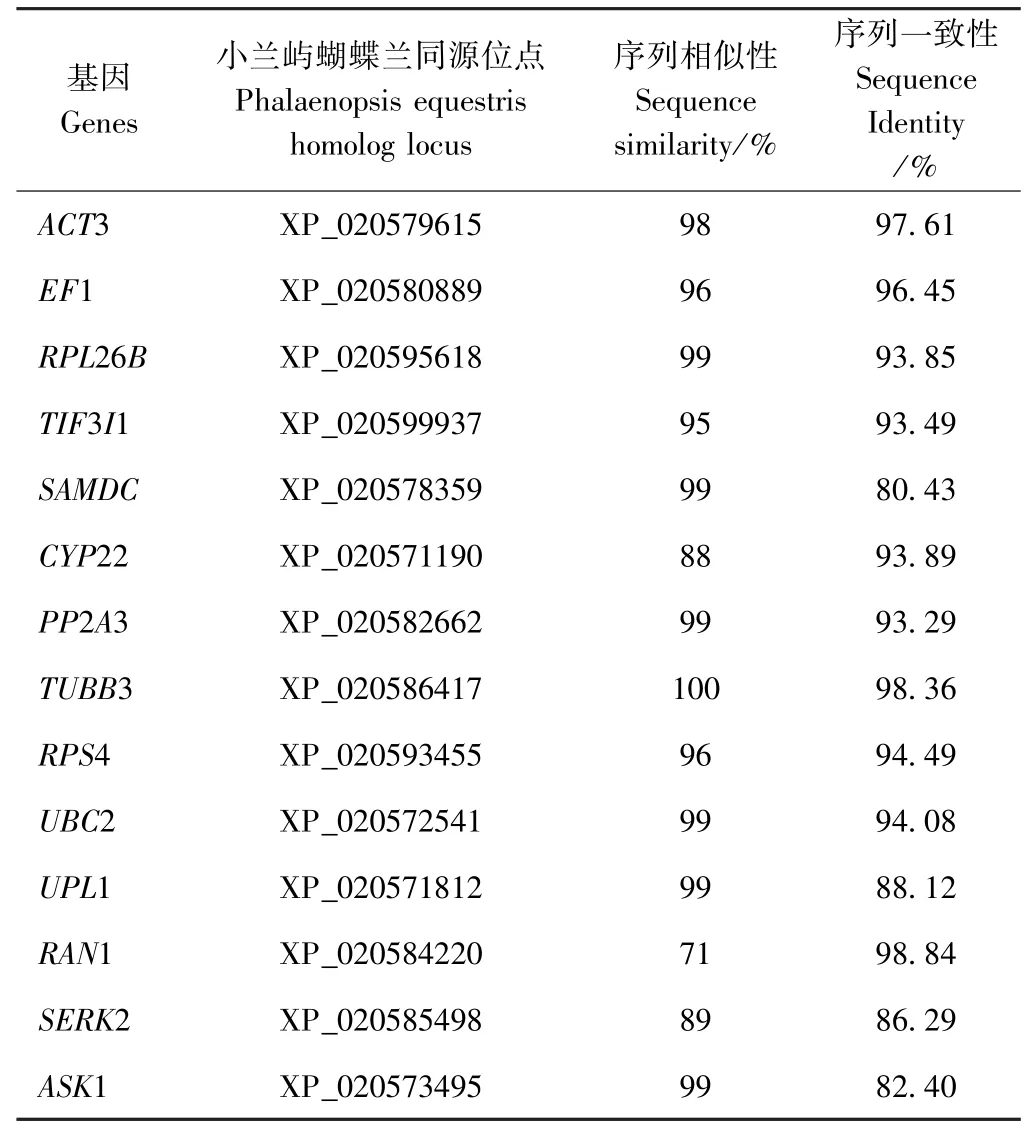
表1 扇脉杓兰候选内参基因和目的基因的比对信息Table 1 Description of candidate reference genes and target gene for RT-qPCR in C. japonicum
以9 份材料等量混匀的cDNA 为模板,进行RTqPCR 分析。1.5%琼脂糖凝胶电泳结果显示(图2),14个基因的扩增产物条带单一,与预期结果大小一致,不存在引物二聚体,且候选内参基因引物溶解曲线只有一条主峰,没有其他杂峰的出现(图3),表明引物特异性好。应用标椎曲线法对引物扩增效率的分析如表2 所示,扩增效率为95.07%~108.55%,其中,PP2A3 的扩增效率 最 低(95.07%),TIF3I1的扩增效率最高(108.55%),且相关系数R2在0.988 5~0.999 9 之间。

图2 候选内参基因PCR 扩增产物电泳检测Fig.2 Electrophoresis of the PCR products of candidate reference genes
2.3 候选内参基因的Ct 值
Ct 值用于候选内参基因稳定性表达分析,由图4可知12 个候选内参基因Ct 值平均值在20 ~30 之间,其中EF1 的平均Ct 值最小,为23.063 5,平均表达水平最高;UPL1 的平均Ct 值最高,其平均表达水平最低;其他各候选内参基因的平均Ct 值在23.063 5 ~25.378 0 之间,表达水平相差不大。
2.4 内参基因的稳定性分析
2.4.1 geNorm 分析 geNorm 程序是根据计算所得M 值来表示候选内参基因表达稳定性,M 值越小,候选内参基因的稳定性越好[22]。由图5 可知,在不同试验条件下,候选内参基因的M 值均在1.5 以下,说明这些基因表达相对稳定,在以全部样品为研究材料时,UBC2 和UPL1 的M 值最小,表现出最高的稳定性,其次为TUBB3 和TIF3I1,而EF1 的M 值最高,表达稳定性最低。在不同组织样品中,EF1、RPL26B稳定性较好。当以不同发育时期的种子为研究对象时,TUBB3 和SAMDC的稳定性最佳。不同组织和不同发育时期的种子样品中稳定性最低的基因分别为SAMDC和ACT3。geNorm 软件分析结果表明在不同试验条件下候选内参基因表达的稳定性存在明显差别。
此外,geNorm 还根据候选内参基因标准化因子的配对差异分析(Vn/n+1)得到内参基因的最佳数目,软件默认Vn/n+1=0.15,当Vn/n+1<0.15 时表明n 个内参基因已经稳定,没有必要引入第n+1 个基因[22]。如图6 所示,在以全部样品为材料时,V4/5=0.115,表明分析不同组织和发育时期种子需要引入4 个内参基因进行校正,即UBC2、UPL1、TUBB3、TIF3I1。对不同组织进行分析时,V2/3=0.09,表明内参基因的最佳组合数目为2 个,无需引入第3 个内参基因进行标准化。以不同发育阶段种子为对象时,V2/3=0.138, 2 个内参基因就能够满足其标准化。
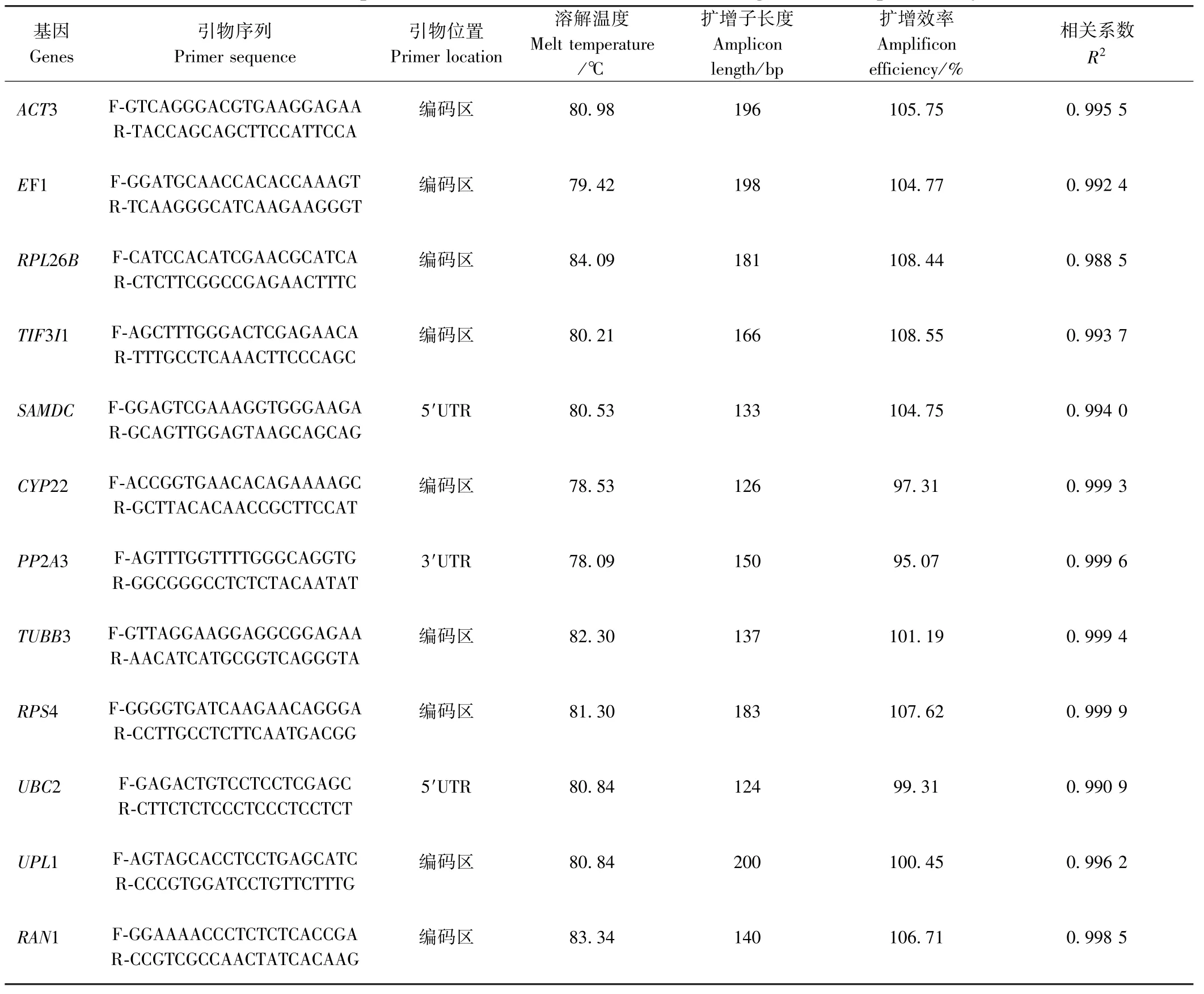
表2 RT-qPCR 分析中候选内参基因相关参数Table 2 Related parameters of candidate internal reference genes in RT-qPCR analysis
2.4.2 NormFinder 分析 NormFinder 软件基于组内方差和组间方差,根据候选基因的表达稳定值选出稳定性最好的基因,表达稳定值越小基因越稳定。由表3 可知,TIF3I1 和CYP22 在全部样品和不同发育时期的种子中表达稳定性最佳,稳定值分别为0.203、0.322 和0.214、0.133。以不同组织为材料时,UBC2和PP2A3 最稳定,稳定值为0.151、0.178。在三组数据中,稳定值最高的基因分别是EF1、SAMDC、ACT3,表明他们的表达稳定性低。其他候选内参基因在NormFinder 软件中稳定性排名与geNorm 软件的结果相似。
2.4.3 BestKeeper 分析 BestKeeper 程序通过计算样品Ct 值的标准差(SD)、变异系数(CV)和基因间相关系数(r)来判断内参基因的稳定性,相关系数越大、标准差和变异系数越小,表达越稳定[8]。该程序以SD =1 为临界值,当SD>1 时表明不适合做内参基因,反之则表示基因的表达稳定性好。BestKeeper 软件只能对10 个内参基因进行比较,因此本试验基于geNorm、NormFinder 程序对12 个候选内参基因的筛选结果,选取稳定性较好的10 个候选内参基因用于BestKeeper程序分析,结果如表4 所示。CYP22、TUBB3、RPS4、UBC2 在9 个试验样品中能够稳定表达,且CYP22 稳定性最好。在4 个不同组织中内参基因的稳定性从高到低依次为RAN1、PP2A3、CYP22、TIF3I1、RPS4、EF1、UBC2、UPL1、RPL26B。在5 个不同发育时期的种子中UBC2、TUBB3、SAMDC基因最稳定。其他候选内参基因的SD 均大于1,不适合做内参基因。
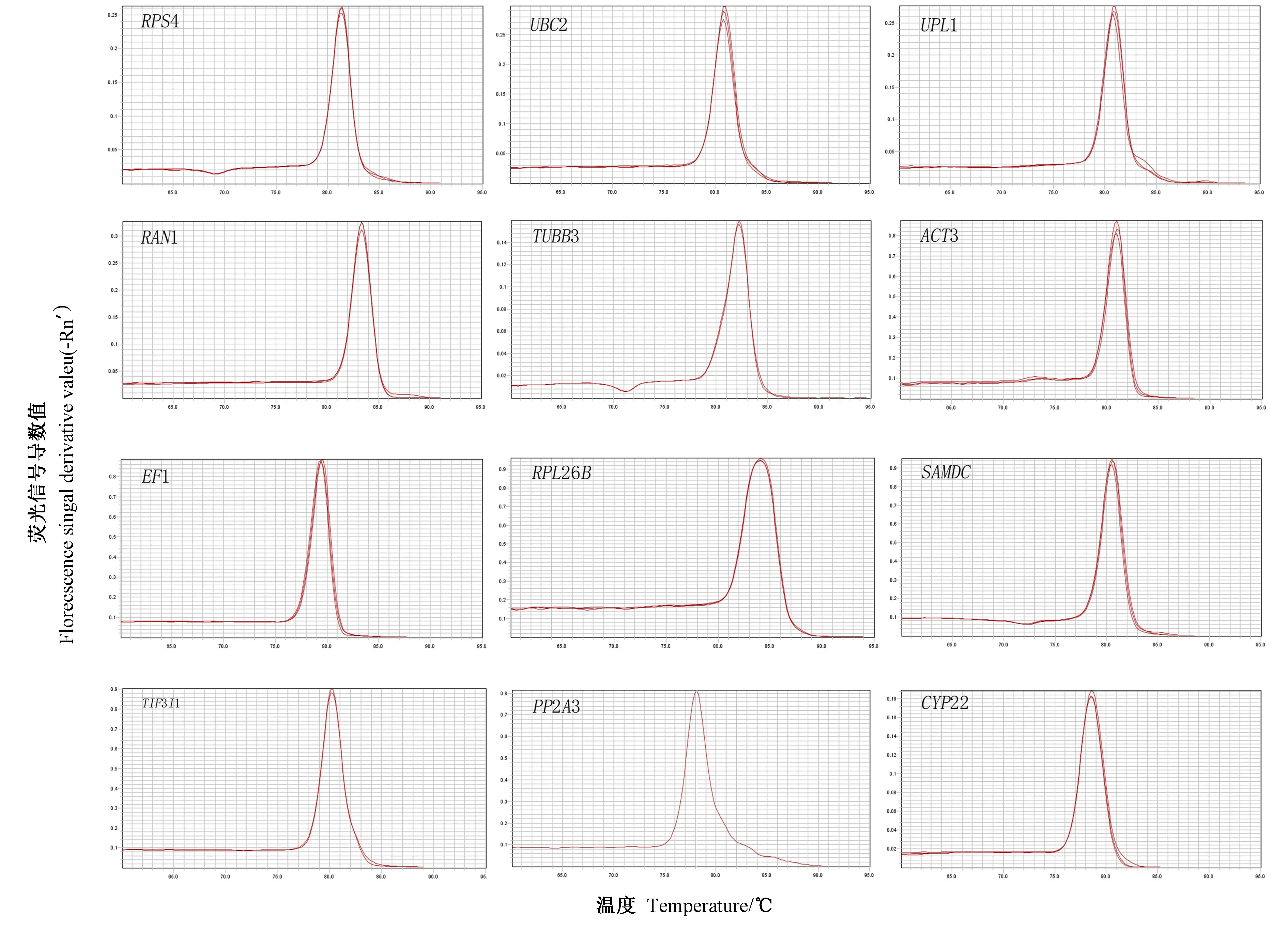
图3 候选内参基因PCR 产物的溶解曲线Fig.3 The melting curve of the candidate reference gene
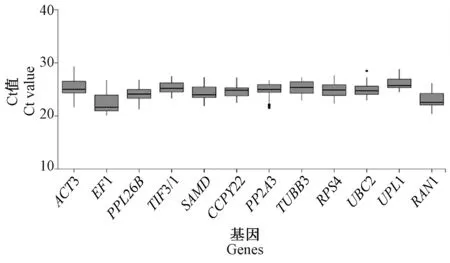
图4 候选内参基因的Ct 值Fig.4 Raw Ct values for candidate reference genes in all data sets form RT-qPCR
BestKeeper 分析结果与geNorm 和Normfinder 分析结果差异明显,利用Excel 对3 个软件分析的稳定内参基因进行几何平均数的排名(表5)。在全部样品中内参基因稳定性排序为CYP22、UBC2、TIF3I1、TUBB3;不同组织中基因稳定性从高到低排名为PP2A3、TIF3I1、RAN1、UBC2、RPS4、EF1、RPL26B、UPL1、CYP22;以不同发育时期的种子为材料时,最稳定的内参基因的排序为TUBB3、UBC2、SAMDC。根据geNorm 软件分析,在全部样品中最适内参基因为4个,不同组织和发育时期的最适内参基因均为2 个,因此3 组数据最稳定内参基因分别为CYP22、UBC2、TUBB3、RPS4;PP2A3、TIF3I1;TUBB3、UBC2。
2.4.4 内参基因稳定性验证 以胚胎发生过程中发挥重要作用的SERK2 和ASK1 基因为目的基因,通过在不同发育时期的种子中筛选出的稳定内参基因UBC2 和TUBB3 以及不稳定的ACT3 基因对目的基因进行相对表达量的计算,进一步验证所筛选的内参基因的稳定性,结果如图7 所示。以UBC2 和TUBB3 及其组合基因作为内参基因时,ASK1 和SERK2 的相对表达变化趋势相一致,而以稳定性较差的ACT3 基因作为内参基因时,ASK1 和SERK2 的相对表达发生了改变。由此可知,不合适的内参基因会导致目的基因表达水平有偏差。
3 讨论

图5 利用geNorm 软件分析内参基因的平均表达稳定值(M)Fig.5 Average expression stability value(M)of reference genes evaluated by geNorm

图6 通过geNorm 软件分析内参基因的配对变异值(V)Fig.6 Pairwise variation(Ⅴ)of reference genes generated by geNorm

表3 NormFinder 程序对候选内参基因稳定性的排序Table 3 Candidate reference genes ranked by NormFinder
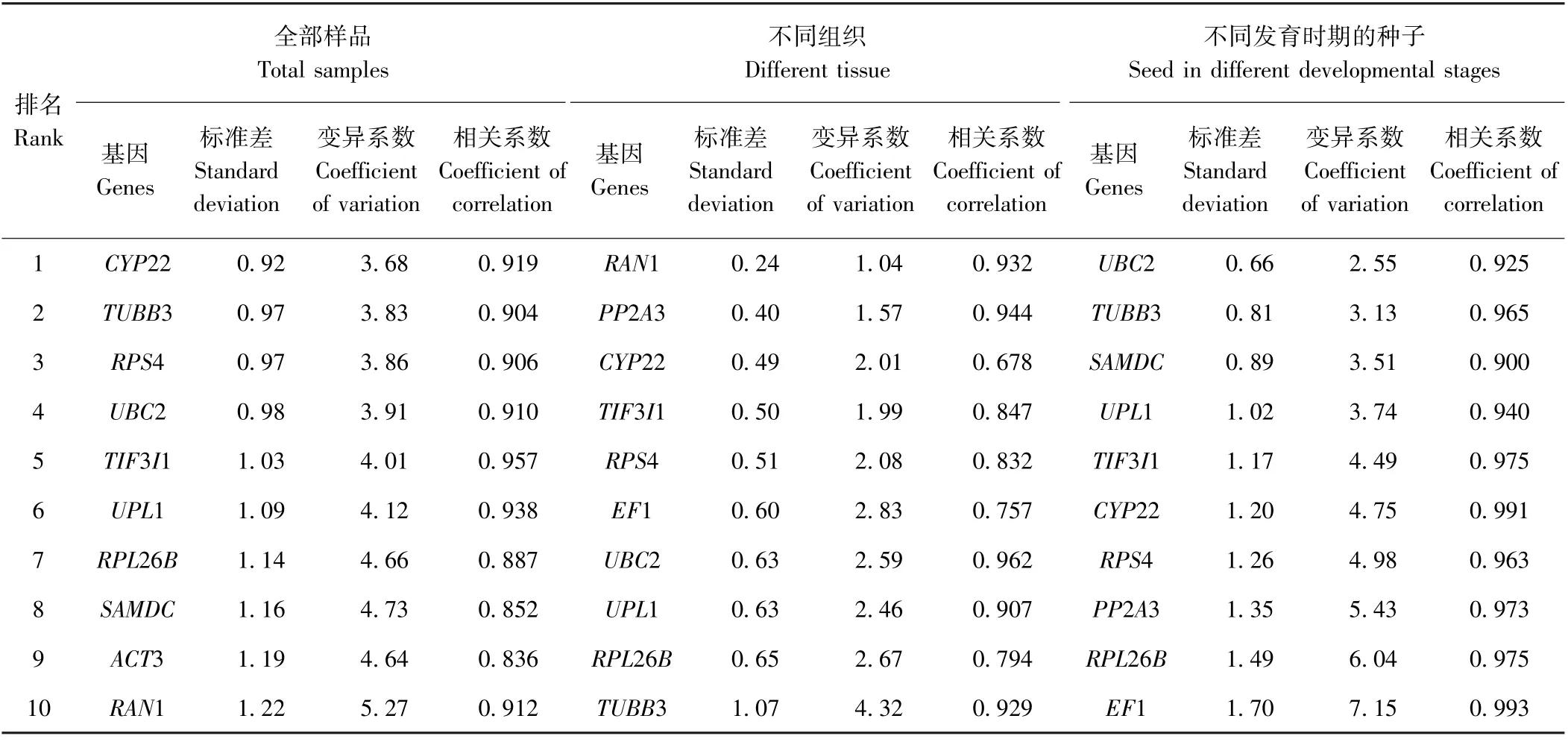
表4 BestKeeper 程序对候选内参基因的稳定性排序Table 4 Candidate reference genes ranked by BestKeeper
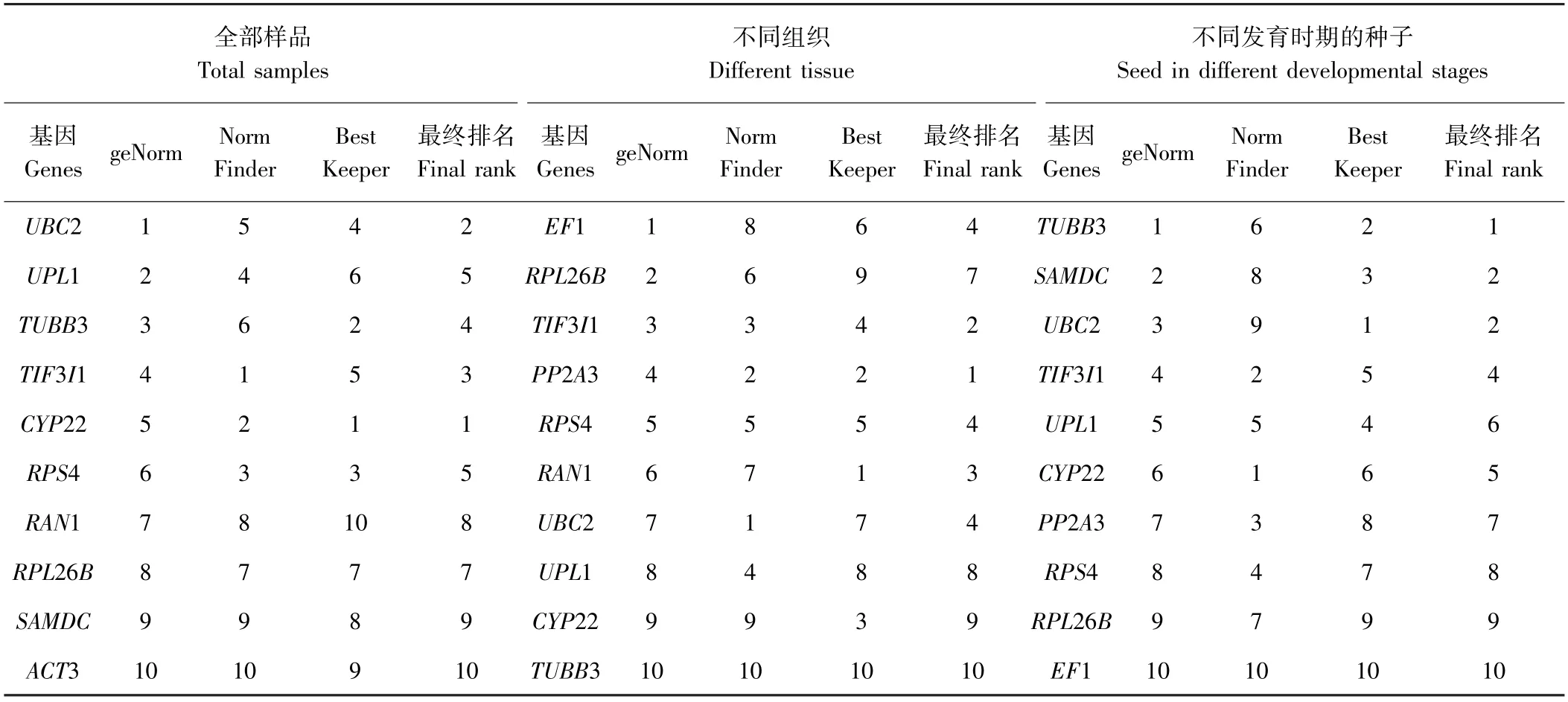
表5 3 种分析软件的总分排名Table 5 The rank of total score by three analysis software
目前已有关于植物不同组织和发育时期内参基因筛选的研究报道。如张岗等[23]筛选铁皮石斛(Dendrobium officinaleKimura et Migo)不同组织最适内参基因为EF-1α和18SrRNA。李晗等[24]在羽衣甘蓝(Brassica oleraceavar. acephala DC.)的不同组织和不同发育时期柱头中发现,Tub-α6 在不同组织中稳定表达,在不同发育时期的柱头中,ACT稳定表达。刘洪峰等[25]在牡丹(Paeonia suffruticosaAndr.)不同发育阶段种子和花瓣组织内参基因的筛选中发现,RPS9 和PUF1639 在不同发育阶段种子中表达最稳定。本研究中,PP2A3、TIF3I1 基因在不同组织中表达最稳定,以不同发育时期的种子为研究对象时,TUBB3、UBC2基因表达最稳定,这与上述已有研究结果不一致,这可能是由于试验样品种类和方法等不同造成的最稳定内参基因的不同。

图7 ASK1 和SERK2 的相对表达量Fig.7 Relative expression levels of ASK1 and SERK2
根据内参基因在3 个软件中的综合排名得出,以全部样品为材料时,CYP22、UBC2、TIF3I1、RPS4 和TUBB3 表达稳定性最好,PP2A3、TIF3I1 基因在不同组织中表达最稳定;以不同发育时期的种子为研究对象时,TUBB3 和UBC2 基因表达最稳定。由此可见,有必要针对不同的试验条件和材料选择不同的内参基因。林榕燕等[26]对“黄金小神童”花器官不同部位和不同杂交兰(Cymbidium hybrid)品种叶片的研究发现,ChUBQ、ChEF-1α、ChTUB、ChACT及ChUBQ和ChEF-1α基因组合可作为内参基因,这与扇脉杓兰不同组织的内参基因存在差异,Li 等[27]发现ACT在水稻种子和不同组织中均能稳定表达,马璐琳等[28]关于西南鸢尾(Iris bulleyanaDykes)和白花变型西南鸢尾(Ⅰ.bulleyanaDykes f.albaY. T. Zhao)花蕾组织的研究发现,最稳定的内参基因为ACT,但其在扇脉杓兰种子和不同组织中稳定性较差。这说明不同物种和不同组织器官中内参基因不存在通用性。
通过3 个软件对候选内参基因在全部样品、不同组织和不同发育时期种子的表达稳定性分析结果得出,候选内参基因在geNorm 和NormFinder 分析软件中排名相似,但BestKeeper 分析结果与geNorm 和NormFinder 分析结果存在明显差异,这与蒋婷婷等[29]对石蒜属(Lycoris)不同组织、不同花发育期和不同杂交种的幼鳞茎进行最适内参基因筛选的分析结果一致,可能是软件算法不同导致的内参基因排序的不同。如BestKeeper 中排名第2 的TUBB3,在geNorm 和NormFinder 中排名第3 和第6,其稳定值符合内参基因的要求,也可作为内参基因。因此,需要进一步验证排名靠前内参基因的稳定性。
研究表明,单一内参基因可能对试验结果有影响,一般选择2 个或多个基因作为内参基因[30-31],这有助于调整系统偏差,更有利于得到准确的基因表达定量结果[32]。Park 等[33]对在胁迫作用下的4 种番薯[Ipomoea batatas(L.)Lam.]品种进行候选内参基因的筛选时,使用内参基因ARF、ARF和COX组合以及不稳定内参基因TUB分别对IbLEA14 和swpa2 基因进行表达验证,结果显示单个最佳内参ARF与ARF和COX组合的表达水平有微小差异,而以TUB为内参基因的表达水平则呈现相反的结果。本研究对目的基因ASK1、SERK2 在不同发育时期的种子中进行表达分析,发现利用2 个内参基因在单独定量及其组合定量方面差异较小,表明利用2 个内参基因组合进行基因表达定量分析完全可行。
4 结论
本研究共选取12 个候选内参基因,研究其在扇脉杓兰不同组织和不同发育时期种子的表达情况,分析了各候选内参基因的稳定性。结果表明,12 个候选内参基因在不同组织和不同发育时期种子中均有表达,但表达量存在差异,在以全部样品为材料时,CYP22、UBC2、TUBB3、RPS4 表达稳定性好;以不同组织为研究对象时,PP2A3、TIF3I1 表达最稳定;以不同发育时期的种子为材料时,TUBB3、UBC2 表达最稳定。随着分子生物学的迅速发展,可以借助全基因组测序来探究更多未知且恒定表达的内参基因。本研究结果不仅提高了扇脉杓兰基因表达分析的准确性,也为其他杓兰属植物内参基因的筛选提供了理论参考。

