毛竹PheDof2转录因子克隆及表达分析
刘 俊 程占超 郑慧芳 蔡苗苗 彭立鑫 白羽聪 宋华建 高 健
(1 国际竹藤中心/国家林业和草原局竹藤科学与技术重点开放实验室, 北京 100102;2河南中医药大学/中医药科学院,河南 郑州 450046)
Dof 蛋白是植物转录因子中的一个主要家族成员,属于C2C2 单锌指蛋白超家族,含有一个独特的半胱氨酸(Cys)残基的单锌指保守Dof 结构域。Dof 蛋白由一个拷贝的Dof 保守域和两个结构域(N 末端高度保守的DNA 结合结构域和C 末端转录调控域)组成[1]。Dof 蛋白在许多植物中普遍存在,是植物特有的转录调控因子,研究表明,Dof 转录因子在植物的生长发育、信号转导、碳氮代谢、种子萌发、光周期响应、非生物胁迫和激素代谢等多种生物学途径中都发挥了重要作用[2-5]。在拟南芥中,DAG1 和DAG2 参与种子的萌发[6],AtDof2.4、AtDof5.8 和AtDof5.6/HCA2 参与维管组织的发育[7]。OsDof24 和OsDof25 能够调节水稻种子中贮藏蛋白谷蛋白GluB-1 基因的表达[8]。过表达OsDof12 减少转基因水稻主枝和侧枝的数目,导致植株高度降低,叶片直立、缩短,小穗变小[9]。大量研究表明,Dof 转录因子参与植物的非生物胁迫等防御反应[10-11]。在拟南芥中,AtDof1.1 基因在茉莉酸甲酯(methyl jasmonate, MeJA)处理后,表达量上调2 ~3倍[12],AtDOF5.8 通过调控ANAC069 参与盐胁迫响应[13]。AtCDF3 基因的表达受干旱、盐、高温和脱落酸(abscisic acid, ABA)的诱导,过表达CDF3 提高了转基因拟南芥对干旱、寒冷和渗透胁迫的耐受性,诱导转基因植株提前开花,但缺失表达CDF3(cdf3-KO)则导致转基因植株抗性减弱,CDF3 可以调控细胞渗透和活性氧(reactive oxygen species, ROS)稳态相关基因表达,CDF3 通过多跨膜结构蛋白(GIGANTEA,GI)依赖和独立的方式调节应答植物中糖和氨基酸水平的变化,由此说明,拟南芥CDF3 基因在非生物胁迫中发挥着多重作用[14]。在二穗短柄草中,BdCBF1、BdCBF2和BdCBF3 通过调节下游靶基因DEHYDRIN5.1(Dhn5.1)和COR的表达,在寒冷、干旱和盐胁迫中发挥重要作用[15]。
广泛分布于热带和亚热带地区的1 250 多种竹子,经常受到环境变化的影响,在进化过程中,竹子已形成多种防御机制以适应复杂的环境[16]。毛竹(Phyllostachys edulis) 禾 本 科(Poaceae) 竹 亚 科(Bambusoideae)刚竹属(Phyllostachys),是中国特有的重要经济竹种[17]。然而,毛竹在生长过程中经常受到环境的胁迫,如干旱、高温、干冷等,严重影响其生长、分布,以及冬笋的质量和产量[18-20]。目前,关于毛竹Dof基因的报道较少,先前研究表明,PheDofs参与毛竹非生物胁迫响应[21-23],但调控机制尚不清楚。因此,本研究以毛竹cDNA 为材料,从毛竹中克隆得到PheDof2 基因,在生物信息学分析的基础上,分析该基因在干旱、ABA 处理条件下的表达模式,初步鉴定PheDof2 的功能,旨在为毛竹抗性育种提供候选基因。
1 材料与方法
1.1 材料与试剂
毛竹种子采自广西省桂林市大境县(110°17′~110°47′E,25°04′~25°48′N),盆栽于长25 cm、宽15 cm 塑料花盆中。栽培基质为蛭石∶腐殖土∶花园土(1 ∶1 ∶1),置于光照恒温培养箱中,培养温度白天25℃,夜晚18℃,光周期为16 h 光/8 h 暗,相对湿度80%,营养液浇灌培养至3 个月。
TRIZOL、乙醇、氯仿、异丙醇、T4 DNA 连接酶、荧光定量试剂(Promega 公司,美国);LATaq酶、反转录试剂盒(TaKaRa 公司,日本);胶回收试剂盒(QIAGEN公司,德国);RNA 小量提取试剂盒(AXYGEN 公司,美国)。
1.2 目的基因克隆
从毛竹基因组数据库中获得PheDof2 基因的编码序列(coding sequence, CDS),设计特异性引物(表1),并在引物的上游和下游分别添加KpnⅠ和SalⅠ酶切位点,以毛竹cDNA 为模板,利用特异引物PheDof2-F-Kpn Ⅰ和PheDof2-R-SalⅠ,反转录PCR(reverse transcription PCR, RT-PCR)扩增目的基因,经过琼脂糖凝胶电泳分离,溴化乙锭(ethidium bromide,EB)显色,通过胶回收,纯化目的基因,将纯化后的目的片段连接至pGEM-T easy 载体,利用热激转化法转入DH5α 大肠杆菌(Escherichia coli),通过蓝白斑筛选,获得阳性克隆,菌落经PCR 检测后,送至苏州金唯智生物科技有限公司测定序列。
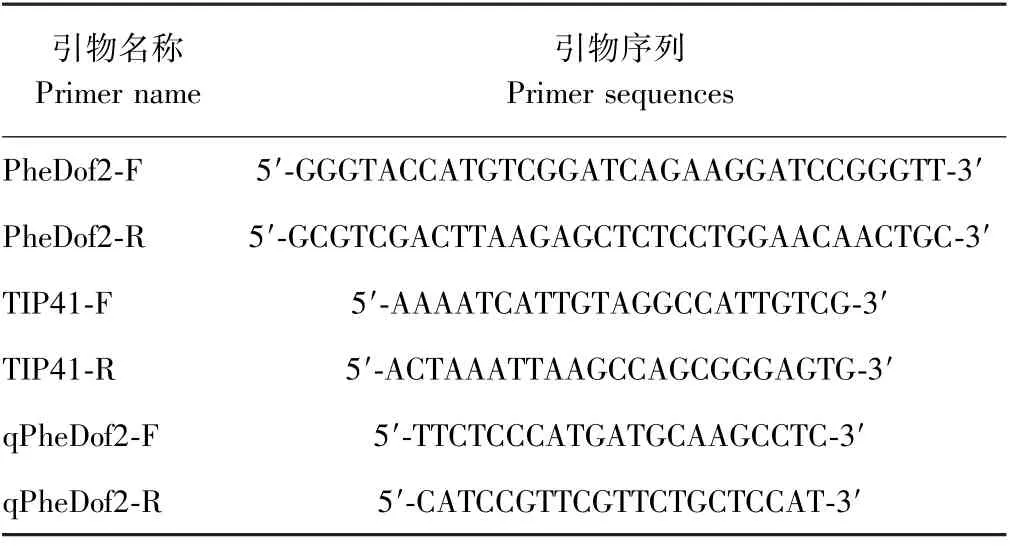
表1 引物信息Table 1 Primers information
1.3 生物信息学分析
采用 Protparam ( http:/ /web. expasy. org/protparam/)在线分析软件预测PheDof2 蛋白的基本物理化学性质[24];通过NCBI Conserved Domain Search service 对目的基因的保守结构域进行鉴定,利用Gene Structure Display Server 软件对基因结构进行分析,用PlantCARE ( http:/ /bioinformatics. psb. ugent. be/webtools/plantcare/html/)软件对启动子序列顺式作用元件进行分析[25],通过ClustalX 1.83 进行多序列比对[26],并使用MEGA 6.0 软件的邻接法(neighborjoining,NJ)进行1 000 次重复(>50%),构建系统进化树,分析其进化关系。
1.4 胁迫处理试验
干旱处理:利用20% 聚乙二醇(polyethy lene glycol, PEG)8000 对3 个月的毛竹实生苗进行浇灌处理,分别取处理后0(对照)、1、3、6、12、24、48、72 h 的根、茎、叶片,于液氮中迅速冷冻,-80℃冷冻保存,用于后续提取RNA。ABA 处理:使用200 μmol.L-1ABA对3 个月的毛竹实生苗进行浇灌处理,在处理后0、0.5、3、6、9、12、24、48、72 h 采集叶片,液氮中迅速冷冻,-80℃冷冻保存,用于后续提取RNA。
1.5 PheDof2 表达水平检测
利 用 Roche LightCycler480 ® System, SYBR ®Premix EXTaqTMkit(美国Gene Copoeta 公司)进行实时荧光定量PCR(real-time fluorescence quantitative PCR, RT-qPCR)反应,20 μL 反应体系:2×mix 10.0 μL、正向引物/反向引物各0.5 μL、cDNA 2.0 μL、ddH2O 7.0 μL。反应程序:95℃预变性5 min;95℃变性10 s,60℃退火10 s,72℃延伸10 s,45 个循环。内参基因为TIP41[27],使用2-ΔΔCt法[28]对3 次生物学重复的数据进行分析,通过SigmaPlot 12.5 作图。
从NCBI 的Short Read Arshive (SRA)数据库中下载毛竹不同高度笋(S1:冬笋;S2:50 cm;S3:100 cm;S4:300 cm;S5:600 cm;S6:900 cm;S7:1 200 cm;CK:成熟茎)和不同花发育时期(CK:未开花叶片;F1:花芽形成期;F2:花序伸长期;F3:盛花期,F4:幼胚形成期)的转录组数据[29-30],不同组织的相对表达丰度用每百万映射中每个碱基读取数(read per ktlobase per million mapped read, RPKM)值表示,并对该数值取对数(log2)进行统计分析,基因表达图谱通过Sigma Plot 12.5 软件绘图。
2 结果与分析
2.1 PheDof2 基因克隆载体构建及结构分析
以毛竹cDNA 为模板,PheDof2-F 和PheDof2-R 为引物进行PCR 扩增,发现在1 000~2 000 bp 之间有清晰的条带(图1),测序结果显示条带长度为1 614 bp,与毛竹基因组数据库中完全符合,将其命名为PheDof2。

图1 毛竹PheDof2 基因片段电泳图Fig.1 Electrophoresis of the amplification fragment of PheDof2 gene from moso bamboo
通过ProtParam 软件分析发现,PheDof2 编码537个氨基酸,蛋白质的分子量为53.20 kDa,等电点为5.37;保守结构域分析表明,PheDof2 含有由56 个氨基酸组成的典型zf-dof 结构,属于Dof 转录因子家族成员。基因结构分析显示,PheDof2 含有两个外显子,一个内含子(图2);亚细胞定位预测表明,该基因定位在细胞核中,这与转录因子在细胞核中发挥作用的研究结果相一致。
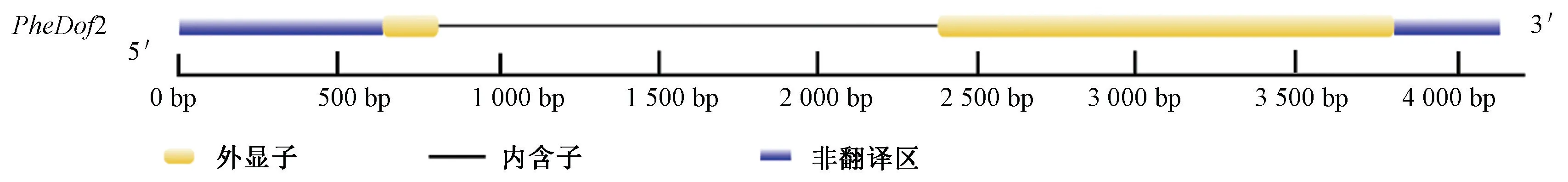
图2 PheDof2 基因结构分析Fig.2 Gene structure analysis of PheDof2
2.2 PheDof2 启动子元件分析
为了预测PheDof2 基因的功能以及为可能的调控机制提供参考依据,对PheDof2 基因编码序列ATG 上游2.0 kb 的启动子序列进行顺势作用元件分析。Plant CARE 预测结果显示,该基因启动子区域不仅含有真核生物典型的顺式调控元件及激素调控相关的元件(表2),还含有28 个其他作用元件,主要参与光应答、非生物胁迫和生长发育等生物学过程。光应答元件数量最多有11 个,如G-Box、G-box、GATA-motif、Sp1和Box 4 等,还含有多个非生物胁迫响应元件、低温响应相关元件LTR、分生组织(CAT-box)和胚乳(GCN4_motif)[31]表达相关调控元件等(表2)。由此说明,PheDof2 参与多种生物学过程,可能在毛竹非生物胁迫响应和激素调控方面发挥重要作用。
2.3 PheDof2 蛋白进化分析
利用PheDof2 的氨基酸序列,在NCBI 进行序列比对,构建PheDof2 系统进化树。由图3 可知,单子叶植物、双子叶植物、松柏植物和苔藓植物分别聚为4 个分支,PheDof2 与单子叶植物聚为同一分支,与二穗短柄草的亲缘关系最近,同源性为79.05%,与小麦、水稻、高粱、小米的同源性均在70%以上,这与物种的进化结果相一致[32]。多序列比对结果显示,PheDof2 编码的氨基酸序列与其他物种Dof 蛋白同源性较高,均含有高度保守的C2C2 单锌指结构域,即zf-dof 结构域(图4),表明PheDof2 属于Dof 转录因子家族成员。
2.4 PheDof2 基因在毛竹不同组织及不同发育阶段的表达模式
由图5 可知,PheDof2 在毛竹的根、茎和叶片中均有表达,但表达水平不同;在叶片中,PheDof2 的表达量最高,其次是根,在茎中的表达水平最低,表明PheDof2的表达具有组织特异性。在不同高度笋中,S1~S2 是毛竹笋的细胞分裂阶段,S4~S6 是笋的快速生长阶段。由图6-A 可知,PheDof2 在S1 ~S2 中的表达量较高,表明PheDof2 参与毛竹笋的生长发育,在笋细胞分裂阶段发挥主要作用;在毛竹花不同发育时期,PheDof2 在花序伸长期的表达水平最高,且花中的表达水平均高于叶片中的表达水平(图6-B),说明PheDof2 参与毛竹花的发育,主要在花序伸长期发挥作用。
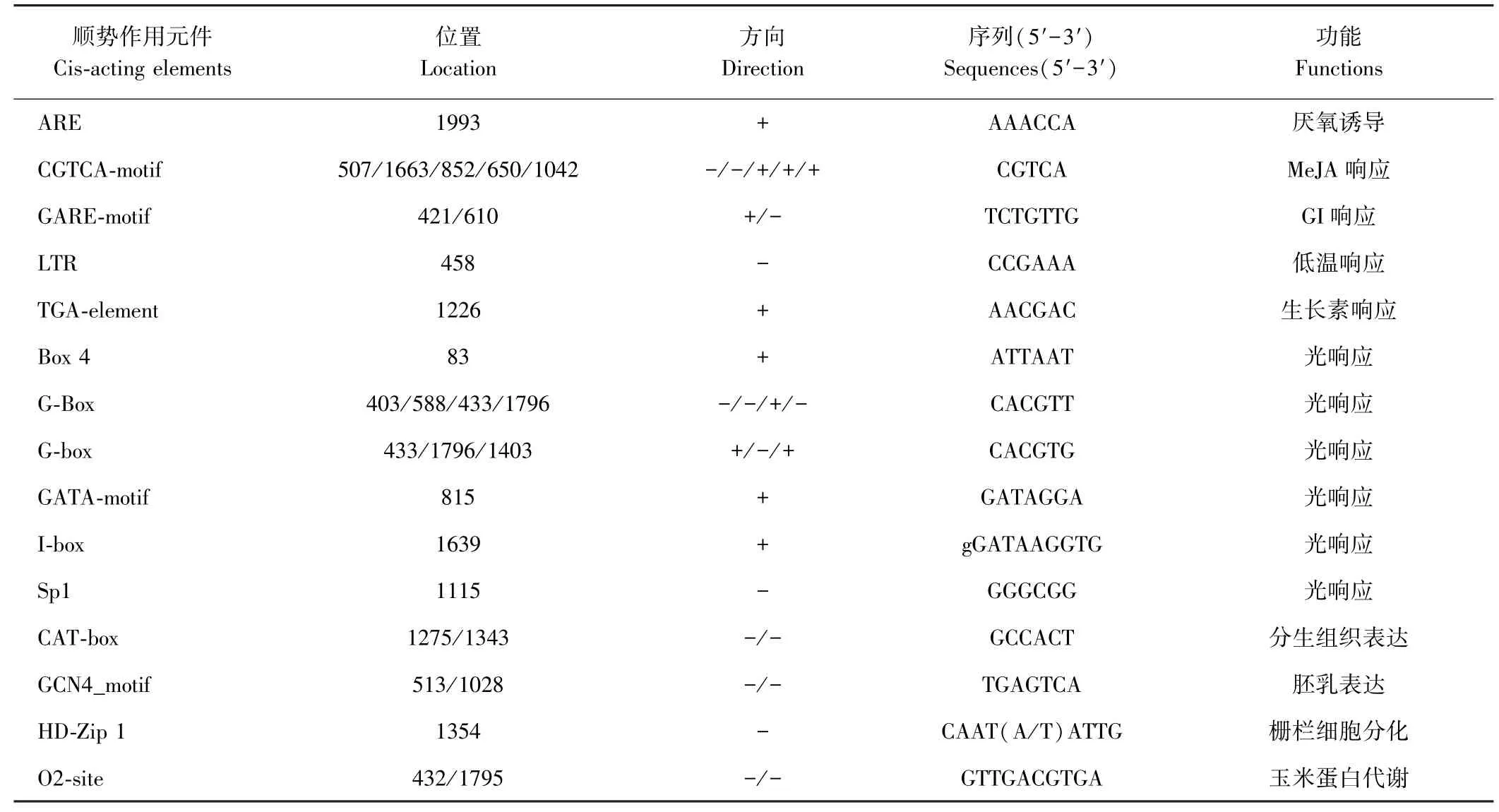
表2 Plant CARE 预测PheDof2 启动子区域顺式作用元件基本信息Table 2 Plant CARE predicts the basic information of cis-acting elements of PheDof2 promoter region
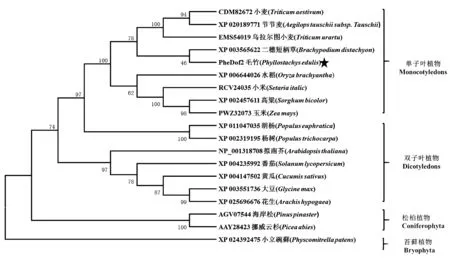
图3 PheDof2 基因编码蛋白系统进化树分析Fig.3 Phylogenetic tree analysis of amino acid sequences encoded by PheDof2
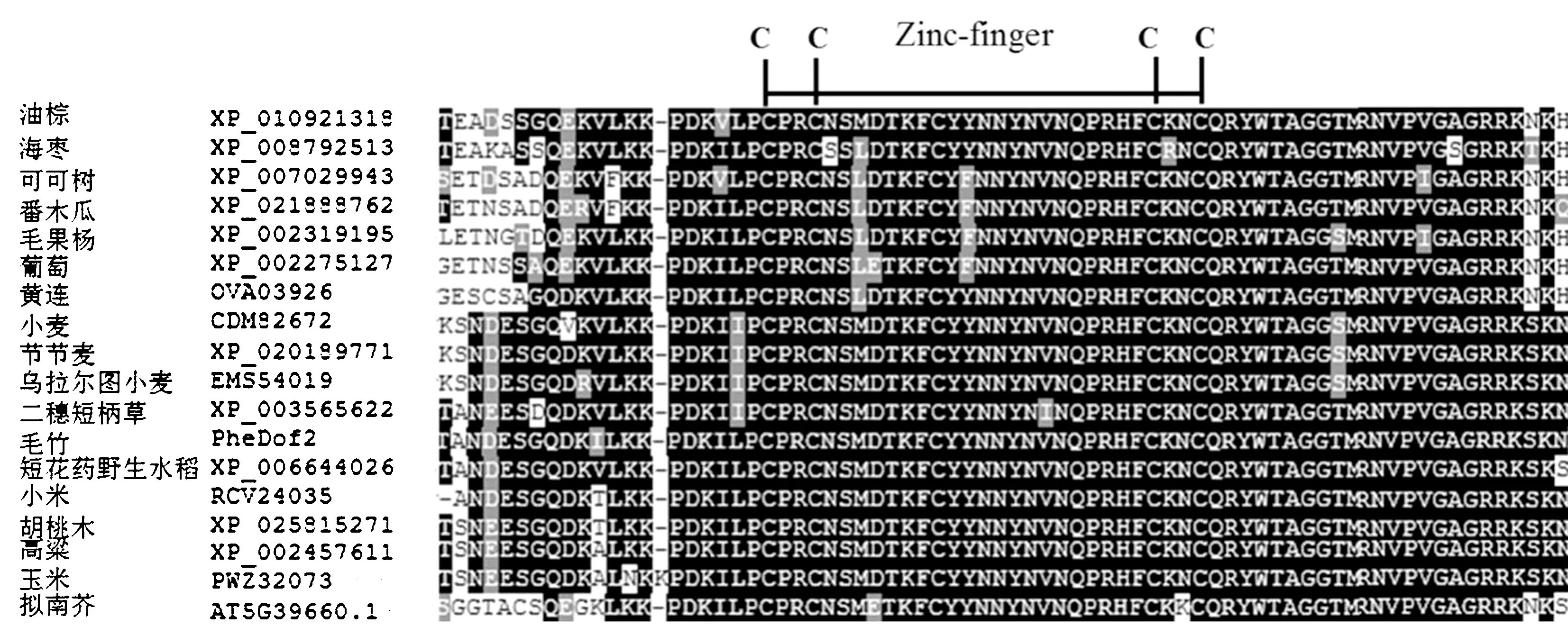
图4 毛竹PheDof2 与其他植物Dof 氨基酸序列的多重比对Fig.4 The multiple alignment of amino acid sequences of PheDof2 from moso bamboo and other plants

图5 PheDof2 在毛竹不同组织中的表达分析Fig.5 Expression analysis of PheDof2 in different tissues of moso bamboo
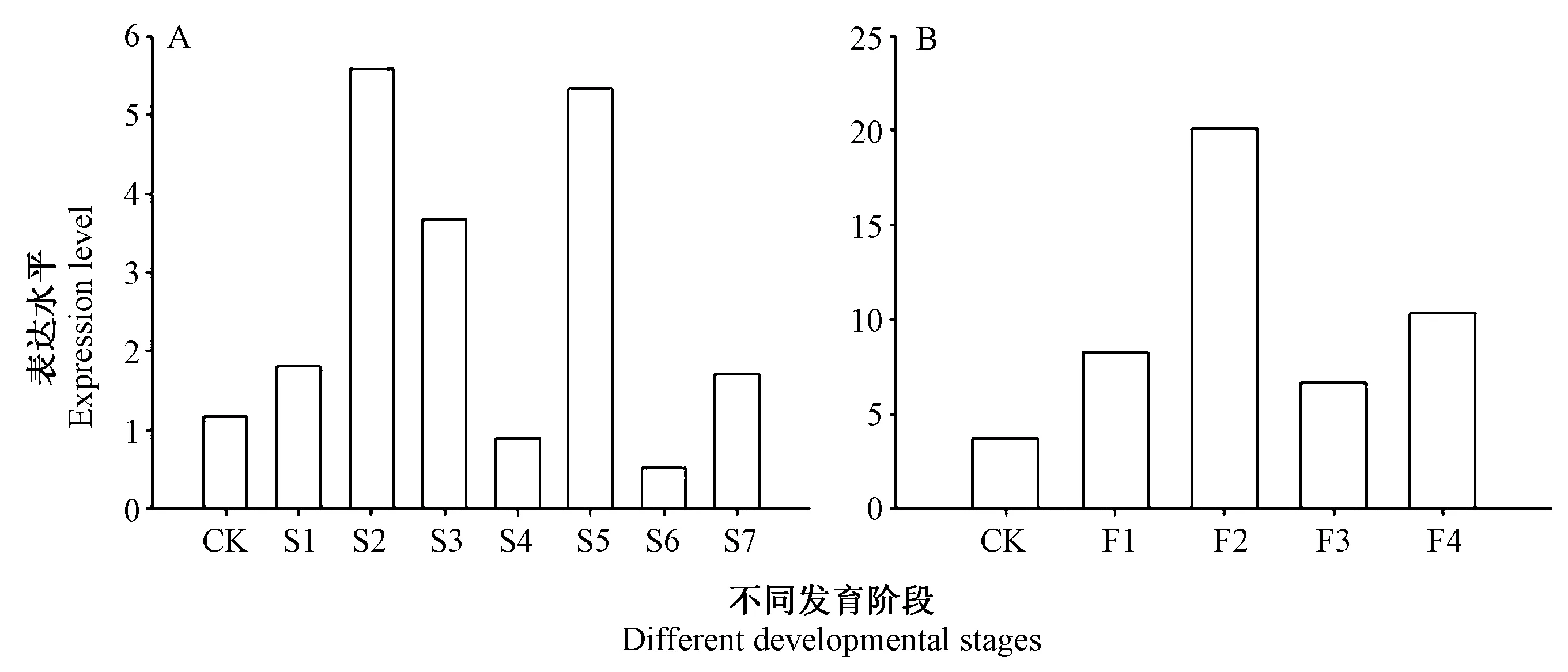
图6 PheDof2 在毛竹不同组织及不同发育阶段的表达分析Fig.6 Expression analysis of PheDof2 in different tissues and developmental stages of moso bamboo
2.5 PheDof2 基因对干旱胁迫和ABA 处理的响应
在PEG8000 干旱处理的根中,PheDof2 呈现先升高后降低,再升高的表达趋势(图7-A),PheDof2 在处理6 h 时,表达丰度达到峰值,是对照的20 倍,随后表达水平逐渐下降,但仍高于对照组,说明PheDof2 在干旱处理的根中发挥正调控作用。在毛竹的幼茎中(图7-B),PheDof2 的表达水平急剧下降,处理1 h 时,PheDof2 的表达水平降为对照0.15 倍,处理24 h 时,降为对照组的0.2 倍,随后表达水平逐渐上升。在叶片中,PheDof2 在干旱胁迫前期下调表达(图7-C),处理6 h 时,PheDof2 的表达水平降为最低值,仅为对照组的0.07 倍,处理24 h,表达水平急剧升高,为对照的1.6 倍。PheDof2 在相同处理的不同组织中具有不同的表达模式,说明PheDof2 在不同组织中可能发挥不同的功能。
在200 μmol.L-1ABA 处理的叶片中,PheDof2 基因的表达水平呈现先降低后升高的表达趋势(图8)。ABA 处理6 h 时,PheDof2 的表达水平降为最低值,仅为对照的0.027 倍,随后表达水平有所上升,在处理48 h 时,PheDof2 的表达水平达到峰值,是对照的1.6倍,由此说明PheDof2 参与ABA 激素调控。
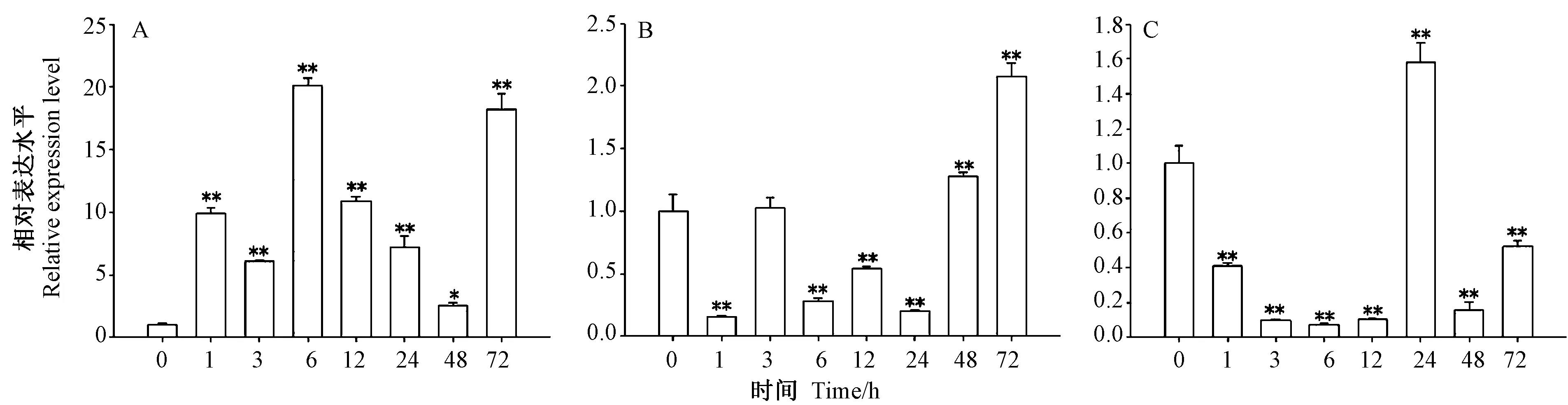
图7 干旱胁迫处理条件下PheDof2 的表达分析Fig.7 Expression analysis of PheDof2 under drought treatment

图8 ABA 处理条件下PheDof2 的表达分析Fig.8 Expression analysis of PheDof2 under ABA treatments
3 讨论
Dof 蛋白是植物体内特有的一类转录因子,参与多种生物学过程,如种子萌发、组织特异性表达、光信号响应、植物激素等。
系统进化分析显示,PheDof2 与单子叶植物聚为一枝,与二穗短柄草的亲缘关系更近,同源性为79.05%,这与物种进化关系相一致[32],推测PheDof2可能与这些蛋白具有功能相似性。在水稻中,RDD1(rice Dof daily fluctuations1)是PheDof2 的同源基因,RDD1 蛋白主要在维管组织中表达,mRDD1 过表达,增加转基因植株每穗粒数、二级枝梗数、单株粒数,RDD1 诱导水稻对NH4+、PO43-、K+、Mg+、Cl-等营养离子的有效吸收和积累,提高水稻产量[33],反义表达RDD1 导致转基因植株颗粒大小和重量减少,说明该基因与水稻生产力有关[34],推测PheDof2 可能也参与毛竹种子的形成和发育。在拟南芥中,PheDof2 的同源基因CDF2 可以与DCL1 相互作用,直接与miRNA的某些启动子结合,影响DCL1 介导的这些原始miRNA 的转录进程,说明CDF2 在转录和转录后水平上调控一系列pri-miRNAs,从而调控植物的发育[35]。推测PheDof2 在毛竹生长发育、miRNA 转录方面也可能发挥重要作用,但PheDof2 在毛竹中具体的功能还需进一步验证。
本研究显示,PheDof2 在毛竹不同高度笋和不同花发育时期均有表达,主要在笋的细胞分裂期和花发育的花序伸长期表达量较高,由此说明PheDof2 参与毛竹笋的生长和花的发育。在拟南芥中,过表达AtDOF5.4/OBP4 通过促进内循环的早期发生,抑制细胞的扩增,降低了转基因拟南芥细胞的大小和数目,导致转基因植株矮小,OBP4 作为一个负调控因子,调节拟南芥细胞的扩张和细胞周期进程[36];在水稻中,过表达OsDof12 减少转基因水稻主支和侧支的数目,降低植株高度,叶片直立变短,小穗长度变小[9],推测PheDof2 可能也参与细胞的分裂和植株的生长。Dof不仅参与植物的生长发育,而且参与开花调控,在拟南芥中,AtCDF1 通过与开花诱导因子CO和成花基因FT启动子结合,抑制CO和FT基因的转录,导致转基因拟南芥开花延迟,在光照条件下,泛素蛋白FKF1(FBOX 1)和多扩膜结构蛋白GIGANTEA(GI)形成GIFKF1 蛋白复合体,抑制AtCDF1 基因的转录,进而将AtCDF1 从CO的启动子区域解除下来,促进开花[37-38];在水稻中,OsDof12 基因通过直接或间接调节Hd3a和OsMADS14 基因的表达,诱导转基因水稻开花[39],推测PheDof2 可能也参与毛竹开花调控。
研究表明,Dof基因参与植物非生物胁迫响应,在拟南芥中,AtDof1.1 在MeJA 处理4 ~6 h 后,表达量升高2 ~3 倍[12];在番茄中,拟南芥CDFs的同源基因SlCDF1-5 参与干旱、盐、高温和冷胁迫的响应[40],在二穗短柄草中,BdCBF 是冷响应重要的调控因子,诱导一系列胁迫相关基因的表达[15]。在菊花中,CmDofs参与激素和非生物胁迫响应,但表达模式不同[41]。在胡椒中,高温和盐处理后,CaDofs呈现先升高后降低的表达趋势[42]。本研究中,在干旱处理的根中,PheDof2 基因上调表达,发挥正调控作用。ABA 处理中,PheDof2 呈现先降低后升高的趋势。毛竹中PheDof12-1 基因的表达也受干旱处理的影响,根中PheDof12-1 和PheDof2 基因在处理1 h 时,PheDof12-1 的转录水平急剧增加,为对照的70 倍[23],本研究中PheDof2 相对表达水平是对照的10 倍左右,说明PheDof2 在毛竹干旱处理的根中表达模式与PheDof12-1 基本一致,发挥正调控作用。然而,PheDof4-1 基因的表达受到了强烈的抑制,干旱处理1 h 时PheDof4-1 基因的表达水平迅速降为对照的0.02 倍,随后继续降低,说明PheDof4-1 在干旱处理根中发挥负调控作用[21],与本研究中PheDof2 呈现相反的表达趋势。由此推测,在干旱处理条件下,PheDof2 和PheDof12-1在毛竹根中可能协同参与胁迫响应。
研究显示在拟南芥中,AtCDF3 基因的表达受到ABA 处理的诱导[14],菊花CmDofs基因也参与激素(如ABA、SA 和MeJA)响应[41]。本研究中,ABA 处理6 h 时,毛竹PheDof2 的表达水平降为最低值,为对照的0.027 倍,在处理48 h,表达水平达到最大值,这与PheDof12-1 的表达模式相一致[23]。此外,PheDof2 在毛竹不同组织和不同胁迫处理中呈现不同的表达模式,说明该基因在毛竹不同组织和不同胁迫条件下发挥的作用不尽相同,这可能与基因的组织特异性和组织响应胁迫的先后顺序有关。综上表明,PheDof2 响应毛竹干旱和ABA 处理,具有组织特异性。
4 结论
本研究从毛竹中克隆得到PheDof2 基因,对其理化性质、基因结构、进化关系及顺式作用元件进行了分析。结果显示,PheDof2 基因结构简单,只含有一个内含子,两个外显子,其编码蛋白与二穗短柄草亲缘关系最近,启动子中含有多个非生物胁迫和光响应元件,PheDof2 在毛竹叶片中表达水平最高。PEG 8000 胁迫和ABA 处理结果表明,PheDof2 可能在毛竹抵御干旱胁迫中发挥重要作用,还可能参与ABA 激素的响应。本研究为探索毛竹Dof基因的功能奠定了一定的理论基础。

