垄沟集雨覆盖对旱作马铃薯块茎淀粉合成关键酶活性、基因表达及淀粉累积的影响
苏 旺 胡禄华 王 舰
(1青海大学农林科学院/青海省农林科学院/青海大学省部共建三江源生态与高原农牧业国家重点实验室/青海大学青藏高原生物技术教育部重点实验室/青海省马铃薯育种重点实验室,青海 西宁 810016;2 青海大学生态环境工程学院,青海 西宁 810016)
作为青海东部旱区的特色优势作物[1],马铃薯(Solanum tuberosumL.)以块大、整齐、淀粉含量高、退化轻等特性享誉国内外[2]。近二十年,垄沟集雨覆盖栽培可使无效、微效降水形成径流[3],叠加到沟内,且覆盖后可抑制土壤水分蒸发,促进水分下渗[4],逐渐成为青海东部旱区马铃薯生产中的主要栽培技术。
马铃薯垄沟集雨覆盖栽培的研究主要集中在土壤水分[5-6]、温度[7]、酶活性[8]、微生物种类和数量[8]、产量及水分利用效率[9-13]等方面,有关淀粉合成关键酶活性及其基因表达的研究尚鲜见。前人多从品种、氮肥的角度分析马铃薯淀粉合成关键酶活性及其变化规律,从淀粉合成相关基因功能来探讨马铃薯淀粉生物合成的分子基础,如吕文河等[14]研究表明,马铃薯高淀粉品种克新22 号的可溶性淀粉合成酶(soluble starch synthase,SSS)、颗粒结合型淀粉合成酶(granule bound starch synthase,GBSS) 及淀粉分支酶(starch branching enzyme,SBE)活性均显著高于低淀粉品种克新19 号;而杨华等[15]研究认为,低淀粉品种CY-117的 ADP-葡萄糖焦磷酸化酶 ( ADP-glucose pyrophosphorylase,AGPP)、SSS 活性显著高于高淀粉品种QS-2,且氮素主要是通过影响SSS 活性来实现对马铃薯块茎淀粉含量的调控。研究表明,抑制表达异淀粉酶ISA1/2/3 基因[16]以及过表达超氧化物歧化酶SOD、抗坏血酸过氧化物酶APX基因[17]均显著调控了马铃薯块茎淀粉生物合成过程;杨涛等[18]对可溶性淀粉合成酶SSIII基因进行了克隆及生物学分析;Yoo等[19]鉴定了SSIII基因的功能。
鉴于此,本研究以旱作马铃薯生产上大规模应用的垄沟集雨覆盖栽培模式为对象,探讨其对马铃薯块茎形成过程中淀粉合成关键酶活性、基因表达和淀粉累积的影响,分析淀粉合成关键酶活性、基因表达及淀粉累积间的相关性,旨在为青海东部旱区筛选马铃薯优质淀粉生产措施奠定理论基础。
1 材料与方法
1.1 试验材料与试验地概况
供试马铃薯品种为青薯9 号,由青海大学农林科学院提供。试验于2018年4月至9月在青海省西宁市城北区青海大学农林科学院试验基地(36.73°N,101.75°E)进行。该基地位于青藏高原东北部,海拔2 339 m,属大陆性高原半干旱气候,6—9月降水集中,占全年降水量的70%,年均降水量380 mm,年均日照时数1 939.7 h,年均气温7.6℃,年均蒸发量1 363.6 mm,无霜期180 d。试验地耕层土壤含有机质17.2 mg.kg-1,碱解氮147.1 mg.kg-1,速效磷21.0 mg.kg-1,速效钾158.9 mg.kg-1,pH 值8.1。土壤质地为栗钙土,地力水平中上等。
1.2 试验设计
采用大田小区种植,单因素随机区组排列,重复3次。设置2 种垄沟集雨覆盖栽培模式,分别为地膜垄作(M03)和全膜双垄(M02),以露地平播(M01)为对照。其中,M03 为宽窄行种植,垄宽60 cm,沟宽30 cm,垄高15 cm,窄行30 cm,宽行60 cm,选用幅宽90 cm 地膜,小区面积5.4 m×5 m =27 m2,12 行区;M02 为宽窄行种植,大垄垄宽70 cm,垄高15 cm,小垄垄宽50 cm,垄高10 cm,窄行50 cm,宽行70 cm,选用幅宽120 cm 地膜,小区面积6 m×5 m =30 m2,10 行区;M01 为等行距种植,小区面积7 m×5 m =35 m2,行距70 cm,10 行区。各小区种植密度一致,均为4.28×104株.hm-2。采用0.013 mm 厚地膜。旱作,无灌溉。播前施磷酸二胺300 kg.hm-2、尿素225 kg.hm-2、硫酸钾150 kg.hm-2,其他田间管理按照国家马铃薯品种区域试验进行。2018年4月25日整地,4月26日播种,9月27日统一收获。
在马铃薯匍匐茎顶端开始膨大至成熟收获期间,按照时间顺序依次取样,具体取样时期如下:块茎形成期后期(第一花序开始开花,S1)、块茎增长期前期(盛花期,S2)、块茎增长期后期(茎叶开始衰老,S3)、淀粉积累期中期(植株基部1/3 左右茎叶枯黄,S4)、淀粉积累期后期(植株基部2/3 左右茎叶枯黄,S5)、成熟期(植物地上部茎叶全部枯黄,S6)。各处理各重复小区内选择长势均匀的2 株进行取样,取样部位为每株马铃薯全部块茎。
实验室内,去除块茎泥土,选取大小一致的薯块,分别在顶、中、底部各取1 片0.5 cm 厚的薯片,切成0.1~0.2 cm2大小一致的颗粒,混匀,称量4.00 g,置于-80℃超低温冰箱中保存,其中,2.00 g 用于测定AGPP、SSS、GBSS、SBE 活性,2.00 g 用于测定ADP-葡萄糖焦磷酸化酶AGPase、可溶性淀粉合成酶SSII、SSIII、颗粒结合型淀粉合成酶GBSSI、淀粉分支酶SBEI、SBEII基因表达量。剩余部分用于测定马铃薯块茎总淀粉含量及直链淀粉含量。
1.3 测定项目与方法
1.3.1 淀粉合成关键酶活性 AGPP、SSS 和GBSS 粗酶液制备:取1.00 g 马铃薯块茎,碾磨成粉样,加入800 μL 提取液[终浓度为:50 mmol.L-14-羟乙基哌嗪乙磺酸(4-hydroxyethyl piperazine ethanesulfonic acid,Hepes)(pH 值7.2 ~7.4)、5 mmol.L-1乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、1 mmol.L-1二硫苏糖醇(dithiothreitol,DTT)、2 mmol.L-1KCl、1%聚乙烯吡咯烷酮40(polyvinyl pyrrolidone 40,PVP-40)],研磨成匀浆后置于离心管中,于4℃条件下10 000 r.min-1离心30 min,收集上清液作为AGPP 与SSS 活性测定的粗酶液。将离心所得沉淀用800 μL提取液洗涤后,悬浮于提取介质中,作为GBSS 活性测定的粗酶液。
SBE 粗酶液制备:取1.00 g 马铃薯块茎,加入800 μL提取液[含50 mmol.L-1Hepes-NaOH(pH 值7.5)、5 mmol.L-1EDTA、1 mmol.L-1DTT、2 mmol.L-1KCl、1% PVP-40],研磨成匀浆后置于离心管中,于4℃条件下15 000 r.min-1离心15 min,收集上清液作为SBE 活性测定的粗酶液。
参照Nakamura 等[20]的方法测定AGPP、SSS、GBSS 活性;参照李太贵等[21]和程方民等[22]的方法测定SBE 活性。
1.3.2 淀粉合成关键酶基因表达量 取-80℃超低温冰箱保存的块茎颗粒,采用Trizol 法提取RNA[23],同时,去除基因组DNA。反转录合成cDNA 第一链,20 μL反应体系及程序:RNA+水10.5 μL,OligodT(18) 2 μL,65℃加热5 min,迅速冰浴2 min,后加入5×RT buffer 4 μL,RT enzyme 1 μL, RNase-free 水0.5 μL,dNTP 2 μL,42℃孵 育80 min,70℃加 热15 min。根据NCBI 公布的基因RNA 序列,使用Premier 5.0 软件设计实时荧光定量PCR(quantitative ral-time PCR, qRT-PCR)引物(表1),并在扩增反应完成后,绘制溶解曲线,以保证引物特异性。以cDNA 为模板,Tublin1 为内参基因。使用10 μL PCR 反应体系:2×RealStar Green Power Mixture (with ROX Ⅱ) 5 μL,引物各0.4 μL,cDNA 1 μL,水3.2 μL。PCR 反应程序:95℃预变性10 min,95℃变性15 s,60℃退火60 s,72℃延伸1.5 min,40 个循环。各样品重复3 次,参照ΔCt法计算目的基因相对表达量[24]。

表1 qRT-PCR 目的基因引物Table 1 Target gene and sequence of qRT-PCR primers
1.3.3 淀粉累积
1.3.3.1 总淀粉含量测定 取部分马铃薯块茎切碎、烘干及粉碎,采用碘量法[25]测定马铃薯总淀粉含量,每份样品测定3 次,取平均值。根据公式计算淀粉含量:
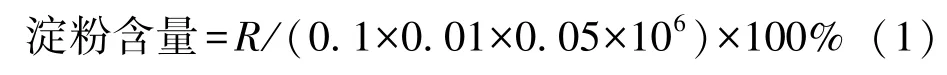
式中,R值为从标准曲线上求出的浓度。
1.3.3.2 直链淀粉含量测定 取剩余马铃薯块茎采用自然沉降法[26]提取淀粉,称2 mg 淀粉样品于烧杯中,加入0.5 mL 35%高氯酸溶液,稍加震荡,待样品完全溶解后加入8 mL 蒸馏水,混合均匀后得到混合样;另取一烧杯加入0.5 mL 35%高氯酸和8 mL 蒸馏水做空白对照。分别取样品混合样和空白对照各600 μL于2 个比色皿中,然后在比色皿中依次加入300 μL 碘液、1 800 μL 蒸馏水。混合均匀,分别于550 nm和618 nm 波长处测定其吸光度值,重复3 次。根据公式计算直链淀粉含量[27]:

式中,R=618 nm 波长处吸光度值/550 nm 吸光度值。
1.3.3.3 直/支链淀粉比 支链淀粉含量=1-直链淀粉含量;直/支链淀粉比=直链淀粉含量/支链淀粉含量。
1.4 统计方法
采用Microsoft Excel 2007 和SAS V8.0 统计软件进行数据处理和统计分析,采用Duncan 法进行样本之间的多重比较(a=0.05),采用Pearson 法进行相关性分析(a=0.05)。
2 结果与分析
2.1 淀粉合成关键酶活性
ADP 葡萄糖焦磷酸化酶(AGPP)、淀粉合成酶(SSS、GBSS)、淀粉分支酶(SBE)、淀粉去分支酶等淀粉合成关键酶相互协调、共同作用完成作物淀粉生物合成。由表2 可知,在马铃薯块茎形成过程中,各淀粉合成关键酶活性波动较大;从块茎发育全程来看,马铃薯块茎的AGPP、GBSS 活性平均表现为露地平播(M01)>地膜垄作(M03)>全膜双垄(M02),M02、M03马铃薯块茎的SSS 活性分别较M01 平均提高77.70%和22.63%(P<0.05),而M01、M02 和M03 马铃薯块茎的SBE 活性无显著差异。可见,在块茎形成过程中,垄沟集雨覆盖栽培显著降低了旱作马铃薯AGPP、GBSS 活性,显著提高了可溶性SSS 活性,其中,以全膜双垄最为明显。
2.2 淀粉合成关键酶基因相对表达量
各淀粉合成关键酶间存在种间功能异化的亚型,在作物淀粉生物合成中扮演各自独特的作用。由表3可知,在马铃薯块茎形成过程中,淀粉合成关键酶基因相对表达量总体均呈升高趋势;从块茎发育全程来看,马铃薯块茎中AGPase、SSII、GBSSI、SBEI、SBEII基因
平均相对表达量均表现为M01>M03>M02,M03、M02马铃薯块茎中SSIII基因相对表达量分别较M01 提高119.35%、32.26%(P<0.05)。可见,在块茎形成过程中,垄沟集雨覆盖栽培显著降低了旱作马铃薯AGPase、SSII、GBSSI、SBEI、SBEII基因表达量,以全膜双垄最为明显;显著提高了SSIII基因表达量,以地膜垄作最为明显。
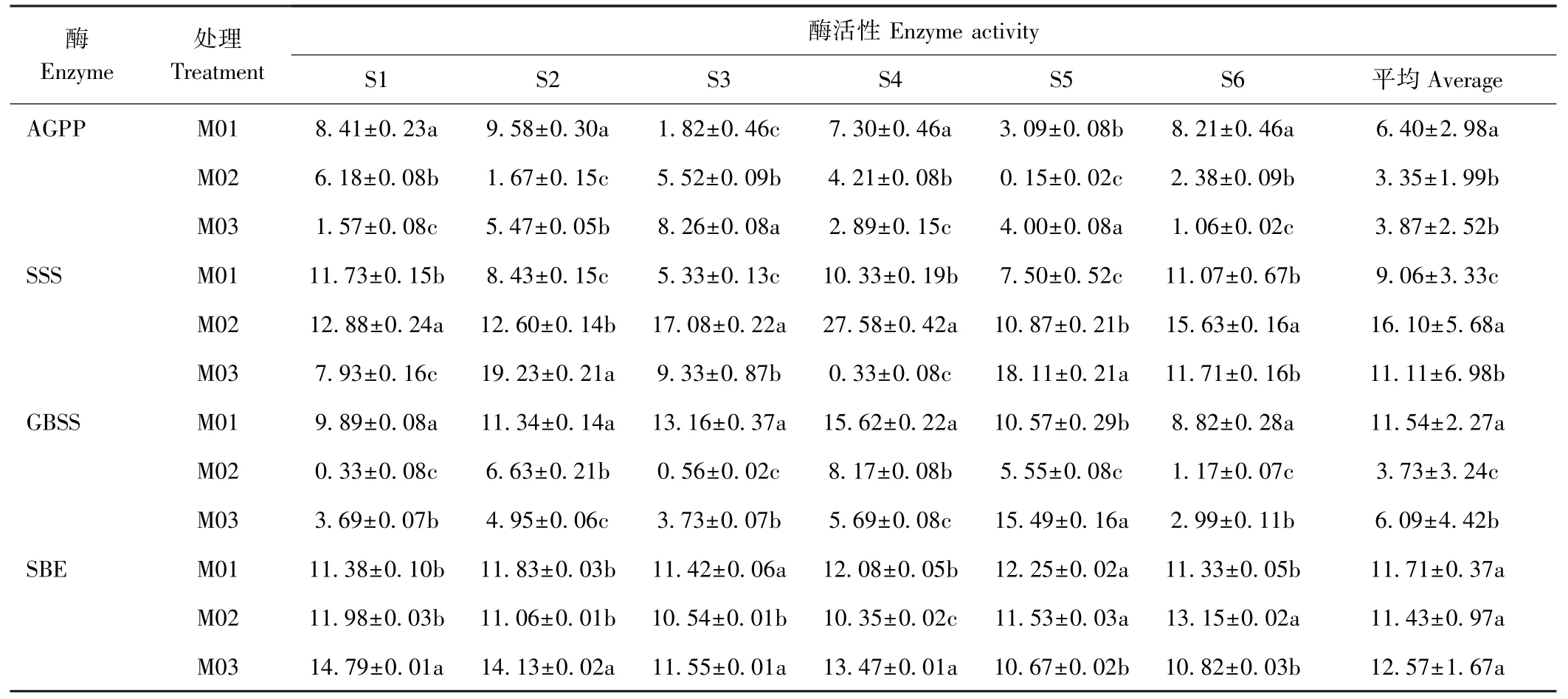
表2 垄沟集雨覆盖栽培模式对旱作马铃薯块茎形成各时期淀粉合成关键酶活性的影响Table 2 Effects of mulching on ridge-furrow for harvesting rainwater on activity of starch synthesis key enzyme at each period of tuber formation in rainfed potato /(U·g-1·min-1)
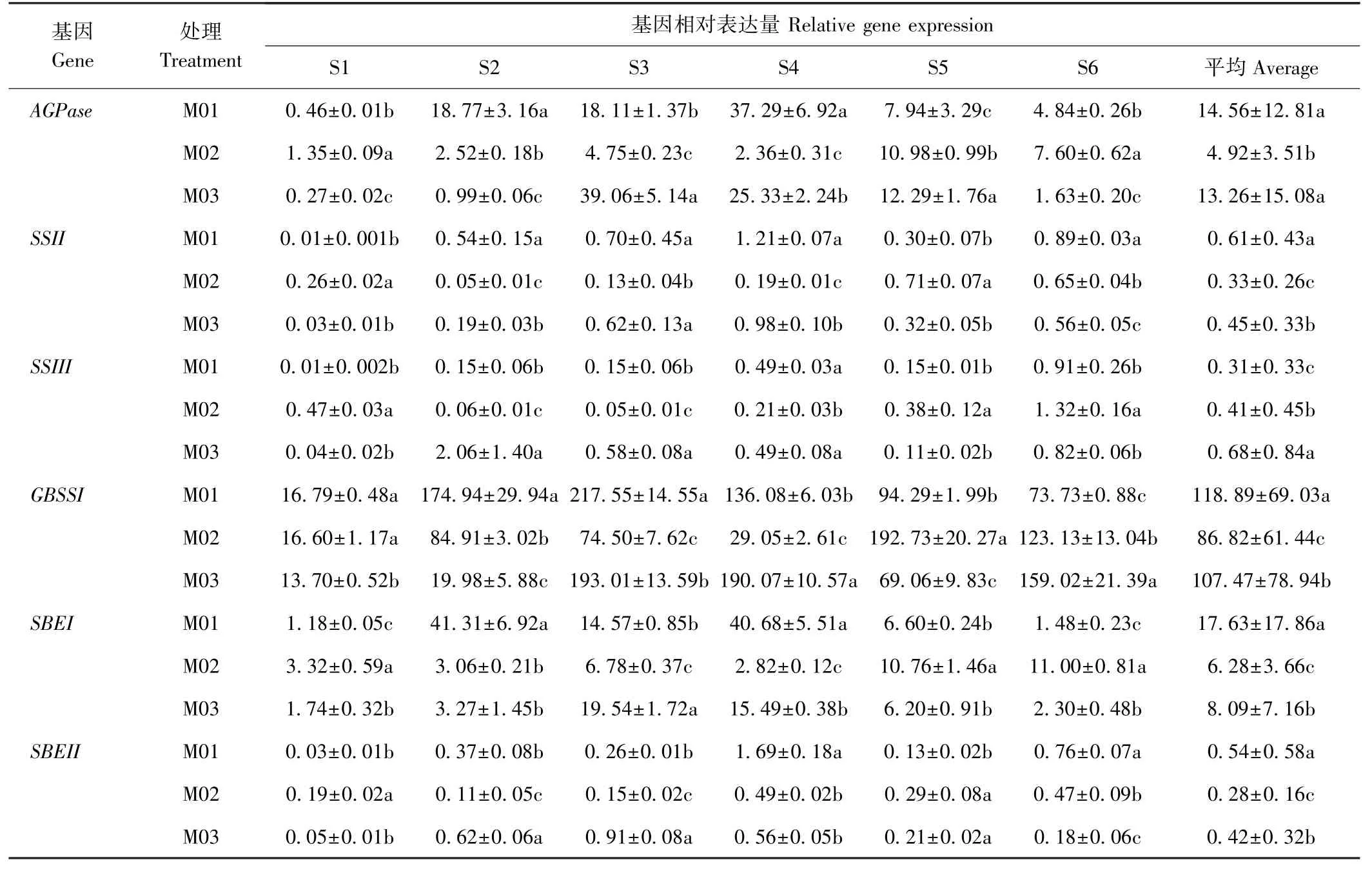
表3 垄沟集雨覆盖栽培模式对旱作马铃薯块茎形成各时期淀粉合成关键酶基因相对表达量的影响Table 3 Effects of mulching on ridge-furrow for harvesting rainwater onrelative gene expression of starch synthesis key enzyme at each period of tuber formation in rainfed potato
2.3 淀粉累积
淀粉累积决定着作物淀粉品质的优劣。由表4 可知,在马铃薯块茎形成过程中,块茎总淀粉含量、直链淀粉含量和直/支链淀粉比波动较大;从块茎发育全程来看,M02 马铃薯块茎总淀粉含量、直链淀粉含量和直/支链淀粉比分别较M01 提高5.04%、17.57%、27.81%,而M03 分 别 较M01 降 低5.71%、42.43%、47.68%。可见,在块茎形成过程中,与地膜垄作相比,全膜双垄覆盖栽培显著提高了旱作马铃薯总淀粉含量、直链淀粉含量及直/直链淀粉比。

表4 垄沟集雨覆盖栽培模式对旱作马铃薯块茎形成各时期淀粉累积的影响Table 4 Effects of mulching on ridge-furrow for harvesting rainwater on starch accumulation at each period of tuber formation in rainfed potato
2.4 相关性分析
由表5 可知,SSS 活性与GBSSI基因表达量呈显著负相关,与直链淀粉含量及直/支链淀粉比呈显著正相关;AGPase基因表达量与SSII、GBSSI、SBEI及SBEII基因表达量呈显著正相关;SSII基因表达量与GBSSI、SBEI及SBEII基因表达量呈显著正相关;GBSSI基因表达量与SBEI基因表达量呈显著正相关;SBEI基因表达量与SBEII基因表达量呈显著正相关;直链淀粉含量与直/支链淀粉比呈显著正相关。
3 讨论
通过多年发展,垄沟集雨覆盖栽培已广泛应用于小麦[28]、玉米[29]、马铃薯[30]、谷子[31]、糜子[32]、燕麦[33]、苜蓿[34]等作物上,因其结合地膜、秸秆、砂石等材料具有活化土壤养分[35]、提高土壤温度[36]、改良作物光合能力[37]等作用,已成为青海东部旱区关注的焦点。本研究表明,在块茎形成过程中,与地膜垄作相比,全膜双垄覆盖栽培模式可显著改良旱作马铃薯淀粉的质量。
马铃薯可溶性淀粉合成酶主要为SSII 和SSIII 两种同工型。本研究显示,在块茎形成过程中,与露地平播相比,垄沟集雨覆盖栽培同时提高了旱作马铃薯SSS 活性及SSIII基因表达量,表明SSIII 是可溶性淀粉合成酶的主要活性成分, 这与Lloyd 等[38]和Edwards 等[39]的研究结果类似。
在作物淀粉生物合成研究中,淀粉合成关键酶活性与基因表达量的关系一直备受关注。本研究表明,除SSS 活性与GBSSI基因表达量呈显著负相关外,AGPP、GBSS、SBE 活性与各关键酶基因表达量均无显著相关性,这可能是马铃薯淀粉合成关键酶活性除受到转录调控外,还受到转录后调控[40],与陈江等[41]在玉米上、谭彩霞等[42]在小麦上取得的结论相似。
本研究显示,旱作马铃薯SSS 活性与直链淀粉含量、直/支链淀粉比呈显著正相关,AGPase基因表达量与SSII、GBSSI、SBEI及SBEII基因表达量呈显著正相关,说明AGPP 和SSS 是马铃薯块茎淀粉生物合成的重要限制及功能酶。甘晓燕等[43]及Sweetlove 等[44]也证实了这一点。除SSS 活性外,其他淀粉合成关键酶活性及其相关基因表达量均与淀粉累积无显著相关,说明马铃薯淀粉合成关键酶活性的改变并不会直接造成淀粉累积的变化,应有其他因素控制,其具体机制还需进一步深入研究。

表5 旱作马铃薯块茎淀粉合成关键酶活性、基因表达与淀粉累积的相关性Table 5 Correlation analysis between amylase activity, key enzyme gene expression and starch accumulation in rainfed potato
4 结论
本研究初步表明,在块茎形成过程中,与地膜垄作相比,全膜双垄覆盖栽培模式可显著提高旱作马铃薯总淀粉及直链淀粉含量,有利于改良淀粉加工品质,但需要多年多点试验的进一步验证。本研究结果对筛选青海东部旱区马铃薯适宜的淀粉优质生产措施具有十分重要的意义。今后,应结合土壤理化及植株生理,如水分、温度、容重、叶片光合及衰老等,研究全膜双垄覆盖栽培下其与旱作马铃薯淀粉生物合成的关联。

