基于SSR标记的鸢尾杂交和诱变育种材料遗传多样性分析
周 琳 蔡友铭 张永春 杨柳燕
(上海市农业科学院林木果树研究所/上海市设施园艺技术重点实验室, 上海 201403)
鸢尾属于鸢尾科(Iridaceae)鸢尾属(IrisL.)多年生草本花卉,因其品种多、花色花型丰富、观赏价值高、抗逆性强、适应性广等优点,大量用于地被覆盖、草坪镶边、河道边坡绿化等[1]。在鸢尾众多类群中,路易斯安那鸢尾(Louisiana iris)作为一类杂种鸢尾,具有花色鲜艳丰富、适应性强、抗寒性强等优点,是较好的观花、观叶类水体绿化材料,在湿地绿化、河塘湖边造景、切花市场均具有较大的市场潜力[2-3]。路易斯安那鸢尾原产于美国,我国虽已开展了引种栽培、生长习性调查、组培快繁体系构建、抗性评价、育种等工作,但仍缺乏自主育成的新优品系,国内市场上大量使用国外品种[2]。近年来,路易斯安那鸢尾育种技术主要为杂交育种、自交育种和60Co-γ 辐射诱变育种,并开展了杂交和种子萌发体系的优化、种间杂交不亲和机理研究、自交及其后代观赏性状分离分析、种子最适60Co-γ 诱变剂量筛选等研究工作[2,4-6]。然而,上述已有的报道均主要通过表型鉴定自交、杂交或诱变育种的后代,鲜有利用简单重复序列标记(simple sequence repeats,SSR)等分子标记对其遗传多样性分析的报道,这在一定程度上制约了路易斯安那鸢尾育种的进程。
近年来,为提高路易斯安那鸢尾繁殖效率,已构建出不同外植体的组织培养繁殖体系[3,7-8],为辐射诱变育种的开展提供了较好的基础。本试验利用收集的5个路易斯安那鸢尾品种进行杂交育种,并通过60Co-γ射线辐射茎尖诱导的组培苗无性系进行诱变育种,最后通过14 对SSR 引物对40 份鸢尾材料进行遗传多样性分析,以期通过SSR 标记加快杂交后代和诱变材料的鉴定,缩短育种周期,使鸢尾新优品种能较快地进入市场,并成为园林绿化、庭院美化和专类园建设的重要花卉。
1 材料与方法
1.1 试验材料及辐射处理
以上海市农业科学院2016年引进的5 个路易斯安那鸢尾品种(Colorific、Heather Stream、Her Highness、Pegaletta 和Spicy Cayun)为试验亲本材料,种植于上海市农业科学院白鹤基地(31°14′16.56″N,121°05′44.88″E)双层塑料大棚内。参照李丹青等[4]的杂交方法进行5 个路易斯安那鸢尾品种间杂交,杂交后代的种子按照沈云光等[9]的方法处理,获得杂交后代幼苗,并种植于上述基地。参照祝剑峰等[10]的组培快繁方法,构建5 个路易斯安那鸢尾品种的无性系,选择长势一致、株高为2~3 cm 的组培苗用于辐射诱变处理。利用上海束能辐照技术有限公司60Co-γ 射线进行辐射诱变处理,设置2.5、5、10、20 和40 Gy 共5 个剂量,剂量率为1 Gy.min-1。辐射诱变处理后,每30 d 转接至继代培养基,培养条件(培养基配方、光照强度和周期、温湿度)与祝剑峰等[10]的继代培养条件一致。培养2 个月后,统计不同剂量辐射诱变成活率。以引进的路易斯安那鸢尾种质资源、品种间杂交后代和辐射诱变材料为试验材料(表1),选取路易斯安那鸢尾种质资源和杂交后代幼嫩且无病害叶片,以及辐射诱变材料继代培养2 个月后的健康无病害叶片,称重后,冻存于-80℃冰箱用于后续试验。

表1 供试路易斯安那鸢尾样本信息Table 1 The sample information of Louisiana iris
1.2 引物序列
从Tang 等[11]基于短茎鸢尾(I.brevicaulis)和暗黄鸢尾(I.fulva)叶片和根系的转录组数据所开发的532对表达序列标签(expressed sequence tags, EST)-SSR标记中选择14 对SSR 标记,引物名称、正向和反向引物序列、重复基序、扩增长度和退火温度具体信息见表2,引物由北京擎科生物技术有限公司合成。
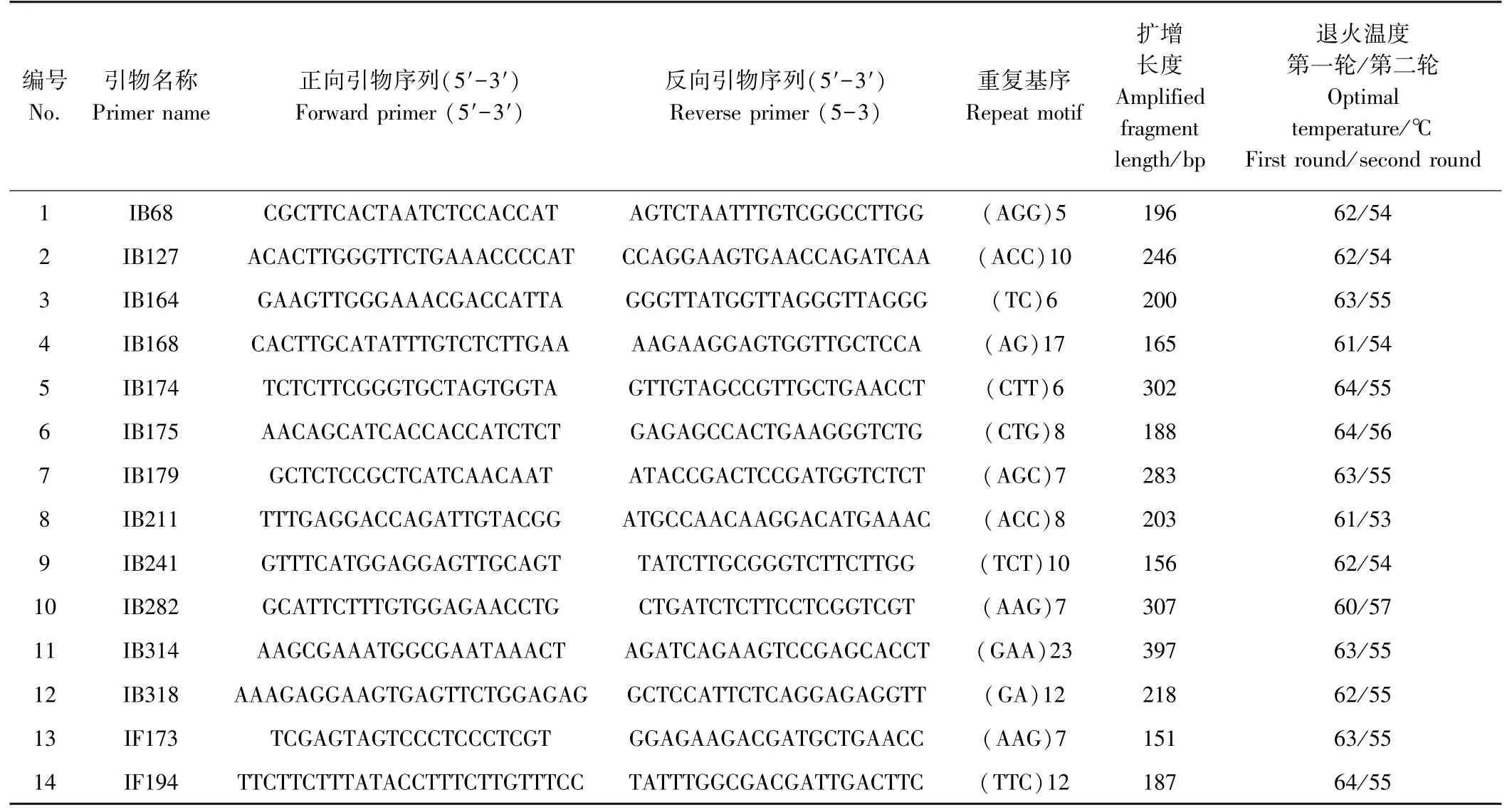
表2 SSR 引物信息Table 2 SSR primer information
1.3 DNA 提取和检测
使用植物基因组DNA 提取试剂盒(DP305,天根生化科技有限公司)提取5 个路易斯安那鸢尾品种、杂交后代及其诱变材料共40 份材料的叶片总DNA。通过1.0%琼脂糖凝胶电泳检测DNA 完整性,使用NanoDrop1000 分光光度计(Thermo Fisher Scientific,美国)测定DNA 浓度及纯度(A260/A280)后,将符合测试要求的各样品DNA 均稀释至10 ng.μL-1,冻存于-20℃备用。
1.4 SSR-PCR 扩增和毛细管电泳检测
多重PCR 扩增体系15 μL,包括2×Tsingke Master mix(green)(TSE004, 北京擎科新业生物技术有限公司)7.5 μL、DNA(浓度10 ng.μL-1)1 μL、正反向引物(浓度10 μmol.L-1)各1 μL、ddH2O 4.5 μL。PCR 反应程序:94℃预变性5 min;94℃变性30 s,60 ~64℃退火30 s(不同引物退火温度见表2),72℃延伸30 s,共30 个循环;72℃延伸5 min,最后4℃保存扩增产物。第一次扩增后的产物(2 μL 扩增产物+5 μL 溴酚蓝)通过1.0%琼脂糖凝胶电泳(电压300 V,12 min)检测和判断对应引物是否扩增出目的DNA 片段;随后进行二次扩增,扩增体系和PCR 反应程序同第一次,第二轮退火温度为53~57℃(不同引物退火温度见表2)。基于14 对SSR 标记的40 个路易斯安那鸢尾试验材料的毛细管电泳检测委托北京擎科生物科技有限公司完成,具体步骤参照徐晓丹[12]的方法。
1.5 数据统计与分析
使用Gene mapper V4.1 软件(美国Applied Biosystems 公司)分析毛细管电泳检测的原始数据准确位点。根据峰图和位点信息判断检测引物是否具有位点多态性,选取特异性高,多态性好的位点作为后续分析重点。使用PopGen32 软件计算SSR 位点遗传多样性指标,并计算样本间的标准遗传距离[13];随后,采用非加权平均数法(unweighted pair-group method with arithmetic means, UPGMA)进行遗传相似性聚类分析,并绘制遗传亲缘关系树状聚类图。参照徐晓丹[12]的方法,通过STRUCTURE version 2.3.4 软件[14]进行群体遗传结构分析;采用的马尔科夫链蒙特卡洛法(markov chain monte carlo,MCMC)方法可预设群体分组(K),同时根据等位基因频率对个体进行计算、抽样分组,参数设置参照徐晓丹[12]的方法。随后利用在线软件STRUCTURE HARVESTER ( http:/ /taylor0. biology. ucla. edu/structureHarvester/)计算最适K 值[15-16]。
2 结果与分析
2.1 杂交与诱变育种情况
5 个路易斯安那鸢尾品种花期均在5月中旬至下旬,但当年开花量小且不同品种间花期最大间隔10 d,给杂交工作造成了极大的影响,最终导致品种间杂交收获的种子数量较少。5 个品种获得杂交后代种子的信息见表1,选择其中长势较好的9 份种质用于后续分析,9 份种质(L3、L4、L5、L16、L17、L26、L34、L35 和L40)的亲本信息见表1。
5 个品种经不同剂量60Co-γ 射线处理后的组培苗成活率如表3 所示。5 个品种的成活率均随着辐射剂量的成倍增加而显著降低,即2.5 Gy 剂量处理时成活率最高,40 Gy 剂量处理时成活率最低。不同品种间2.5 和5 Gy 剂量处理下成活率较为接近,成活率范围分别为20.77%~24.99%和13.33%~17.89%;10、20和40 Gy 剂量处理时,部分品种间成活率存在极显著差异(P<0.01)。参照黄桂丹[17]总结的经验,即半致死剂量或低于半致死剂量的60Co-γ 对植株伤害小,且易获得优良变异性状。本试验中5 个品种在2.5 Gy剂量处理下,成活率均已低于25%,但高于其余4 个剂量处理,因此选择2.5 Gy 剂量处理后长势较好的组培苗用于遗传多样性分析,诱变材料具体信息见表1。
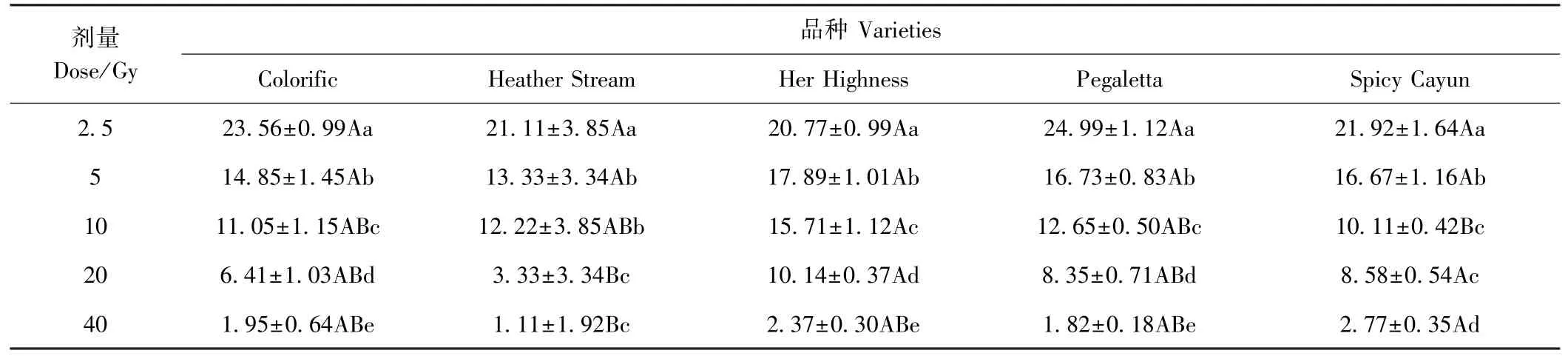
表3 不同剂量60Co-γ 对鸢尾成活率的影响Table 3 Effect of different doses of 60Co-γ on the survival rate of iris /%
2.2 引物选择和扩增效果
由于路易斯安那鸢尾由短茎鸢尾、暗黄鸢尾、六角果鸢尾(I. hexagona)、高大鸢尾(I. giganticaerulea)和内耳森鸢尾(I.nelsonii)5 个野生种杂交而来[2-3],因此本试验从适用于短茎鸢尾和暗黄鸢尾的532 对ESTSSR 标记中选择了14 对用于遗传多样性分析,其中IB179、IB194、IB211、IB282、IB314 和IB318 均位于预测编码蛋白框(coding DNA sequence, CDS),与功能基因密切相关。14 对SSR 引物的检测结果表明其中10对SSR 引物特异性高且多态性较好,适用于后续遗传多样性分析;而IB68、IB164、IB174 和IB282 在检测中存在无多态性、条带杂乱或多态性低等问题,不能用于测试样本的遗传多样性分析。
2.3 SSR 标记多态性
10 对特异性高且多态性好的SSR 引物在40 个鸢尾材料中共检测出60 个等位基因位点(表4)。其中,最小等位基因数目为4(IB127、IB175 和IB314),最大等位基因数目为11(IB168),平均等位基因数目为6。有效等位基因总数为33.087 4,数值变化范围为2.091 7(IB175)~4.071 2(IF173),平均每个位点有效等位基因数目为3.308 7。香农指数的数值范围为0.964 9(IB175) ~1.661 9(IB168),平均值1.347 2。多态信息指数的数值范围为0.472 7(IB175)~0.718 5(IF173),平均值0.637 3,可见10 对SSR 引物具有较高的多态信息(PIC>0.25)。观测杂合度(Ho)和期望杂合度(He)的数值范围分别为0.297 3(IF194) ~0.571 4(IB318)和0.529 1(IB175)~0.763 9(IF173),均值分别为0.451 5 和0.696 2。
2.4 聚类和遗传结构分析
根据遗传相似系数进行UPGMA 聚类分析,绘制聚类树状图(图1)。利用10 对SSR 标记可将供试的40 份路易斯安那鸢尾材料相互区分,10 对SSR 标记可用于鉴定和区分路易斯安那鸢尾杂交后代和诱变材料。聚类分析将供试材料分成4 类,第Ⅰ类包括9 份材料,为Colorific(L1)、Pegaletta(L27)、Pegaletta 诱变材料(L28~L33)以及♀Pegaletta×♂Heather Stream 杂交后代(L34);第Ⅱ类包括16 份材料,为Heather Stream(L6)、Heather Stream 诱变材料(L7~L15)及其与其他品种的杂交后代(L3、L4、L5、L16、L17 和L26);第Ⅲ类包括10 份材料,为Colorific 诱变材料(L2)、Her Highness(L18)、Her Highness 诱变材料(L19 ~L25)以及♀Her Highness×♂Spicy Cayun 杂交后代(L35);第Ⅳ类包括5份材料,为Spicy Cayun(L36)、Spicy Cayun 诱变材料(L37 ~L39)以及♀Spicy Cayun×♂Colorific(L40)。由此可见,除了Colorific 以外,其余4 个品种的多数杂交后代(L5、L16、L17、L34、L35 和L40)与母本的遗传距离较近。Colorific 作为亲本时,其杂交后代(L3、L4、L5)均与亲本Heather Stream 遗传距离接近,由于该品种经辐射诱变后获得的诱变材料长势均较弱,因此仅选择其中L2 作为测试材料,但L2 与Colorific(L1)遗传距离较大,且更接近于♀Colorific×♂Heather Stream杂交后代(L3),可见60Co-γ 射线处理耳促进Colorfic产生变异。5 个路易斯安那鸢尾品种中,Heather Stream 品种获得的诱变材料长势较好,选择了其中9个材料(L7 ~L15)用于测试。由图1 可知,L7、L13、L14 与亲本(L6)遗传背景较为一致,后续可不进行继代培养,而L8~L12 与亲本遗传差异大,值得进一步扩繁后观测其表型性状。Her Highness 品种有7 个诱变材料(L19~L25)长势较好,但仅L23、L24 和L25 存在差异。对于Pegaletta 品种的诱变材料,值得继续关注L29 ~L33;对于Spicy Cayun 品种,诱变材料L38 和L39则较为相近。因此,筛选出的10 对SSR 标记能较好地区分路易斯安那鸢尾亲本、杂交后代和诱变材料,可用于路易斯安那鸢尾育种材料的早期筛选。
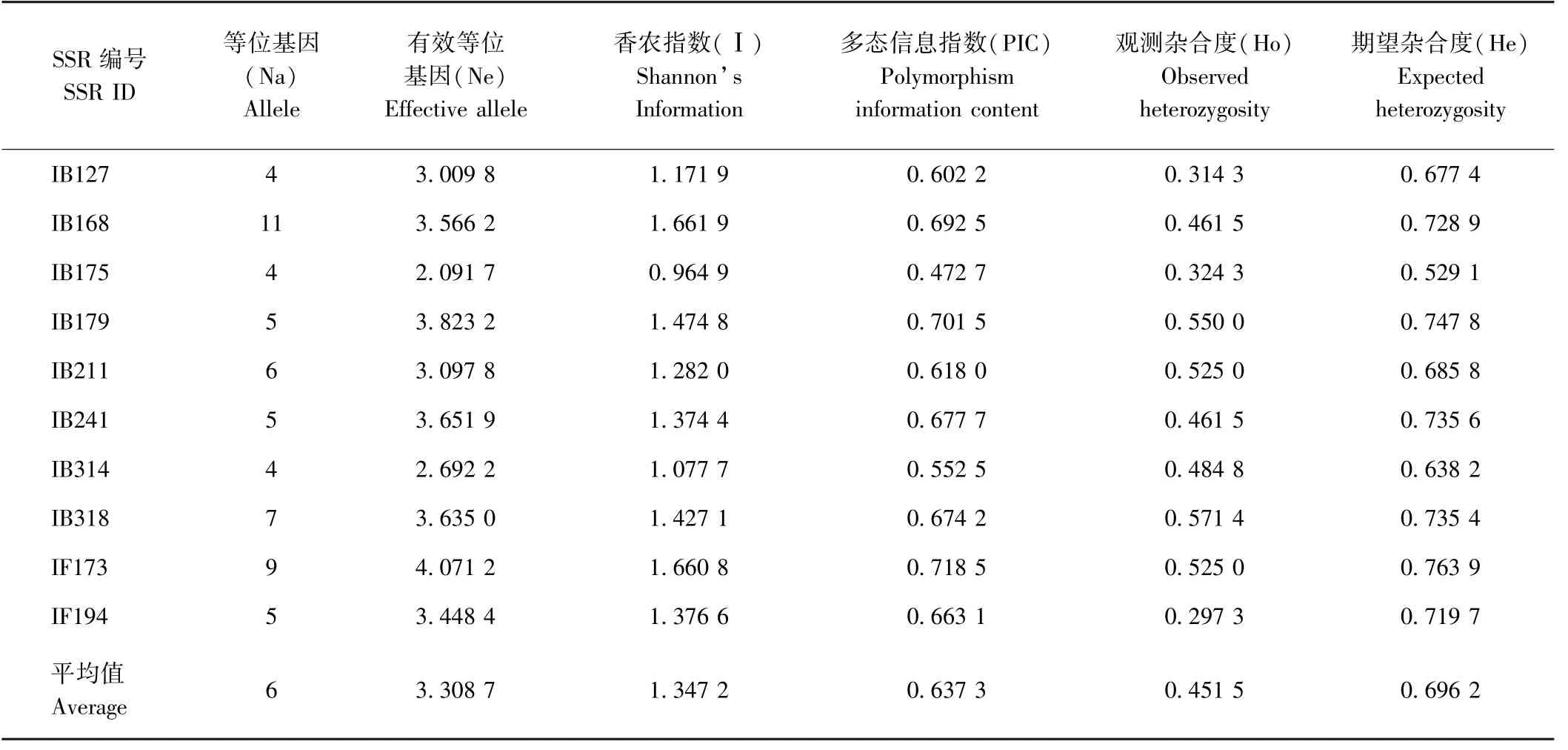
表4 10 对SSR 引物的多态性信息含量分析Table 4 The analysis of polymorphic information in 10 SSR primer
在 STRUCTURE HARVESTER 中根据 Evanno等[16]的方法计算,得到的最适ΔK值为5,表明40 个样品中有5 个基因库的存在,不同基因库由不同颜色表示(图2、图3)。由图3 可见,STRUCTURE 结果将40 份路易斯安那鸢尾材料分为5 个组,且5 个组基本与5 个品种相对应,不同品种的主要基因库不同,可见基于筛选的10 对SSR 标记分析结果,5 个路易斯安那鸢尾材料的遗传结构并不相似。
3 讨论
鸢尾属作为重要园林绿化花卉,国内外已通过多种方法开展育种工作,以加快育种进程。杂交育种技术作为常用育种技术之一,已用于鸢尾属种间和品种间育种,主要研究集中于有髯鸢尾类中的德国鸢尾类群和无髯鸢尾类的西伯利亚鸢尾类群、花菖蒲类群等[1,18-19]。我国已开展路易斯安那鸢尾杂交育种相关研究,如报道了黄玉[20]、蓝纹白蝶[21]和紫霞等[22]3 个新品种。本试验利用已收集的5 个路易斯安那鸢尾品种进行杂交育种,对其杂交后代进行遗传多样性检测,发现多数杂交后代与母本的遗传距离更接近。因此,后续将开展5 个路易斯安那鸢尾品种的性状调查、抗性评价、杂交育种等工作,从中筛选符合育种目标的母本,可提高杂交育种效率,缩短育种周期。
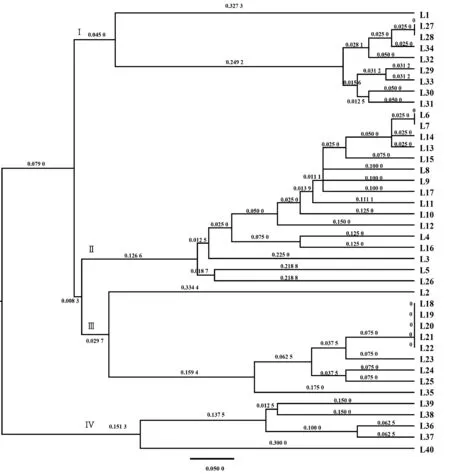
图1 基于SSR 标记的40 个鸢尾材料聚类分析Fig.1 Cluster analysis of 40 iris samples based on SSR markers
60Co-γ 射线辐射已用于百合、红掌、玉兰、菊花等花卉的诱变育种[17],然而不同物种、不同组织的最佳辐射剂量存在显著差异,筛选合适的辐射诱变剂量是诱变育种的关键步骤之一。鸢尾诱变育种工作相对较少,且主要以种子[2]、种球[23]为诱变材料,筛选出的最佳诱变剂量因材料不同而差异较大。本试验以不同路易斯安那鸢尾品种的无性系组培苗为试验材料,不同剂量60Co-γ 诱变处理下,剂量越高其成活率越低,在2.5 Gy 剂量处理下不同路易斯安那品种的成活率均已低于25%。此外,在低剂量辐射剂量(2.5、5 和10 Gy)下,不同路易斯安那品种间成活率差异并不明显;但随着剂量增加(20、40 Gy),Her Highness 和Spicy Cayun 成活率高于另外3 个品种。2.5 Gy 剂量处理下,5 个路易斯安那鸢尾品种间成活率较为接近(范围为20.77%~24.99%),但品种间后期长势存在差异;Colorific、Heather Stream、 Her Highness、 Pegaletta 和Spicy Cayun 分别获得了1、9、7、6 和3 个长势健壮的诱变材料,结合不同60Co-γ 诱变剂量的结果,可见路易斯安那鸢尾品种间对60Co-γ 射线的耐受能力存在差异,且Heather Stream 品种耐受能力强于其余4 个品种。与鸢尾种子或种球相比[2,23],鸢尾组培苗适宜的60Co-γ 辐射剂量相对较低,但基于组培快繁体系可获得大量用于诱变处理的不同品种组培苗,且可对与亲本有差异的诱变株系快速扩繁,可加快路易斯安那鸢尾诱变育种进程。
本试验选择2.5 Gy 剂量获得的诱变材料,采用10对SSR 标记分析其遗传多样性,其中Heather Stream、Her Highness、Pegaletta 和Spicy Cayun 的诱变材料虽均与其母本遗传距离较近,但也筛选出多份与亲本存在遗传差异的诱变材料,且发现5 个路易斯安那鸢尾材料的遗传结构并不相似,表明路易斯安那鸢尾诱变材料具有丰富的多样性。值得关注的是, 虽然Colorific(L1)诱变材料中长势较好的仅为L2,但其与L1 的遗传距离较大,更接近于Heather Stream,这可能是变异具有不定向性,也可能是由组培的去分化和再分化过程中发生基因突变等因素引起。虽然,利用10对SSR 标记对获得的路易斯安那鸢尾材料进行了遗传多样性分析,但本研究并未对其后期表型,尤其是花期性状(可否开花、花色等)、株高、株型等进行观测,后期将开展表型观测,筛选与育种目标相符的材料。
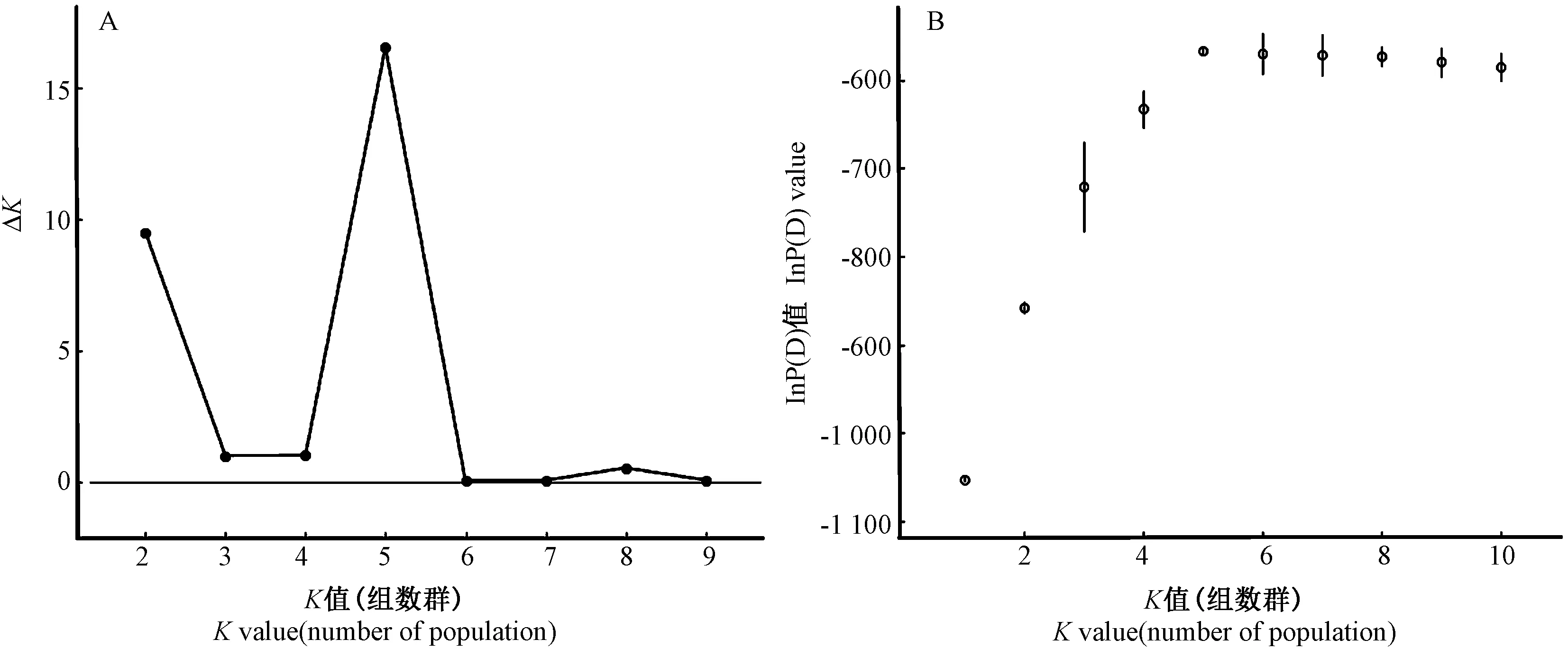
图2 基于STRUCTURE 分析K 值与△K 和LnP(D)值折线图Fig.2 Lines chart of Kvalue with ΔK value and LnP (D) value based on STRUCTURE analysis
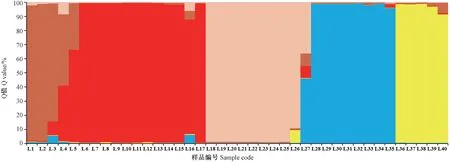
图3 40 个路易斯安那鸢尾种质资源基于模型的遗传结构(K=5)Fig.3 Model-based structure of Louisiana iris germplasm resources(K=5)
近年来,SSR 标记除了用于杂交和自交后代的遗传多样性分析和新种质鉴定外[24-25],还成功应用于狼尾草属牧草[26]、高羊茅[27]、紫花苜蓿[28]等不同物种的诱变材料鉴定。随着分子标记技术的不断发展,除了传统SSR 标记开发方法,基于转录组或基因组可更高效和大规模地开发SSR 标记。例如,在狼尾草属牧草诱变系鉴定中[26],Wang 等[29]使用的70 对SSR 引物是基于象草Survey 测序开发的;蔡璐等[27]从高羊茅基因组SSR 引物库中随机选择了140 对引物用于航天诱变株系的鉴定。与模式植物相比,花卉基因组测序工作相对滞后,且花卉品种(品系)丰富,部分品种(品系)可能尚未有相关转录组报道。因此,本试验基于短茎鸢尾和暗黄鸢尾转录组开发的532 对EST-SSR标记,选择其中14 对相对多态性较高的SSR 引物用于遗传多样性分析,其中10 对具有多态性且稳定表达,由此可见这部分标记适用于路易斯安那鸢尾,且可用于杂交后代和诱变材料的鉴定。进一步基于转录组数据筛选和验证多态性高且稳定的SSR 标记,可为路易斯安那鸢尾的遗传多样性分析、亲缘关系鉴定、遗传图谱构建和分子标记辅助育种奠定一定的基础。
4 结论
本研究以引进的5 个路易斯安那鸢尾品种为试验材料,开展了杂交育种和60Co-γ 射线诱变育种,并选择长势健壮的幼苗进行遗传多样性分析。从短茎鸢尾和暗黄鸢尾的EST-SSR 标记中选择14 对SSR 标记用于路易斯安那鸢尾品种、杂交后代和诱变材料的遗传多样性分析,通过毛细管电泳法筛选出10 对适用于路易斯安那鸢尾的SSR 标记。经遗传多样性分析,路易斯安那鸢尾杂交后代与母本的遗传差异小;5 个路易斯安那鸢尾品种经不同剂量的60Co-γ 射线辐射后,剂量越高成活率越低;虽然2.5 ~40 Gy 剂量处理下诱变材料成活率均低于25%,但通过EST-SSR 标记分析均获得了与亲本遗传差异大的诱变材料,可进一步扩繁后对其性状进行测评。

