异源表达EgrNAC1提高拟南芥抗寒性和对干旱、高盐的敏感性
从 青 倪晓祥 程龙军
(浙江农林大学/亚热带森林培育国家重点实验室,浙江 杭州 311300)
植物在生长发育过程中,极易遭受干旱、盐碱、极端温度等非生物逆境胁迫的影响。同时,在长期进化中,植物自身也形成了一套应对环境胁迫的机制,在逆境胁迫产生时,使其能够迅速感受到逆境信号,进而从分子、细胞、生理和发育水平上提高植物对逆境胁迫的适应能力和抗性[1-2]。分子水平上,转录因子作为控制基因时空表达的开关,在植物逆境胁迫响应中发挥重要功能[3-4]。参与植物非生物逆境胁迫的转录因子种类众多,包括NAC、bZIP、WRKY、MYB、DREB、ERF等[5]。其中,NAC(NAM、ATAF1/2 和CUC2)转录因子是植物特有的大型转录因子家族之一。NAC 转录因子不仅参与植物生长和发育[6],而且在抵抗低温、干旱、高盐、病原菌等多种生物和非生物逆境胁迫中发挥重要作用[7]。
最早在矮牵牛(Petumnia hybrida)中发现NAC基因,该基因缺失影响根尖分生组织和叶片发育[8]。NAC基因还被证明参与植物侧根发育[9-10]、顶端分生组织分化[11]、次生细胞壁形成[12]、器官衰老[13]和花发育[14]等过程。近年研究表明,NAC与非生物胁迫的响应密切相关。参与非生物逆境响应的NAC基因统称为SNAC(stress-relatedNAC)[15],如水稻(Oryza stativa)SNAC1 基因超表达转基因株系在田间遭受严重干旱情况下,结实率仍比对照组高22%~34%,其营养生长阶段的抗寒性与耐盐性也显著提高[16]。鹰嘴豆(Cicer arietinumL.)CarNAC6 在拟南芥(Arabidopsis thliana)中超表达也能提高转基因株系的抗旱和耐盐性[17]。同一植物中不同NAC 转录因子发挥的功能不同,胡杨(Populus euphratica)中的PeNAC036 在拟南芥中超表达能显著提高转基因株系对干旱和高盐的抗性;而PeNAC034 的超表达拟南芥转基因株系却提高了对干旱和高盐胁迫的敏感性;杨树中超表达另一个NAC 基因PeNAC045,则会使植株在盐和干旱胁迫下降低气孔导度、呼吸速率和净光合速率[18]。由于在逆境响应中NAC 发挥的功能多样且复杂,因此有必要对在非生物逆境响应中发挥重要功能的NAC 基因进行深入研究。
桉树(Eucalyptus)作为我国南方栽培的重要用材树种,低温、干旱等逆境一直是影响其栽培效益和限制其栽培范围的主要原因。浙江农林大学桉树抗逆分子育种课题组前期在巨桉中发现一个参与非生物逆境响应的NAC基因EgrNAC1(Eucgr.I00058),其在低温、干旱和高盐胁迫下的表达,都有明显的诱导效应,同时还参与脱落酸(abscisic acid,ABA)的信号转导,推测其可能在桉树非生物逆境响应中发挥重要功能[19]。本研究利用异源转化手段,在拟南芥中超表达EgrNAC1,初步分析转基因株系在低温、干旱和高盐等非生物逆境胁迫下的响应,以期为深入研究该基因在非生物逆境响应中的功能提供基础。
1 材料与方法
1.1 植物材料
拟南芥为哥伦比亚生态型(Col)。EgrNAC1 基因来自于浙江农林大学保存的巨桉G5 无性系材料。拟南芥生长环境条件为25℃/15 h(光)、22℃/9 h(暗),相对湿度65%,光照强度为100 μmol.m-2.s-1。
1.2 EgrNAC1 超表达载体构建、拟南芥遗传转化
超表达载体构建采用Gateway 技术,载体选用pGWB 系列含35S 启动子的pGWB402Ω。以巨桉叶片中提取的mRNA 为模板逆转录为cDNA。根据EgrNAC1 mRNA 序列设计Gateway 载体引物(表1)。以逆转录后获得的cDNA 为模板进行PCR 扩增,利用BP ClonaseTMEnzyme Mix(赛默飞,美国)将扩增产物与入门载体pDONR221 进行重组反应。获得的阳性克隆测序正确后,再用LR ClonaseTMEnzyme Mix(赛默飞,美国)进行Gateway 重组反应。重组的阳性克隆提取质粒后,利用电击法转入农杆菌GV3101 中,利用蘸花法转化拟南芥。侵染植株种子在含60 mg.L-1卡那霉素(Kanamycin)的1/2 MS 培养基上进行筛选,获得的阳性株系通过分子检测后,继续进行繁殖,筛选,直至获得T3 转基因纯合株系。
1.3 转基因拟南芥株系中EgrNAC1 的表达
将获得的3 个超表达EgrNAC1 拟南芥T3 转基因纯合株系和Col 于基质中培养10 d,剪取完全展开的莲座叶片,利用RNA 提取试剂盒(北京天根生物技术公司)提取RNA,用PrimeScriptTMRT reagent Kit(TaKaRa,日本)反转录为cDNA,设计引物(表1),以AtACTIN为内参,进行半定量PCR 试验。同时,用Bio-Rad CFX96(Bio-Rad, 美国)进行实时荧光定量PCR(quanitative real-time PCR, RT-qPCR)试验,用系统自带的Bio-Rad CFX Manager(Ver 1.5.5.34)软件进行结果计算,分析转基因纯合株系中EgrNAC1 的表达情况。
1.4 低温、干旱和高盐处理试验
将EgrNAC1-OE1 和EgrNAC1-OE8 纯合转基因株系与Col 种子均匀撒播至湿润的育苗基质中,4℃处理2 d,转移至拟南芥生长室培养。子叶展开后,移栽至含相等重量基质的育苗盆中培养2 周,进行低温、干旱和高盐处理试验。野生型和不同转基因株系各处理3盆,每盆9 株苗,重复3 次。
低温处理:将长势一致的幼苗转移至Snijders 微气候控制生长箱(MC1000,荷兰),参考Steponkus等[20]和阎依超等[21]的方法,根据预试验结果进行调整。将幼苗放置于-6℃处理12 h 后,再于4℃处理1 d,然后转移至生长室恢复5、9 d 后,拍照并统计存活率。
干旱处理:选取长势一致的幼苗,对育苗盆称重,用水调整各育苗盆使其重量一致,停止浇水,至植株叶片完全萎蔫后再恢复浇水3 d,拍照并统计存活率。
高盐处理:参考Liu 等[22]的方法,选取长势一致的幼苗,浇灌NaCl 溶液(300 mmol.L-1),每盆每天浇灌100 mL,每天1 次,处理至产生盐渍化并呈现差异(约2 周左右)后,拍照。
1.5 离体叶片失水率测定
选取长势一致的2 周苗龄幼苗,于称量纸上快速剪取第3 ~第6 片莲座叶,每20 片为一个样本,称重(m0),设置3 次重复,每隔1 h 称重1 次(m1)。按照公式计算失水率:
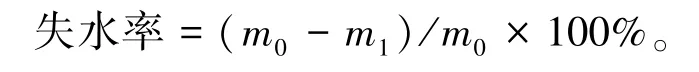
1.6 低温响应相关基因的定量表达分析
将14 d 苗龄的拟南芥幼苗转移至低温培养箱进行低温处理(方法见1.4),提取RNA,进行反转录。同时,参考刘静妍等[23]的方法设计拟南芥低温响应相关基因AtCBF1、AtCBF2 及AtRD29A等定量引物,进行RT-qPCR,试剂由大连TaKaRa 公司提供,定量引物由南京金斯瑞生物工程技术有限公司合成,具体序列如表1 所示。

表1 引物列表Table 1 The list of primers used
1.7 ABA 处理方法
取Col 和EgrNAC1 超表达株系EgrNAC1-OE1,EgrNAC1-OE6 和EgrNAC1-OE8 纯合株系的种子,用75%乙醇消毒10 min,均匀点播在含0.5 μmol.L-1ABA 的1/2 MS 培养基上,同时点播在未添加ABA 的1/2 MS 培养基上(对照),均在4℃冰箱中放置48 h,然后正常培养10 d 后,观察ABA 对转基因株系的影响。
1.8 数据统计与分析
RT-qPCR 结果利用2-ΔΔCt法[24]计算获得。采用GraphPad Prism (ver 5.01)软件作图并进行显著性检验。
2 结果与分析
2.1 超表达 EgrNAC1 拟南芥转基因株系中EgrNAC1 的表达
将构建好的载体遗传转化拟南芥植株后,筛选阳性株系并繁育至T3,获得3 个纯合体株系:EgrNAC1-OE1、EgrNAC1-OE6 和EgrNAC1-OE8,并对这3 个株系进行EgrNAC1 表达情况分析(图1-A)。结果表明,3个株系中EgrNAC1 都有较高丰度的表达。定量表达结果(图1-B)进一步表明,EgrNAC1 在EgrNAC1-OE8株系中的表达量最高,EgrNAC1-OE1 次之,EgrNAC1-OE6 最低。
2.2 超表达EgrNAC1 转基因拟南芥低温处理下的表型分析
为了解EgrNAC1 在非生物逆境响应中的功能,对转基因株系中EgrNAC1 表达量高的2 个转基因株系EgrNAC1-OE1、EgrNAC1-OE8 进行-6℃低温处理。正常生长条件下,转基因株系EgrNAC1-OE1、EgrNAC1-OE8 生长2 周的植株与同苗龄野生型植株长势一致。-6℃处理12 h 后,转基因株系与野生型都产生不同程度冻害,然后,再于正常生长条件下恢复生长到第5天,转基因株系的生长恢复情况明显好于野生型,恢复9 d 后,转基因株系几乎完全恢复生长(图2-A),EgrNAC1-OE1、EgrNAC1-OE8 的存活率分别达到了88.9%和81.5%,而野生型只有29.6%(图2-B)。由此可见,EgrNAC1 的表达显著提高了转基因拟南芥的抗寒能力。

图1 拟南芥野生型和EgrNAC1 超表达转基因株系中EgrNAC1 的半定量(A)和定量(B)表达Fig.1 Semi-quantitative (A) and quantitative (B)expression analysis of EgrNAC1 in wide type and EgrNAC1 overexpression transgenic lines
2.3 超表达EgrNAC1 转基因拟南芥低温处理下抗寒相关基因的表达分析
参与植物低温响应的分子调控途径主要为CBF(CRT/DRE-binding factor)转录因子介导的植物低温响应途径[25]。针对ICE(inducer of CBF expression)-CBF 途径中的重要基因AtICE1、AtCBF1、AtCBF2、AtCBF3、AtRD29A、AtCOR15、AtCOR47 等,分析了低温处理下转基因株系中上述基因的表达。由图3 可知,4℃低温处理下,2 个转基因株系中AtCBF1、AtCBF2 和AtRD29A的表达量显著上调,而其他基因无显著变化。暗示转基因株系抗寒能力的提高可能是通过EgrNAC1促进AtCBF1、AtCBF2 和AtRD29A的表达引起的。
2.4 超表达EgrNAC1 转基因拟南芥干旱、高盐处理下的表型分析

图2 野生型和EgrNAC1 超表达转基因株系-6℃低温处理后恢复5 d 和9 d 的表型(A)与存活率(B)Fig.2 Phenotype of wide type and EgrNAC1 overexpression lines after 12 h treatment of -6℃and recover for 5 and 9 days under normal temperature (A). And, survival ratio of wide type and EgrNAC1 overexpression lines under low temperature treatment(B)
由图4-A 可知,干旱处理后,恢复供水3 d,野生型拟南芥叶片从失水萎蔫状态中逐渐恢复,而转基因株系EgrNAC1-OE1 和EgrNAC1-OE8 则无法恢复,存活率为0,而野生型存活率为100%, 表明超表达EgrNAC1 的转基因拟南芥植株对干旱的敏感程度提高。进一步对离体叶片的失水率进行比较,发现2 个转基因株系离体叶片失水率均高于野生型(图4-B),表明干旱条件下转基因株系对干旱敏感性的提高可能与叶片过快的失水反应有一定的关系。

图3 4℃低温处理12 h 野生型和EgrNAC1 超表达株系中AtICE1,AtCBF1,AtCBF2,AtCBF3,AtRD29A,AtCOR15 和AtCOR47 的表达分析Fig.3 Analysis of gene expression of AtCBF1,AtCBF2 and AtRD29A under 4℃treatment for 12 hours in wide type and EgrNAC1 overexpression lines
高盐(300 mmol.L-1NaCl)处理2 周后,野生型和转基因株系都表现叶片黄化、焦枯等盐渍化伤害表型。但EgrNAC1-OE1 和EgrNAC1-OE8 的盐害更为严重,叶片出现白化现象,植株生长受到更加明显的抑制作用,表明EgrNAC1 转基因拟南芥株系对盐的敏感度也高于野生型(图5)。

图4 野生型和EgrNAC1 转基因株系干旱处理下的表型(A)与叶片离体失水率比较(B)Fig.4 Phenotype(A) and water loss ratio(B) of wide type and EgrNAC1 overexpression lines under drought treatment

图5 野生型和EgrNAC1 超表达转基因株系高盐处理表型Fig.5 Phenotype of wide type and EgrNAC1 overexpression lines under salt treatment
2.5 超表达EgrNAC1 转基因拟南芥ABA 处理下的表型分析
ABA 影响植物对非生物逆境的响应[26]。为了进一步分析逆境响应中影响EgrNAC1 发挥功能的因素,对EgrNAC1-OE1、EgrNAC1-OE6 和EgrNAC1-OE8 进行ABA 处理。由图6 可知,与野生型相比,EgrNAC1超表达转基因株系叶柄更长,展开叶更大,根系更壮,说明EgrNAC1-OE1、EgrNAC1-OE6 和EgrNAC1-OE8对ABA 的敏感程度大幅度降低,EgrNAC1 的表达影响了植株对ABA 的反应,进而可能会影响植株对ABA依赖性非生物逆境信号的响应。
3 讨论

图6 野生型和EgrNAC1 超表达转基因株系ABA 处理10 d 后的表型Fig.6 Phenotype of wide type and EgrNAC1 overexpression lines treated with ABA after 10 days
NAC 是参与非生物逆境响应的一类重要转录因子,在调控植物抵抗低温、干旱和高盐等非生物逆境响应中发挥了重要作用。植物NAC 类转录因子中,大约有20%~25%的成员参与了至少1 种以上的非生物逆境响应,而且这些NAC 类转录因子在进化上亲缘关系很近,大都属于同一个进化分支,统称其为SNAC(stress-responsive NAC)[15]。EgrNAC1 也 属 于SNAC类转录因子,为SNAC-A 亚类[19]。该亚类中的成员广泛参与植物的低温、干旱、高盐和氧化胁迫等逆境响应[15]。拟南芥中的ANAC019、ANAC055、ANAC072 和ATAF1 都属于该类成员,均受干旱和高盐的强烈诱导[27-28]。同时,超表达ANAC019、ANAC055 和ANAC072 的拟南芥转基因株系还显著增强了对干旱的耐受性[29]。而ATAF1 被认为是非生物逆境响应的负调控因子,突变体ataf1 对干旱的耐受性强于野生型,同时,超表达ATAF1 的转基因拟南芥株系对ABA、高盐和氧化逆境的敏感性也增强[27]。水稻中属于SNAC-A 亚类的SNAC1、SNAC2 和OsNAC3 ~5 也都被高盐、干旱、低温和ABA 诱导,水稻中超表达SNAC1能提高转基因植株对干旱的抵抗能力,同时增加植株对ABA 的敏感性[30]。这表明SNAC-A 类的NAC 类转录因子广泛参与了植物的非生物逆境响应过程。而EgrNAC1 同样表现出明显的非生物逆境响应,其在低温、干旱、高盐和ABA 处理后的表达都表现出明显诱导效应[19]。
本研究在EgrNAC1 表达分析基础上,通过超表达载体构建和拟南芥的异源转化,进一步分析了EgrNAC1 在非生物逆境响应中发挥的功能,结果表明,超表达EgrNAC1 的转基因拟南芥纯合株系,对ABA的敏感性降低,对高盐和干旱处理的敏感程度增强。同时,转基因株系对低温的抵抗能力却大幅度增强。-6℃冻害处理12 h 后的存活率,相当于对照的29.6%,转基因株系存活率达到80% 以上,表明EgrNAC1 对不同的非生物逆境产生的响应不同。很多植物中的NAC 类转录因子也有类似的现象,如南荻(Miscanthus lutarioriparius)MlNAC5 基因的超表达,提高了转基因拟南芥株系对NaCl 的敏感性,但同时增强了植株的抗寒与抗旱能力[31]。GmNAC2 在烟草中超表达后,转基因植株对干旱、高盐和低温的敏感性都增强,但抵抗氧化逆境的能力得到大幅度提高[32]。水稻OsNAC095 在干旱和低温逆境中发挥的功能也表现出双面性,抑制OsNAC095 的表达能够提高水稻植株的抗旱性能,却降低了其对低温的耐受能力[33]。这反应了NAC 类转录因子在植物非生物逆境响应中功能的复杂性。EgrNAC1 可能也具有这种特点,对干旱、高盐和低温有不同的响应。
在非生物胁迫条件下,EgrNAC1 与很多植物中的NAC 类基因也有不同的表现。如水稻中超表达SNAC1 提高对ABA 的敏感性,在干旱信号产生时迅速关闭气孔,降低了组织内部水分损失,进而提高植株的抗旱性[30,34]。小麦(Triticum aestivum)TaNAC29 也有类似特征[35]。但柠条(Caragana intermedia)CiNAC3和CiNAC4 基因超表达株系却降低了对ABA 的敏感性,其耐盐性提高[28]。EgrNAC1 超表达拟南芥植株对ABA 敏感性降低,同时对干旱、高盐的敏感性增强。超表达EgrNAC1 拟南芥植株抗旱能力减弱可能是由于其对ABA 敏感性降低,导致干旱时植株叶片不能及时接收ABA 信号,气孔关闭延迟而导致植株抵抗干旱的能力下降,这也与叶片离体试验结果吻合。
ICE-CBF 途径是植物响应低温逆境,调控低温胁迫适应性的重要分子途径[36-37]。研究表明,NAC 类转录因子也通过参与该条途径调控植物对低温胁迫的响应。香蕉(Musa acuminata)中的MaNAC1 是MaICE1的直接调控蛋白,同时还与MaCBF1 互作影响香蕉植株对低温的响应[38]。蒺藜苜蓿(Medicago truncatula)中MfNAC3 则可直接结合在MfNAC3 的启动子上,作为一个正向调控因子调控植株的低温逆境响应[39]。大豆GmNAC20 还可以直接结合在低温响应下游基因RD29A的启动子上发挥作用[10]。本试验对低温处理下EgrNAC1 超表达转基因拟南芥株系中ICE-CBF 途径及低温响应的部分下游基因的表达进行了分析,发现转基因株系中2 个CBF基因AtCBF1 和AtCBF2,以及AtRD29A的表达量相对于野生型都有显著升高,表明超表达株系低温抗性提高很可能与EgrNAC1 对ICE-CBF 途径基因的调控有关。
由于NAC 类转录因子处于多个非生物逆境信号交叉互作的位置,NAC 接受到不同的逆境信号后,会通过与其他响应蛋白的互作调控不同的下游基因,产生不同响应,从而导致NAC 基因功能的复杂性。EgrNAC1 可能也具有这种特性。因此,进一步研究EgrNAC1 在桉树中参与ABA 信号转导与低温、干旱和高盐逆境信号之间的交叉互作和调控机制,对了解其在桉树抗逆中的地位及应用具有重要意义。
4 结论
巨桉中受低温、干旱、高盐和ABA 诱导表达的EgrNAC1,其超表达转基因拟南芥株系对ABA 的敏感性下降。转基因植株抗寒性显著增强,但提高了对干旱和高盐的敏感性。基因表达结果表明,EgrNAC1 参与低温抗性增强效应可能与EgrNAC1 对ICE-CBF 途径基因的调控有关。因此,EgrNAC1 可能参与了巨桉低温、干旱和高盐等非生物逆境的响应过程。这些结果有利于进一步研究和明确EgrNAC1 在桉树中的功能和调控机制,为桉树抗逆分子辅助育种工作提供了理论依据。

