胎盘CD68、PD⁃1、IL⁃10与妊娠并HCV感染关系及对母婴结局的影响
李瓅 周亚丹 高利伟
相关研究显示,母婴垂直传播是慢性丙型肝炎病毒(Hepatitis C virus,HCV)感染患儿的重要传播途径之一[1⁃4],发生风险可达10%[5],多通过宫内、产道感染。HCV 母婴传播机制较为复杂,研究已证实机体固有免疫、获得性免疫共同参与HCV感染过程[6]。鉴于胎盘组织中免疫机制在妊娠并HCV 感染中的作用尚未完全明确,本研究综合分析胎盘CD68、PD⁃1、IL⁃10 与妊娠并HCV 感染关系及对母婴结局的影响,报道如下。
1 资料和方法
1.1 一般资料
选取本院2016年10月至2019年10月妊娠并HCV 感染患者116 例作为观察组,另选取同期正常妊娠孕妇58 例作为对照组。纳入标准:①观察组产前均经酶联免疫吸附试验(ELISA)法、荧光定量PCR 法检测显示HCV 呈阳性;②对照组产前均经血清学ELISA 法、荧光定量PCR 法等检测显示HCV 呈阴性;③两组均为单胎妊娠;④患者及家属均签署知情同意书。排除标准:①近期有HCV 相关治疗者;②爆发性肝衰竭黄疸者;③药物性肝炎或乙型肝炎病毒、甲型肝炎病毒等其他病毒性肝炎者。两组基本资料均衡可比(P>0.05),见表1。本研究经院医学伦理委员会审批同意。
1.2 方法
1.2.1 胎盘IL⁃10 检测方法
胎盘娩出后,5 min 内严格遵照无菌操作规范采集1 cm3母体面脐带根部胎盘组织:生理盐水冲洗2~3 次后,电子天平称重,加入生理盐水50 mg/mL,低温环境下手动研磨标本、生理盐水混合液,均匀后加入2.5 mL EP 管内,3 000 r/min,4℃低温离心20 min,收集上清液,-70℃保存待检。采用ELISA 法检测胎盘组织匀浆中IL⁃10 水平,试剂盒购自上海岚派生物科技有限公司。
表1 两组一般资料比较(±s)Table 1 Comparison of general data between two groups(±s)
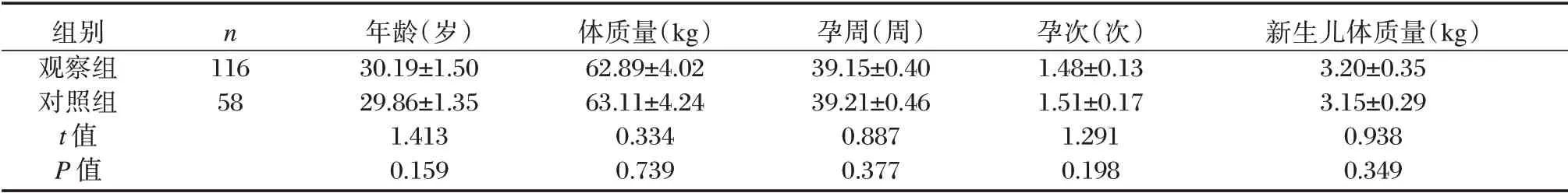
表1 两组一般资料比较(±s)Table 1 Comparison of general data between two groups(±s)
组别观察组对照组t 值P 值n 116 58年龄(岁)30.19±1.50 29.86±1.35 1.413 0.159体质量(kg)62.89±4.02 63.11±4.24 0.334 0.739孕周(周)39.15±0.40 39.21±0.46 0.887 0.377孕次(次)1.48±0.13 1.51±0.17 1.291 0.198新生儿体质量(kg)3.20±0.35 3.15±0.29 0.938 0.349
1.2.2 胎盘CD68、PD⁃1 检测方法
采用全自动免疫组化染色仪(型号:MY⁃AU60)以免疫组织化学染色法测定胎盘CD68、PD⁃1阳性细胞数,仪器及试剂盒均购自上海永创医疗器械有限公司,石蜡包埋,切片,二甲苯梯度脱蜡,酒精梯度脱水,微波抗原修复,使用双氧水(H2O2,3%)清除内源性过氧化物酶,滴加抗体,显色,酒精梯度脱水,二甲苯透明,中性树胶封片。判读标准[7]:光学显微镜下探查切片染色情况,细胞浆及细胞核内有棕黄色颗粒视为阳性,并根据染色强度进行分级。0 分,胞内无染色、染色不清,与背景颜色一致,均为均匀淡黄色;1分,细胞浆及细胞核内可见少量淡黄色颗粒,并超出背景颜色;2 分,细胞浆及细胞核内可见较多深棕色颗粒;3 分,细胞浆及细胞核内可见大量深棕色颗粒。阳性细胞百分率:无阳性细胞为0 分;阳性细胞百分率<25.0%为1 分;25.0%≤阳性细胞百分率≤50.0%为2分;阳性细胞百分率>50.0%为3分。染色强度分级与阳性细胞百分率分级相乘积分≥2分表示阳性表达。
1.2.3 HCV 载量检测方法
采用全自动PCR 检测仪(型号:SLAN®⁃48P)以RT⁃PCR 法检测HCV 载量,仪器及试剂盒均购自上海宏石医疗科技有限公司,严格按照仪器、试剂盒说明书执行。
1.3 观察指标
①比较两组胎盘CD68、PD⁃1阳性细胞数及IL⁃10水平。②观察组不同病毒载量患者胎盘CD68、PD⁃1 阳性细胞数及IL⁃10 水平。③比较两组母婴结局。④观察组不同胎盘CD68、IL⁃10、PD⁃1 表达患者母婴结局。⑤分析胎盘CD68、IL⁃10、PD⁃1 与HCV 病毒载量相关性。
1.4 统计学方法
采用SPSS 22.0 统计学软件处理数据;符合正态分布计量资料以()表示,两两比较采用t检验,偏态分布数据以M(P25⁃P75)表示,组间比较用Mann⁃Whitney U 检验;计数资料用n(%)表示,行χ2检验;采用Pearson 进行线性相关性分析,P<0.05 为差异有统计学意义。
2 结果
2.1 两组胎盘CD68、PD⁃1 阳性细胞数及IL⁃10 水平比较
观察组胎盘CD68、PD⁃1 阳性细胞数低于对照组,IL⁃10 高于对照组,差异有统计学意义(P<0.05),见表2、图1。
2.2 观察组不同HCV 病毒载量患者胎盘CD68、IL⁃10、PD⁃1 水平比较
观察组116 例妊娠并HCV 感染患者平均HCV 病毒载量为(5.18±0.75)l gIU/mL。根据此水平分为高病毒载量患者与低病毒载量患者。高病毒载量患者胎盘CD68、PD⁃1 阳性细胞数低于低病毒载量患者,IL⁃10 高于低病毒载量患者,差异有统计学意义(P<0.05),见表3。
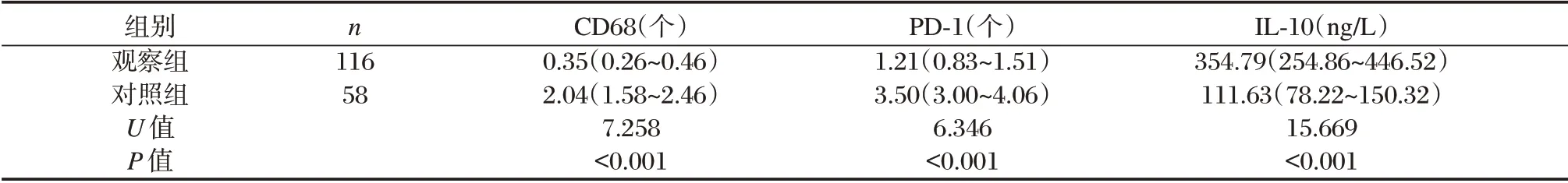
表2 两组胎盘CD68、PD⁃1 阳性细胞数及IL⁃10 水平比较Table 2 Comparison of placenta CD68,PD⁃1 positive cells and IL⁃10 levels in placenta between the two groups

图1 胎盘CD68、PD⁃1 免疫组织化学染色图(SP,×200)Figure 1 immunohistochemical staining of placenta CD68 and PD⁃1 in placenta(SP,×200)
2.3 两组母婴结局比较
观察组产妇、新生儿不良结局发生率高于对照组,差异有统计学意义(P<0.05),见表4。
2.4 观察组不同胎盘CD68、IL⁃10、PD⁃1 表达患者母婴结局比较
根据观察组胎盘CD68、IL⁃10、PD⁃1 表达均数为界,分为高表达、低表达患者。胎盘CD68、PD⁃1高表达患者产妇、新生儿不良结局发生率低于低表达患者,IL⁃10 高表达患者产妇、新生儿不良结局发生率高于低表达患者,差异有统计学意义(P<0.05),见表5。
2.5 胎盘CD68、IL⁃10、PD⁃1 与HCV 病毒载量相关性
胎盘CD68、PD⁃1 阳性细胞数与HCV 病毒载量呈负相关(r1=-0.741,P1<0.001;r2=-0.644,P2<0.001),IL⁃10 水平与HCV 病毒载量呈正相关(r3=0.561,P3<0.001),见图2。

表3 两组胎盘CD68、PD⁃1 阳性细胞数及IL⁃10 水平比较Table 3 Comparison of placenta CD68,PD⁃1 positive cells and IL⁃10 levels in placenta of two groups

表4 两组产妇结局比较[n(%)]Table 4 Comparison of maternal and neonatal outcomes between 2 groups[n(%)]
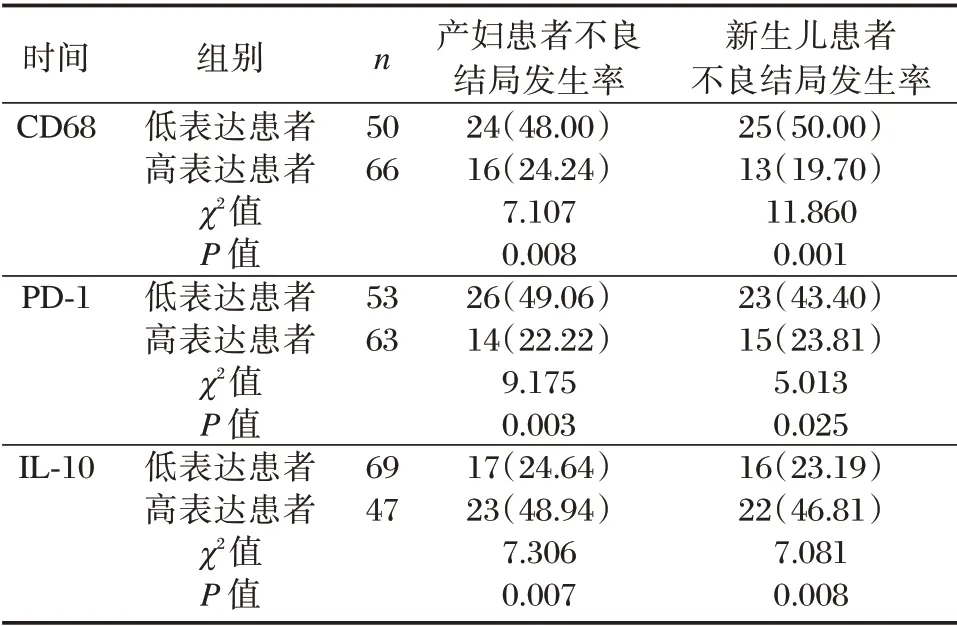
表5 观察组不同胎盘CD68、IL⁃10、PD⁃1 表达患者产妇及新生儿结局比较[n(%)]Table 5 Comparison of maternal and neonatal outcomes of patients with different placental CD68,IL⁃10 and PD⁃1 expression in observation group[n(%)]

图2 胎盘CD68、IL⁃10、PD⁃1 与HCV 病毒载量相关性Figure 2 Correlation between placenta CD68,IL⁃10,PD⁃1 and HCV viral load in placenta
3 讨论
本研究通过免疫组织化学染色法可知,观察组胎盘CD68、PD⁃1 阳性细胞数低于对照组。提示胎盘CD68、PD⁃1 可能参与妊娠并HCV 患者发生、发展。CD68 是一种以巨噬细胞为主的炎症细胞,在细胞摄粒作用、溶酶体运输过程中扮演重要角色[8]。PD⁃1 及其主要配体PD⁃L1 是负性共刺激信号之一,可负向调控T 细胞介导的免疫反应,甚至形成免疫耐受[9]。提示HCV 感染一定程度会降低胎盘免疫功能,引发自身免疫应答,进而抑制胎盘CD68、PD⁃1 表达,而胎盘CD68、PD⁃1 低表达会破坏胎儿抵御病原体侵入的第一层免疫屏障,难以识别病毒,从而导致病毒免疫逃逸,诱发HCV 持续感染。另外,本研究还发现,高病毒载量妊娠并HCV 患者胎盘CD68、PD⁃1 阳性细胞数低于低病毒载量患者,可能归因于HCV 分泌相关病毒抗原激活肝脏免疫抑制效应,导致巨噬细胞出现低反应性,影响抗原提呈过程,进而为HCV 藏匿、复制提供场所及传播媒介,增加HCV 垂直传播风险[10]。本研究进一步分析,胎盘CD68 高表达患者产妇、新生儿不良结局发生率低于低表达患者,这可能是由于母体肝脏共同承担产妇及胎儿解毒及代谢作用,而胎盘CD68 低表达可能会引发HCV 持续感染,加重肝功能损伤,降低醛固酮灭活能力,增加子宫收缩频率、程度,进而增加产妇、新生儿不良结局发生风险。然而,胎盘PD⁃1 低表达对妊娠并HCV 感染患者母婴结局的影响机制尚未完全明确,结合既往研究结果[11]推测可能与PD⁃1/PD⁃L1信号通路调节Treg/Th17 细胞平衡,引发母胎免疫耐受有关。
病毒感染者外周血中存在Th1/Th2 偏移现象,主要表现为Th2 型免疫应答。本研究经ELISA 法检测发现,高病毒载量患者胎盘IL⁃10 高于低病毒载量患者,可见胎盘IL⁃10 表达与妊娠并HCV 感染病毒载量存在一定关系。IL⁃10 是母胎界面最主要的Th2 型细胞因子,既可促进Th2 分化增殖,又能抑制Th1 分化增殖。这可能归因于胎盘IL⁃10水平上调通过免疫抑制,导致Th1/Th2 细胞因子平衡偏移,从而抑制HCV 特异性免疫应答,减弱机体抗炎及抗病毒能力,增加胎盘HCV 病毒清除难度,引发HCV 感染。本研究还指出,胎盘IL⁃10 高表达患者产妇、新生儿不良结局发生率高于低表达患者,这可能归因于胎盘IL⁃10 高表达一方面可促使胎盘大量分泌肿瘤坏死因子⁃α,增加胎盘局部及血循环中炎症浓度,进而增强免疫排斥反应,降低母体免疫耐受,影响产妇结局;另一方面机体Th1/Th2偏移,可抑制肝细胞能量代谢,加重肝脏功能损伤,增强母体对胎儿免疫排斥,导致围产儿死亡。
综上可知,胎盘CD68、PD⁃1 表达下降、IL⁃10 表达升高可能参与胎盘抗病毒免疫,诱导妊娠并HCV感染持续存在,从而对母婴结局产生不良影响。

