根癌农杆菌介导的少孢节丛孢菌遗传转化体系研究
黄运福,贡莎莎,孟庆玲*,乔 军 ,张国武,王熙凤,才学鹏
(1.石河子大学动物科技学院,新疆 石河子 832003; 2.中国兽医药品监察所,北京 100081)
捕食线虫性真菌(nematode-trapping fungi)是一类通过产生复杂的捕食结构来捕获和杀死线虫的丝状真菌,也是自然界中线虫重要的天敌和生防资源[1]。少孢节丛孢菌(Arthrobotrysoligospora)是捕食线虫性真菌中极具应用潜力的代表菌,是研究最多、应用最广的生防真菌之一[2]。目前,对少孢节丛孢菌的分子背景研究较为清楚,其全基因组的测序成功[3]为在分子水平研究少孢节丛孢菌以及菌株改造奠定了基础。
遗传转化是进行新基因功能研究和菌种改良的重要手段。丝状真菌转化方法有CaCl2-PEG介导转化法、电击转化法、限制酶介导整合法、醋酸锂转化法、基因枪法等,但这些转化方法或涉及原生质体的制备和再生,或花费高昂、应用范围窄,或转化效率低、遗传不稳定等,这些不足限制了它们在真菌研究中的应用[4]。根癌农杆菌介导的转化法(Agrobacteriumtumefaciens-mediated transformation,ATMT)利用农杆菌将供体质粒中转移的DNA(T-DNA)插入到宿主基因组中,具有操作简单、受体广泛、单拷贝插入、转化效率高和遗传稳定等优点,因此成为丝状真菌遗传转化的有效方法[5]。ATMT技术已经成功应用于黄曲霉菌[6]、指状青霉菌[7]、双孢蘑菇[8]等多种丝状真菌的转化。目前,少孢节丛孢菌成熟的遗传转化方法为以原生质体为受体的CaCl2-PEG介导法[9]和限制酶介导整合法[10-11],但以原生质体为受体的转化本身具有的缺点限制了它的应用,因此探索并建立一套高效稳定的遗传转化体系对于少孢节丛孢菌的分子生物学研究具有重要意义。本研究拟利用ATMT技术转化少孢节丛孢菌并优化其转化体系,为少孢节丛孢菌功能新基因的研究及菌株改良奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 少孢节丛孢菌新疆分离株XJ-A1、EscherichiacoliDH5α菌株、根癌农杆菌AGL-1、EHA105和GV3101菌株、pAN7-1质粒、pCAMBIA1304质粒、pMD19-PtrpC质粒,石河子大学动物科技学院预防兽医学实验室(以下简称本实验室)保存;真菌表达载体pCAMBIA1304'-PgpdA,本实验室构建。
1.1.2 主要试剂 限制性内切酶、pMD19-T(simple)、DNA标准DL 10 000,宝生物工程(大连)有限公司产品;Biospin真菌基因组DNA提取试剂盒,杭州博日科技有限公司产品;2×TaqPCR Mix,广州东盛生物科技有限公司产品; DNA标准DL 600、DNA标准DL 2 000、DNA标准DL 5 000、DNA标准DL 15 000,北京全式金生物技术有限公司产品;质粒小提试剂盒、琼脂糖凝胶电泳回收试剂盒,天根生化科技(北京)有限公司产品;GUS染色试剂,北京华越洋生物科技有限公司产品;利福平、头孢霉素、卡那霉素、乙酰丁香酮,Sigma公司产品;潮霉素,Roche公司产品;其他化学试剂均为国产分析纯;LB培养基、PDA培养基、基础培养基(MM)、诱导培养基(IM)及共培养基(CM)按照常规方法制备。
1.1.3 主要仪器设备 恒温摇床(ZHWY-2102C),PCR仪(TC4000),真菌培养箱(MJX280),恒温培养箱(HIQ-X100),振荡培养箱(ZHWY-2102C),常规离心机(Beckmanmicrofuge16),琼脂糖水平电泳仪(DYCP-31DN),凝胶成像仪(Bio-Rad),全波长酶标仪(Thermo,MuLtiskanGO),生物显微镜(CX21BIM)。
1.2 方法
1.2.1 少孢节丛孢菌对潮霉素选择压敏感性测定 将少孢节丛孢菌接种于PDA固体培养基上,于28 ℃培养14 d后收集分生孢子,吸取10 μL孢子悬浮液滴于含有0、50、100、150、200 mg/L潮霉素的PDA固体培养基,于28 ℃培养7 d后观察真菌生长情况。
1.2.2 真菌表达载体的构建 通过融合PCR获得PtrpC-hph片段。以pMD19-PtrpC质粒为模板,克隆363 bp的PtrpC启动子序列(引物:PtrpCF:5'-CGAGCTCTACGTACAGAAGATGATATTG-3' ; PtrpCR: 5'-CGCGGTGAGTTCAGGCATATGCTTGGGTAGAATAGG-3',上游引物引入SacⅠ酶切位点)。以质粒pAN7-1为模板,克隆1 020 bp的潮霉素磷酸转移酶基因hph序列(引物:hphF:5'-CCTATTCTACCCAAGCATATGCCTGAACTCA
CCGCG-3';hphR:5'-CCTCGAGCTATTCCTTTGCCCTCGG-3',下游引物引入XhoⅠ酶切位点)。再以PtrpC和hph片段为模板,用引物PtrpCF和hphR进行PCR扩增得到PtrpC-hph片段,克隆至pMD19-T载体。对测序正确的质粒用限制性内切酶SacⅠ和XhoⅠ进行双酶切得到PtrpC-hph片段,与同样用限制性内切酶SacⅠ和XhoⅠ双酶切质粒pCAMBIA1304得到的大片段连接,构建出真菌表达载体pCAMBIA1304'。
以质粒pAN7-1为模板,克隆2 129 bp的PgpdA启动子序列(引物:PgpdAF:5'-GCTCTAGAGAATTCCCTTGTATCTCTACAC-3';PgpdAR:5'-CATGCCATGGGAAAAGAAAGAGAAAAG-3',上游引物引入XbaⅠ酶切位点,下游引物引入NcoⅠ酶切位点),克隆至pMD19-T载体。对测序正确的质粒用限制性内切酶XbaⅠ和NcoⅠ进行双酶切得到PgpdA启动子片段,与同样用限制性内切酶XbaⅠ和NcoⅠ双酶切质粒pCAMBIA1304'得到的大片段连接,构建出真菌表达载体pCAMBIA1304'-PgpdA,用限制性内切酶SacⅠ和XhoⅠ、XbaⅠ和NcoⅠ进行双酶切鉴定。
表达载体pCAMBIA1304'-PgpdA通过冻融法转化农杆菌,对在含有100 mg/L卡那霉素的LB固体培养基上生长的单克隆菌株通过PCR扩增hph基因进行验证。
1.2.3 根癌农杆菌介导的少孢节丛孢菌遗传转化 农杆菌介导的少孢节丛孢菌遗传转化体系为:以农杆菌AGL-1、EHA105和GV3101为浸染菌株,转化受体为少孢节丛孢菌分生孢子,少孢节丛孢菌孢子悬浮液浓度为1×106个/mL和1×108个/mL,乙酰丁香酮浓度为200 μmol/L,共培养温度为23 ℃和26 ℃,共培养时间为48 h和60 h。按以下步骤进行转化:将含有表达载体pCAMBIA1304'-PgpdA的农杆菌置于10 mL含有50 mg/L利福平和100 mg/L卡那霉素的LB液体培养基中,28 ℃、200 r/min过夜培养,收集菌体后用3 mL IM培养基重悬至浓度为OD 600 nm为0.15~0.2,继续培养至OD 600 nm为0.5~1.0。取100 μL经过预培养的农杆菌菌液与少孢节丛孢菌孢子悬浮液等体积混合,涂布于CM培养基表面的微孔滤膜,置于避光环境进行共培养。
1.2.4 重组少孢节丛孢菌的筛选 将共培养基表面的微孔滤膜倒贴到含有400 mg/L头孢霉素和150 mg/L潮霉素的PDA固体培养基上,28 ℃培养24 h后用无菌镊子轻轻揭掉微孔滤膜,继续培养7 d~9 d。将长势良好的少孢节丛孢菌转接到新的含有400 mg/L头孢霉素和150 mg/L潮霉素的PDA固体培养基上进行复筛。
1.2.5 重组少孢节丛孢菌的鉴定及遗传稳定性分析 按照杭州博日科技有限公司Biospin真菌基因组DNA提取试剂盒说明提取在含潮霉素抗性的PDA固体培养基上生长良好的少孢节丛孢菌的基因组DNA,扩增hph和gus基因进行验证。将PCR检测的阳性转化子分别接种于PDA固体培养基上培养7 d,从边缘挑取菌丝接种于PDA固体培养基上进行5次传代培养,再次将少孢节丛孢菌转化子转入含150 mg/L潮霉素的PDA固体培养基上培养,提取正常生长的转化子基因组DNA,PCR扩增hph和gus基因进行验证。
1.2.6 重组少孢节丛孢菌GUS活性分析 将转化子及出发菌株分别接至PDA固体培养基上,培养4 d后切取菌块进行GUS染色,将菌块置于Ep管中,加入一定量的GUS染液将菌块完全浸泡,于37 ℃闭光24 h,在显微镜下观察染色结果。
2 结果
2.1 少孢节丛孢菌对潮霉素选择压力敏感性测定
对不同浓度潮霉素抗性PDA固体培养基上生长7 d的少孢节丛孢菌生长情况观察,少孢节丛孢菌在潮霉素浓度为150 mg/L时完全停止生长,因此选择150 mg/L作为筛选浓度(图1)。
2.2 真菌表达载体的构建与鉴定
通过融合PCR扩增得到PtrpC-hph片段,经琼脂糖凝胶电泳分析,PtrpC启动子序列约为363 bp(图2A),PtrpC-hph片段约为1 383 bp(图2B),hph基因约为1 020 bp(图2C),PgpdA启动子序列约为2 129 bp(图2D)。将PtrpC-hph片段和PgpdA启动子片段先后插入pCAMBIA1304质粒得到真菌表达载体pCAMBIA1304'-PgpdA,表达载体经限制性内切酶SacⅠ和XhoⅠ、XbaⅠ和NcoⅠ双酶切鉴定可得到大小约1 383 bp(图3A)和2 129 bp(图3B)的条带,证实成功构建了真菌表达载体。
2.3 表达载体转化农杆菌
将构建的表达载体 pCAMBIA1304'-PgpdA通过冻融法转化农杆菌AGL-1、EHA105和GV3101后,各挑取2颗单菌落通过PCR扩增hph基因,证实质粒成功转入农杆菌中(图4)。

A~E.0、50、100、150、200 mg/L

A.PtrpC;B.PtrpC-hph;C.hph;D.PgpdA;M1.DNA标准DL 600;M2.DNA标准DL 2 000;M3.DNA标准DL 5 000;1~3.PCR扩增产物;4.阴性对照

M1.DNA标准DL 15 000;M2.DNA标准DL 10 000;1.双酶切对照;2.重组质粒双酶切(SacⅠ和Xho Ⅰ);3.双酶切对照;4.重组质粒双酶切(XbaⅠ和Nco Ⅰ)

M.DNA 标准DL 2 000;1~2.GV3101;3~4.EHA105;5~6.AGL-1;7.阴性对照
2.4 重组少孢节丛孢菌的筛选与分子鉴定
揭掉微孔滤膜培养4 d后,发现含头孢霉素和潮霉素抗性的PDA固体培养基上长出许多密集成片的真菌,继续培养数天,结果农杆菌AGL-1介导的转化在1×106个/mL孢子悬浮液,共培养阶段为23 ℃培养60 h的条件下有1株转化子能正常生长,将其转接至含150 mg/L潮霉素的PDA固体培养基培养,其长势良好(图5A)。提取该菌株基因组DNA进行hph和gus基因的PCR检测,结果能扩增出hph和gus基因片段(图5B)。
2.5 重组少孢节丛孢菌的遗传稳定性分析
少孢节丛孢菌转化子在无潮霉素选择压力的PDA固体培养基上连续传代培养5代次后,再次转入含有150 mg/L潮霉素的培养基中进行培养。对转化子提取基因组DNA进行hph和gus基因的PCR检测,结果从转化子可以扩增出hph和gus基因的目的条带,表明hph和gus基因在重组少孢节丛孢菌中可以稳定遗传(图6)。
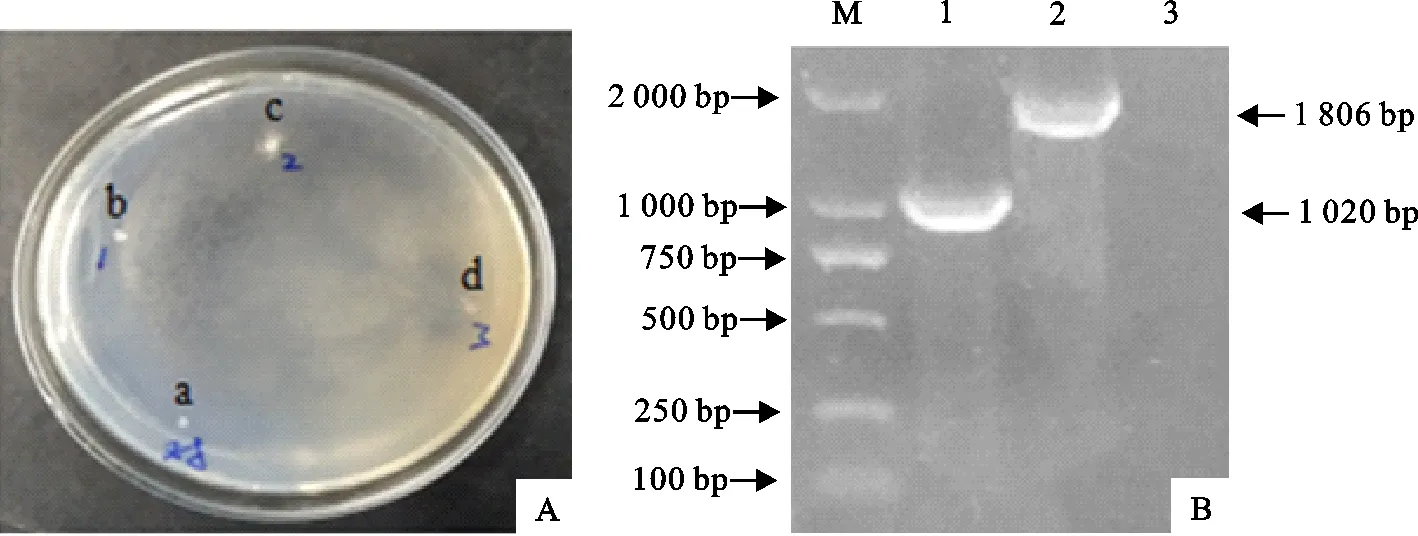
A.菌落;B.PCR;a.出发菌株;b-c.假阳性菌株;d.阳性转化子;M.DNA标准DL 2 000;1.hph基因;2.gus基因;3.阴性对照
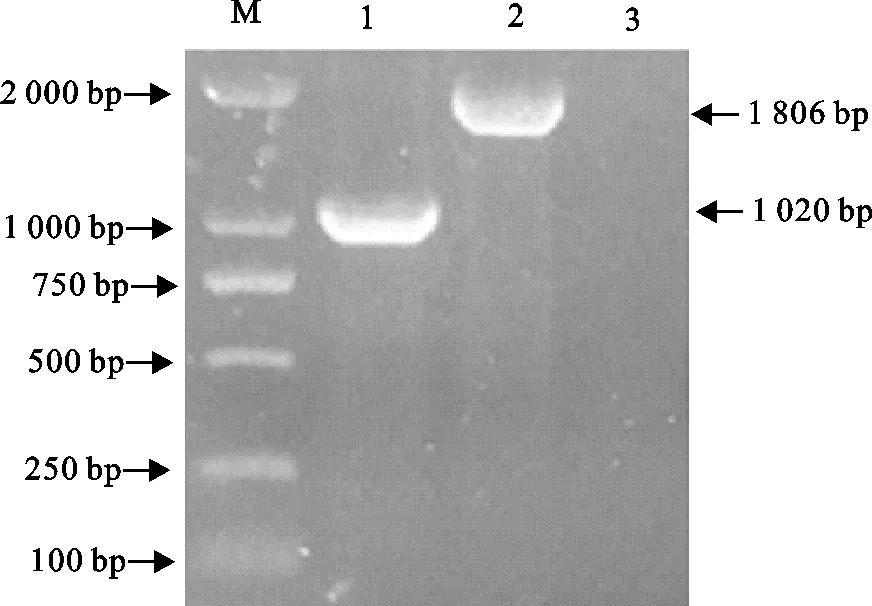
M.DNA 标准DL 2 000;1.hph基因;2.gus基因;3.阴性对照
2.6 重组少孢节丛孢菌gus基因活性分析
分别将转化子和对照菌株接种到PDA固体培养基上,培养4 d后进行GUS染色。如图7所示,出发菌株并未染色(图7A),转化子有明显蓝色(图7B),表明gus基因被整合到少孢节丛孢菌基因组中并在PgpdA启动子调控下正常表达。
3 讨论
Gus基因在许多真菌、细菌等微生物中很少或完全检测不到活性,因此也应用于如棉花黄萎病菌[12]、莱氏野村菌[13]和金针菇[14]等多种真菌的转化试验。Tunlid A等[10]通过限制酶介导整合法将携带gus基因的质粒转化少孢节丛孢菌,在16株转化子中有10株检测到GUS活性,说明gus基因能做为少孢节丛孢菌转化试验的报告基因。

A.出发菌株;B.转化子
ATMT是一种高效转化丝状真菌的有力工具,其介导的真菌遗传转化过程基本相同,但转化效率取决于真菌受体、农杆菌菌株类型、乙酰丁香酮的浓度、农杆菌和真菌受体的比例以及共培养温度和时间[15];此外,还受到孢子浓度、诱导培养基、培养方式、pH等因素的影响。通过优化这些影响条件,很多真菌实现了更高的转化率[16]。ATMT介导的少孢节丛孢菌转化甚少报道,刘瑞[17]利用 ATMT技术在以孢子悬浮液、菌块悬浮液、菌丝溶液和原生质体溶液为受体,农杆菌AGL-1为浸染菌株,孢子浓度为1×105个/mL,共培养条件为22 ℃培养48 h的转化体系对少孢节丛孢菌云南株YMF1.1883进行转化,结果获得了3株转化子。在本研究中,经过多次重复试验,农杆菌AGL-1介导的转化在1×106个/mL孢子悬浮液,共培养阶段为23 ℃培养60 h的条件下获得了1株转化子。尽管优化的转化体系不尽相同,但转化率基本相同,与利用限制酶介导整合法转化少孢节丛孢菌获得35个/μg DNA[11]的最大转化率相比,ATMT介导的少孢节丛孢菌遗传转化可能更难以实现,这可能是由影响ATMT转化效率的多种因素造成的,也可能是少孢节丛孢菌不适合采用ATMT进行转化,这有待于进一步研究。
本研究利用ATMT对少孢节丛孢菌进行了转化,证实ATMT可以应用于少孢节丛孢菌的转化,为少孢节丛孢菌的生防机制、遗传转化及菌株改良等研究奠定了基础。