2019年福建某原种猪场猪繁殖与呼吸综合征病毒流行毒株ORF5基因的遗传变异分析
林楚云,刘建奎,林志锋,林日丹,杨小燕*,戴爱玲*
(1.福建农林大学动物科学学院,福建福州 350002;2.龙岩学院生命科学学院,福建龙岩 364000;3.福建省生猪疫病防控工程技术研究中心,福建龙岩 364000)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种严重危害养猪产业的重要病毒性传染病[1]。PRRSV为单股正链RNA病毒,基因组全长15 kb,至少包含10个开放阅读框(open reading frame,ORF),其中ORF1中的Nsp2、ORF3、ORF5a和ORF5等基因高度变异,而ORF5基因的变异情况在很大程度上可以反映PRRSV基因组的遗传变异特征。PRRSV分为欧洲型和美洲型2种基因型,我国的流行毒株以美洲型毒株为主。PRRSV基因组存在高度的变异,先后出现经典毒株、高致病性PRRSV(HP-PRRSV)毒株及类NADC30毒株[2],给该病的防控带来了极大的挑战。
2019年11月,福建省某PRRS疫苗非免疫存栏能繁母猪700头的原种猪场,母猪先后出现早产、产弱仔,保育猪出现扎堆、嗜睡、喘气、体温升高、采食量下降等临床症状,病死率近10%。临床剖检3头保育猪,肺部可见间质性肺炎,全身淋巴结轻度水肿,其中1头出现心包炎病变。通过3头保育猪的临床特征和病理剖检,初步诊断为PRRSV感染,为进一步确诊并了解PRRSV毒株流行情况,采集2周龄~8周龄的临床疑似发病的保育猪全血,4 ℃保存,送往实验室进行PRRSV RT-PCR检测及ORF5基因序列分析。
1 材料与方法
1.1 材料
1.1.1 样本来源 样品采集于存栏700头的福建某原种猪场,采集2周龄~8周龄各周龄段临床疑似发病保育猪全血各5份,将相同周龄的5份全血各取50 μL,合为1份,并命名为2W、3W、4W、5W、6W、7W、8W。
1.1.2 试剂 总RNA提取试剂盒,北京天根生化有限公司产品;Random Primer、Oligo (dt)18 Primer、Reverse Transcriptase M-MLV反转录酶(200 U/μL)、TaKaRaTaq聚合酶(5 U/μL)、Recombinase RNase Inhibitor(40 U/μL)、DNA标准DL 1 000 、dNTP,宝生物工程(大连)有限公司产品;其他试剂均为国产分析纯。
1.1.3 引物设计与合成 按照参考文献[3]的方法设计PRRSV ORF5基因特异性引物,引物由北京睿博兴科生物技术有限公司合成,扩增目的片段大小约为700 bp。
1.1.4 仪器设备 台式高速冷冻离心机(CL31R)、二氧化碳培养箱(3111),Thermo Fisher Scientific公司产品;PCR仪(MycycLerTM)、凝胶成像系统(GeL Doc TMXR),美国Bio-Rad公司产品;超净工作台(SW-CJ-1D),苏州净化设备有限公司产品;电泳仪(DYY-2C),北京六一生物科技有限公司产品。
1.2 方法
1.2.1 病料核酸的提取 取2周龄~8周龄保育猪全血,进行RNA提取,方法参照北京天根生化有限公司总RNA提取试剂盒说明书。
1.2.2 RT-PCR 检测 RT-PCR反应如下:取16 μL的RNA,分别加入1 μL Random Primer、1 μL Oligo (dt)18 Primer,以18 μL体系用PCR仪进行70 ℃ 10 min,4 ℃ 2 min;反应结束后直接加入4 μL 5× M-MLV buffer、2 μL dNTP、1 μL RTase M-MLV、1 μL Recombinase RNase Inhibitor,以26 μL体系用PCR仪进行30 ℃ 10 min,42 ℃ 60 min,70 ℃ 15 min,4 ℃ 10 min,所得产物即为cDNA。取2 μL 模板cDNA,加入ORF5上、下游引物各1 μL,2.5 μL 10× PCR buffer,2 μL dNTP,0.2 μLTaq,16.3 μL ddH2O;PCR反应程序为:94 ℃ 5 min;94 ℃ 30 s,56.5 ℃ 30 s,72 ℃ 1 min,共35个循环;72 ℃ 10 min。同时设不加模板的阴性对照。取10 μLPCR产物用10 g/L琼脂糖凝胶电泳检测,并以DNA标准DL1 000为对照,观察目的条带和判断结果。
1.2.3 序列测定及分析 将阳性PCR产物送至生工生物工程(上海)股份有限公司进行测序。利用DNA Star软件对ORF5基因序列与GenBank中收录的PRRSV ORF5基因序列的核苷酸进行同源性分析,并应用Mega6.0软件绘制进化树。
2 结果
2.1 RT-PCR扩增结果
2周龄~8周龄保育猪全血经RT-PCR后凝胶电泳鉴定。结果显示,5W、6W、7W、8W保育猪全血均扩增出与预期大小一致的目的条带约700 bp,而2W、3W、4W保育猪全血均未扩增出与预期大小一致的目的条带(图1),表明该猪场5周龄~8周龄保育猪存在PRRSV感染。
2.2 核苷酸同源性分析
经生工生物工程(上海)股份有限公司测序并进行Blast比对,所测得的序列为PRRSV ORF5基因特异性的序列。经PRRSV ORF5基因核苷酸同源性分析,5W毒株ORF5基因与HP-PRRSV代表毒株JXA1、HuN4和TJ同源性最高为95.4%~95.6%,与VR2332和疫苗毒株Resp PRRS MLV为经典毒株代表毒株的同源性为87.4%,与谱系3代表毒株QYYZ、FJFS的同源性为82.3%~82.7%,与类NADC30 PRRSV代表毒株NADC30、FJZ03、FJY04和CHsx1401同源性为84.1%~84.6%;6W、7W、8W毒株的ORF5基因与类NADC30 PRRSV代表毒株NADC30、FJZ03、FJY04和CHsx1401同源性较高,分别为88.9%~91.1%、89.6%~91.9%和89.3%~91.6%,与VR2332和疫苗毒株RespPRRS MLV为经典毒株代表毒株的同源性分别为83.5%、83.7%和83.7%,与谱系3代表毒株QYYZ和FJFS同源性分别为83.3%~84.2%、83.5%~84.2%和83.7%~84.4%,与HP-PRRSV代表毒株JXA1、HuN4和TJ同源性分别为85.4%、85.6%和85.6%(图2)。综上所示,该猪场5W保育猪感染的是HP-PRRSV毒株,6W-8W保育猪感染的是类NADC30毒株。

M.DNA 标准DL 1 000;1.2W;2.3W;3.4W;4.5W;5.6W;6.7W;7.8W;8.阴性对照
2.3 核苷酸遗传进化树
遗传进化树表明,5W毒株与JXA1、HuN4和TJ的HP-PRRSV代表毒株处于同一分支,亲缘关系较近,而与NADC30、VR2332、QYYZ、FJFS等代表毒株处于不同分支,亲缘关系较远;6W、7W、8W毒株与NADC30、FJZ03、CHsx1401等类NADC30 PRRSV代表毒株处于同一分支,亲缘关系较近,而与JXA1、QYYZ、VR2332等代表毒株处于不同分支,亲缘关系较远(图3)。综上结果表明,该猪场5W毒株为HP-PRRSV毒株;6W、7W、8W毒株均为类NADC30毒株。

图2 PRRSV ORF5基因的核苷酸同源性分析
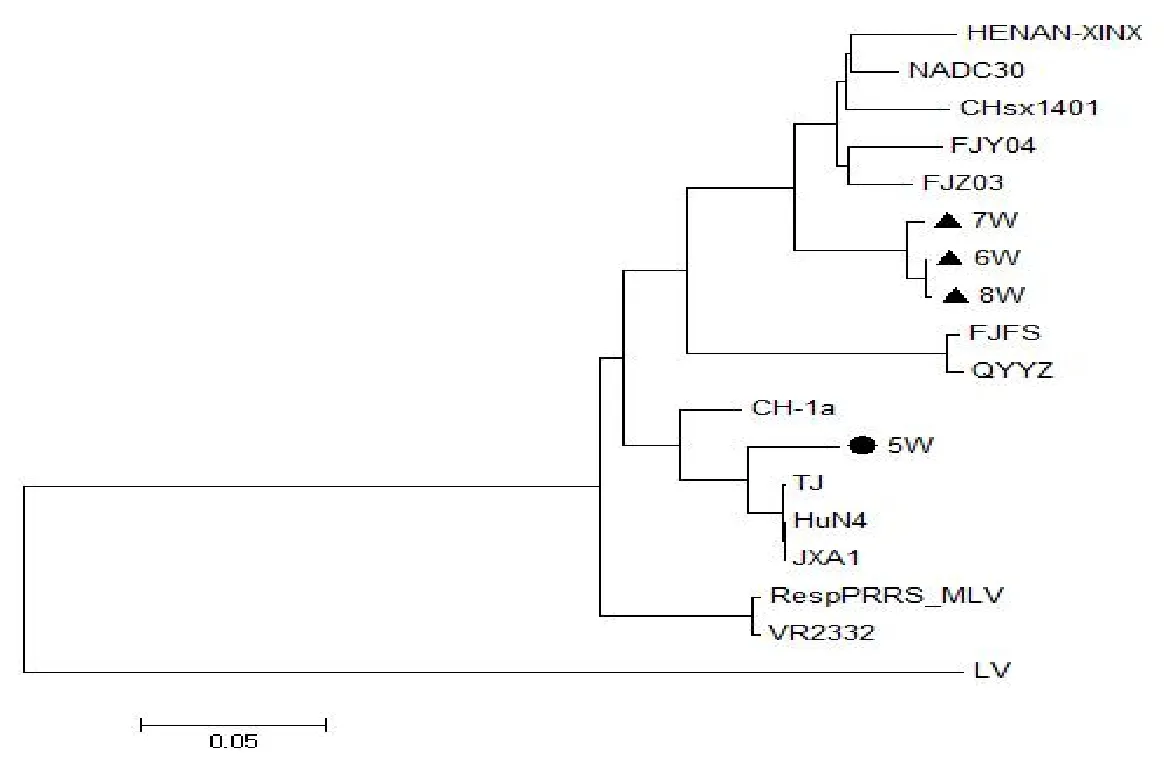
图3 PRRSV ORF5基因核苷酸的遗传进化树
3 讨论
1987年,PRRS首次在美国被发现并报道,之后迅速传播至许多国家。1995年,中国首次分离出PRRSV CH-la毒株。2006年,中国南部部分地区发现HP-PRRSV,其高致病性、高病死率给养猪业造成了巨大的损失。2001年末,美国发现PRRSV变异株,其特征是Nsp2存在131个不连续的氨基酸缺失,缺失模式为“111+1+19”。2008年,美国国家动物疾病研究中心(NADC)首次命名NADC30毒株[4-5]。自2012年起,我国陆续分离到与NADC30同源关系较近的毒株(ORF5基因同源性 97%),且具有特征性的“111+1+19”缺失模式,因此目前国内将这类病毒统称为类NADC30毒株[6]。ORF5基因编码的囊膜蛋白GP5是PRRSV 基因组中高变区之一,是PRRSV主要的糖基化囊膜蛋白及重要保护性抗原,是变异最大的结构蛋白[7]。因此,ORF5基因常作为PRRSV分子流行病学调查及变异分析的研究切入点。
本文通过对PRRSV ORF5基因进行分析,结果显示,5W保育猪全血中的PRRSV ORF5基因与HP-PRRSV代表毒株同源性最高;6W、7W、8W 保育猪全血中的PRRSV ORF5基因与类NADC30代表毒株同源性较高。结果表明,该猪场保育猪存在类NADC30和HP-PRRSV毒株混合感染。2019年,申欢欢等[8]报道了某规模化猪场存在类NADC30、HP-PRRSV和PRRSV毒株混合感染。中国是畜牧大国,复杂的饲养环境,频繁的生猪运输和不当的引种,使毒株变异频发[9],且类NADC30毒株与以往PRRSV毒株不同,该病毒与其他病毒重组率高,加重了猪场防疫的难度[10-11]。刘磊等[12]报道了2016年-2018年广西地区14个地区规模化猪场以HP-PRRSV毒株流行为主,但2018年出现了与美国NADC30处于同一分支的类NADC30毒株和与GM2处于同一分支的经典株与变异株的重组毒株。袁为锋等[13]报道了2016-2017年江西地区的美洲型毒株出现多基因亚型共存的局面,以HP-PRRSV为主,类NADC30毒株和新基因亚型等新毒株的比例较高。本课题组刘建奎等[9]报道了2013年福建省开始流行类NADC30毒株,并在2014年逐渐取代HP-PRRSV,成为优势毒株。外部环境中不同PRRSV毒株可通过多种途径入侵猪场内部,易增加猪场内猪群野毒感染和毒株变异的风险。
据笔者调查,2018年10月引种前该猪场的PRRSV抗体监测记录,母猪PRRSV抗体阳性率在40%~50%,猪场处于PRRSV阳性稳定状态。引种后备猪有采取隔离措施,但混群后猪群还是出现了不稳定状态,2019年7月监测母猪PRRSV抗体阳性率100%。本次RT-PCR检测结果显示该猪场5周龄~8周龄保育猪全血检出PRRSV,存在PRRSV病毒血症,临床上暴发比较典型的PRRS症状。据郭林等[14]跟踪与监测PRRSV抗体消长规律的结果,在未免疫任何PRRSV疫苗的猪场,PRRSV母源抗体在断奶后2周(40日龄左右)降到最低。因此,断奶后的保育猪因为母源抗体消失、自身的免疫系统还没有完善、生长速度加快、场内外PRRSV毒株情况复杂、断奶及转栏应激等多种因素使这个阶段的猪易暴发PRRS。该猪场由于受非洲猪瘟疫情的影响,为了加强生物安全,减少猪群出栏次数,存在断奶后保育猪存栏密度过大、氨气浓度过高和冬季时没有及时调整好猪舍环境等问题,进而导致保育猪群PRRS的暴发,该场没有采取紧急免疫PRRSV疫苗的措施,实行部分保育猪及中大猪的部分清群,淘汰没有治疗价值的发病猪,减少保育猪、中大猪的密度,同时添加药物控制继发感染和中药类产品提高抵抗力等措施。曲向阳[15]证明当母猪群不稳定时,感染仔猪免疫PRRSV弱毒疫苗会增加死淘率。因此,对于非免疫PRRSV疫苗猪场的猪蓝耳病的防控,首先严把引种关,尽量在同一猪场引种,保障隔离时间,监测隔离猪群的PRRSV毒株类型。在毒株型不同的情况下,尽量在抗原阴性时进行本场毒株的驯化工作;其次,猪场要建立PRRSV监测方案,降低猪场内PRRSV的污染与病毒载量,阻断病毒在猪群中间的循环与传播;最后,改善猪场设备,如增加负压空气过滤系统,它可以有效的阻断由空气传播所导致的PRRSV感染[16]。
PRRS作为危害养猪业的重要疫病,目前主要防疫措施包括生物安全、免疫策略、感染状态监控等。不管哪种防控措施,毒株多样化导致患病猪临床表现多变和疫苗保护效力不佳,都给猪场的防控造成极大的困难。毒株驯化和封群管理是PRRS防控的重要方向,但国内尚无利用该技术在区域化或大型养猪企业成功净化PRRSV的报道。

