猪A群轮状病毒荧光定量PCR检测方法的建立及应用
陈小飞,严 楠,张 斌,廖 明*
(1.华南农业大学兽医学院/人兽共患病防控制剂国家地方联合工程实验室/广东省动物原性人兽共患病防控重点实验室/农业农村部人兽共患病重点实验室,广东广州 510642; 2.西南民族大学生命科学与技术学院,四川成都 610041)
A群轮状病毒(group A rotavirus,RVA)属于呼肠孤病毒科(Reoviridae)轮状病毒属(Rotavirus),是仔猪以及其他幼龄哺乳动物胃肠炎的主要病原之一[1-4]。RVA跨越种间屏障,引起幼儿腹泻已被证实[5-7]。RVA是由11个不连续的双链RNA组成的无囊膜病毒,分别编码6个结构蛋白(VP1-VP4、VP6、VP7)和5或6个非结构蛋白(NSP1-NSP5/6)[8-10]。
据报道RVA的外衣壳蛋白VP7和VP4能诱导产生中和抗体,是构成G和P双重分型系统的核心[11],至今RVA已确立了35个G基因型和50个P基因型[12-13]。VP6是RVs基因组的核心蛋白,占病毒蛋白的50%以上,是参与介导RVA黏膜免疫反应的特异性抗原,高度保守,具有较强的诊断学意义[8-10,14]。
随着PCR应用的推广,极大地满足临床诊断的时效性需求,由于荧光定量PCR的灵敏性高,已逐渐成为金标准,用于各种疾病的检测及监控。近年来已建立了RVA PCR检测方法[15-18],但是由于RV的变异性,急需高效通用的检测方法。本研究根据最近5年来NCBI及本实验室分离鉴定并测序的结果,通过针对RVA VP6的保守序列设计引物、优化条件等建立了检测RVA的荧光定量PCR方法。
1 材料与方法
1.1 材料
1.1.1 病毒株和临床样本 猪瘟病毒(Classical swine fever virus,CSFV)疫苗株,广东永顺生物制药股份有限公司提供;猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,RRRSV)疫苗株,吉林硕腾国原动物保健品有限公司提供;猪A群轮状病毒RVA/Pig-tc/CHN/SCMY-A3/2017/G9P [23]、猪轮状病毒G9G3G4G5G26亚型、猪流行性腹泻(Porcine epidemic diarrhea virus,PEDV)、猪呼肠孤病毒(Porcine reovirus,MRV)、猪捷申病毒(Porcine teschovirus,PTV)、巴氏杆菌(Pasteurellamultocida,PM)、链球菌(Streptococcus,SS)及猪等孢球虫(Isosporasuis)核酸,西南民族大学预防兽医学实验室保存。
2018年-2019年91份仔猪腹泻粪便或肠道临床样本,来自四川省10个地区18个规模化猪场。
1.1.2 主要试剂与仪器 常规荧光定量PCR设备及试剂。
1.2 方法
1.2.1 引物的设计与合成 根据GenBank近5年来发布的猪RVA VP6基因序列进行比对,针对保守区域用Premier 5软件设计特异性引物,上游引物R:5'-TCAAGCACGATTTGGAAC-3',下游引物F:5'-TGGTATTGCGTATTCCTG-3',预期扩增产物长度为209 bp,引物由生工生物工程(上海)有限公司合成。
1.2.2 阳性RVA标准品的制备 取本实验室保存的猪A群轮状病毒RVA/Pig-tc/CHN/SCMY-A3/2017/G9P[23],按照Trizol试剂盒说明书提取总RNA,并按照PrimeScriptTMRT试剂盒说明书进行反转录合成cDNA,置-20 ℃保存备用。
以cDNA为模板对其进行PCR扩增,扩增产物经20 g/L琼脂糖凝胶电泳及凝胶成像扫描进行鉴定。将PCR阳性扩增目的条带通过胶回收、克隆、提取相应质粒,再经序列测定验证后作为本试验的阳性标准品质粒。将获得的阳性标准品经核酸蛋白测定仪定量,计算拷贝数后连续10倍梯度稀释,置-20 ℃保存备用。
1.2.3 TB Green实时荧光定量PCR反应条件的优化及标准曲线的建立 通过对反应体系中退火温度、最佳引物浓度进行优化,最佳反应条件为:95 ℃ 2 min;95 ℃ 15 s,54 ℃ 20 s,78℃ 5 s,共循环40次。优化后的20 μL最佳反应体系为:TB Green Premix ExTaqⅡ 10 μL,模版1 μL,上、下游引物(10 pmol/L)各0.5 μL,ddH2O补足20 μL。
在该反应条件下,阳性标准品10倍系列稀释(101~109)的质粒作为模板建立检测猪RVA 实时荧光定量PCR方法的标准曲线。
1.2.4 TB Green实时荧光定量PCR特异性试验 用优化的反应体系及条件检测猪RVA(G3、G4、G5、G9、G26),以及猪常见病原(CSFV、PRRSV、PEDV、MRV、PTV、PM、SS、猪等孢球虫),以检验所建立的TB Green实时荧光定量PCR方法的特异性。
1.2.5 TB Green实时荧光定量PCR重复性试验 将阳性标准质粒设3个重复,用优化好的反应条件进行检测,计算批内变异系数;将阳性质粒-20 ℃保存,每周检测1次,连续3次,计算批间变异系数。
1.2.6 TB Green实时荧光定量PCR临床检测及应用 将91份临床腹泻样本用PBS重悬,离心取上清,按Trizol法提取RNA,并反转录合成cDNA,使用本研究建立的TB Green 荧光定量PCR、文献报道的SYBR Green Ⅰ荧光定量PCR[15]检测方法和国家标准RVA普通RT-PCR检测方法[16]同时进行检测,评估本方法与以报道方法及国家标准法的符合率。
2 结果
2.1 TB Green实时荧光定量PCR标准曲线的建立
经RT-PCR扩增,得到大小约为209 bp的目的片段,与预期结果相符,测序分析显示,该片段与亲本毒株的VP6基因序列的一致性为100%,并与NCBI中其他猪源RVA VP6基因片段同源性大于90%。该阳性质粒浓度为337.1 ng/μL,1.06×1011copies/μL。
基于TB Green实时荧光定量PCR方法检测RVA阳性质粒在1.06×108copies/μL~1.06×102copies/μL有很好的线性关系,最低检测值为106 copies/μL,扩增曲线见图1。所获得标准曲线线性方程为:y=-3.519x+ 40.104,相关系数R2=0.997 5,扩增效率为92.35%,标准曲线见图2。熔解曲线(图3)显示,溶解温度Tm = 83 ℃±0.5 ℃,只产生特异性单峰,没有引物二聚体和非特异性扩增。

1~8.10倍梯度稀释的1.06×108 copies/μL~1.06×102 copies/μL的质粒标准品
2.2 TB Green实时荧光定量PCR方法的特异性试验结果
用本研究建立的TB Green实时荧光定量PCR方法仅对RVA(G3、G4、G5、G9、G26)扩增出阳性信号,对猪常见病原(如PRRSV、CSFV、PEDV、MRV、PTV、SS、PM及SC)均未检测到扩增信号(图4)。表明本研究建立的TB Green实时荧光定量PCR检测方法对猪RVA有良好的特异性,并能检测多种RVA亚型。
2.3 TB Green实时荧光定量PCR方法的重复性试验结果
TB Green实时荧光定量PCR方法检测阳性标准品1.06×103、1.06×104、1.06×105copies/μL的批内变异系数分别为1.68%、1.46%、1.94%;批间变异系数分别为1.89%、1.54%、1.22%(表1);批间和批内的变异系数均小于2%,表明该方法具有很好的稳定性和重复性。

图2 TB Green实时荧光定量PCR的标准曲线
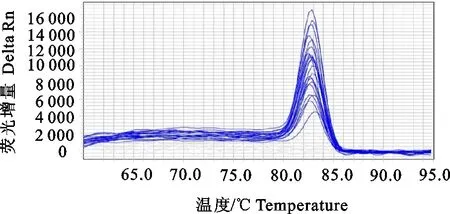
图3 RVA TB Green实时荧光定量PCR的熔解曲线
2.4 临床腹泻样本检测结果
应用本研究建立的TB Green实时荧光定量PCR方法、已报道的SYBR Green实时荧光定量PCR方法[15]和国家标准RVA普通RT-PCR方法[16]对91份临床腹泻样本检测结果表明,国家标准RVA普通RT-PCR检出11份(12.09%)RVA阳性,已报道的荧光定量PCR方法[15]检出39份(42.86%)RVA阳性,本研究建立的TB Green荧光定量PCR检测方法检出40份(43.96%)RVA阳性。已报道的两种PCR方法检测的阳性样品,TB Green实时荧光定量PCR方法检测也为阳性,本方法与已报道荧光定量PCR方法及国家标准RVA检测方法符合率为100%。对40份阳性样本进行克隆测序,结果表明均为RVA VP6核酸序列片段。

1.质粒标准品1.06×104 copies/μL;2~6.RVA阳性;7~15.PRRSV、CSFV、PEDV、MRV、PTV、SS、PM、猪等孢球虫和阴性对照

表1 批内和批间重复试验
3 讨论
猪A群轮状病毒(Group A Rotavirus,RVA)属于呼肠孤病毒科(Reoviridae)轮状病毒属(Rotavirus),是引起小孩和仔猪腹泻的主要原因[1]。无论是单纯的轮状病毒感染还是混合感染都直接或间接的影响猪群生产力,从而导致巨大的经济损失,并且已经证实猪 RVA引起幼儿腹泻[5-7]。
轮状病毒基因组由11个双链的RNA节段构成,分别编码6个结构蛋白(VP1-VP4、VP6和VP7)和6个非结构蛋白(NSP1-NSP6)。根据VP6抗原的差异将轮状病毒分为10个基因群组(A-J)[11],由于VP6基因的高度保守,所以成为国内外检查RVs的最重要分子靶点[8-10,14]。本研究根据GenBank中近5年来猪RVA VP6最新序列分析,针对保守区域设计引物,同对优化反应体系和反应条件,成功建立了TB Green荧光定量PCR检测方法。该方法特异性好,用于检测本实验保存的猪RVA亚型G3、G4、G5、G9、G26均可见特异性扩增曲线和单特异性熔解曲线,而对猪常见病原如PRRSV、CSFV、PEDV、MRV、PTV、SS、PM以及猪等孢球虫检测均为阴性;重复性高,批间、批内变异系数均小于2%;灵敏度高,对阳性标准质粒的检测下限为106 copies/μL,该方法完全能满足临床样本的检查。本研究建立的TB Green荧光定量PCR检测方法不仅为猪RVA的诊断提供了方法,而且为RVA的流行病学调查提供了有力的工具。本研究建立的荧光定量PCR方法检测下限为106 copies/μL。我们在对采自四川10个地区18个猪场的91份仔猪临床腹泻样本采用本研究建立TB Green实时荧光定量PCR方法、已发表SYBR Green Ⅰ荧光定量PCR方法[15]进行检测时,检测出率分别是43.96%(40/91)、42.86%(39/91),而采用国家标准普通RT-PCR[16]方法的检出率为12.09%(11/91)。上述结果表明本研究所建立的方法检出率显著高于国家标准法,这可能是由于国家标准法是针对RVA VP7基因建立,而VP7基因变异较大,决定RVA G型[11]。
王振玲等[19]对北京地区2010年8月-2012年1月的248份腹泻样本采用胶体金快速检测试纸进行RV抗原检测,其阳性率为17.7%~40%;王璐等[20]对2011年-2012年除海南、西藏自治区外全国的531份病料采用PCR方法进行调查,显示样本阳性率为7.34%,猪场阳性率为19%,西南地区2.7%(1/37)。曹恭貌等[21]对四川部分地区2015年的腹泻样本使用PCR方法检测显示阳性率为7.69%(10/130)。秦谷雨等[22]对安徽省2011年10月-2012年5月的37个规模猪场采集病料使用RT-PCR方法检测显示,猪RV样本阳性率为8.1%,猪场阳性率为21.6%。而本研究中对2018年-2019年,四川10个地区的18个农场91份仔猪临床腹泻样本显示样本阳性率为43.96%。上述研究提示我国猪RV的感染率可能在逐年增加,地区间应该存在感染率差异,近年来四川地区猪RV感染率显著高于过去,这些差异可能与检测方法有关。
综上所述,本研究基于RVA VP6建立的荧光定量PCR方法检测下限为106 copies/μL,灵敏度高、准确性好,在猪RVA的快速诊断、流行病学调查等方面具有极高的应用价值。

