糯米酸细菌多样性解析及其表型和基因功能预测
向凡舒 张 婷 董 蕴 侯强川 豁银强 郭 壮
(湖北文理学院食品科学技术学院,襄阳 441053)
作为我国发酵谷物制品的特色组成部分,糯米酸是以糯米面、切碎的新鲜红辣椒和食盐为主要原料,混合均匀后在常温下经过密封发酵制作而成,发酵时间大致为15~20 d。糯米酸通过煎炸的方式烹饪后酸辣香酥,爽口开胃,在我国华中地区有着较为广泛的食用人群。谷物经微生物发酵后,其自身的消化性与生物活性均会有所提高,因而对发酵谷物制品微生物多样性进行解析具有一定必要性[1],但目前关于糯米酸微生物类群的研究较少。
鲊广椒的制作工艺与糯米酸较为相似,区别在于鲊广椒常以大米面或玉米面为主要原料制作而成,且水分含量低于糯米酸[2]。王玉荣等[2,3]对鲊广椒中的微生物多样性进行了解析,结果发现乳酸杆菌属和念珠菌属为主要的细菌和真菌类群。邓风[4]、雷炎[5]和葛东颖[6]采用纯培养的方法分别对咸丰、恩施和荆州地区鲊广椒中乳酸菌进行了解析,均发现植物乳杆菌为其中的优势乳酸菌。通量高、检测速度快和价格相对较低的优点,使第二代高通量测序技术在米酒[7]、面团[8]和鲊广椒[9]等淀粉质发酵食品微生物多样性解析中有了广泛应用,实现了对微生物类群的全面和准确解析[10]。
本研究在采用高通测序技术对糯米酸中细菌多样性进行解析的基础上,进一步对其细菌的表型和基因功能进行了预测,以期为以糯米酸为代表的特色发酵谷物制品开发提供参考。
1 材料与方法
1.1 材料与试剂
DNeasy mericon Food Kit DNA基因组提取试剂盒、引物338F/806R、DNA聚合酶、10×PCR Buffer和dNTPs Mix、Axygen清洁试剂盒、Illumina高通量测序配套试剂。
1.2 主要仪器设备
Veriti FAST梯度PCR仪,UVPCDS8000凝胶成像分析系统,Illumina MiSeq高通量测序平台,R920机架式服务器。
1.3 实验方法
1.3.1 样品采集
本研究的9 份糯米酸样品均于2019年10月下旬采集自湖南省湘西土家族苗族自治州永顺县(E109°10′~110°22.5′,N27°44.5′~29°38′)芙蓉镇和永茂镇,编号依次为YS1~YS9,所有样品均在当地制作并销售,采集到的样品被分别装入采样袋中密封保存并在常温下带回实验室进行后续研究。
1.3.2 宏基因组DNA提取、PCR扩增和高通量测序
每份样品各取2 g,使用试剂盒进行DNA提取,使用加入核苷酸标签(Barcord)的引物338F/806R对细菌16S rRNA V3-V4区进行PCR扩增,扩增体系和程序参照蔡怀依[11]的方法。将扩增产物进行测序。
1.3.3 生物信息学分析
反馈回的效序列上传至QIIME(V1.7.0)平台进行生物信息学分析,经97%相似度划分和构建分类操作单元(operational taxonomic units,OTU)[12]后,对其进行嵌合体检查[13],选择OTU代表性序列在Ribosomal Database Project(RDP)数据库中进行比对注释其分类学地位[14]。在同一测序深度下计算超1指数和发现物种数等α多样性指标,并基于UniFrac距离进行加权主坐标(principal coordinate analysis,PCoA)分析和聚类分析计算各样品间的β多样性[15]。
将所有样品中平均相对质量分数大于1.0%的门、属和OTU,定义为优势门、属和OTU[16]。
1.3.4 表型与基因功能预测
在BugBase(https://bugbase.cs.umn.edu/)网站上传OTU矩阵与9 份样品的分类信息,以获得细菌表型预测结果[17]。使用PICRUSt(phylogenetic investigation of communities by reconstruction of unobserved states)软件预测糯米酸中细菌的基因功能[18],并参照蛋白质直系同源簇数据库(clusters of orthologous groups of proteins,COG)进行功能注释[19]。
1.3.5 多元统计
使用Past3软件进行数据处理,使用Kruskal-Wallis检验对各聚类间α多样性指标、表型和基因功能类别指标进行差异性分析;使用R软件、Origin2017和Excel2016进行绘图。
2 结果与分析
2.1 细菌群落结构研究
通过高通量测序,9 个样品共得到了221 437 条高质量序列,平均每个样品包含24 570 条序列,经97%相似度划分和去除嵌合体后共得到6 256 个OTU,平均每个样品含有695 个OTU。本研究首先使用基于OTU水平加权UniFrac距离的主坐标分析和聚类分析对各样品细菌群落结构相似性进行了评价,结果如图1所示。
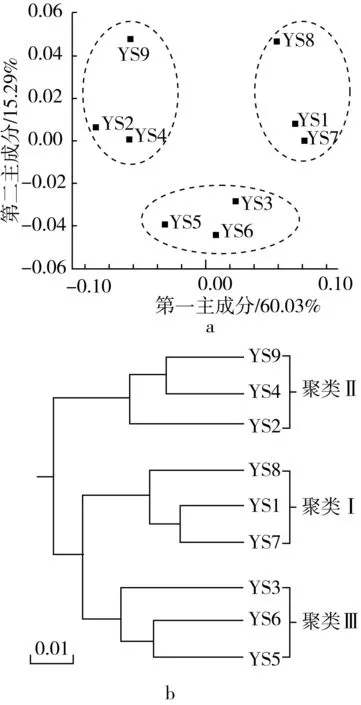
图1 基于加权UniFrac距离的主坐标分析和聚类分析
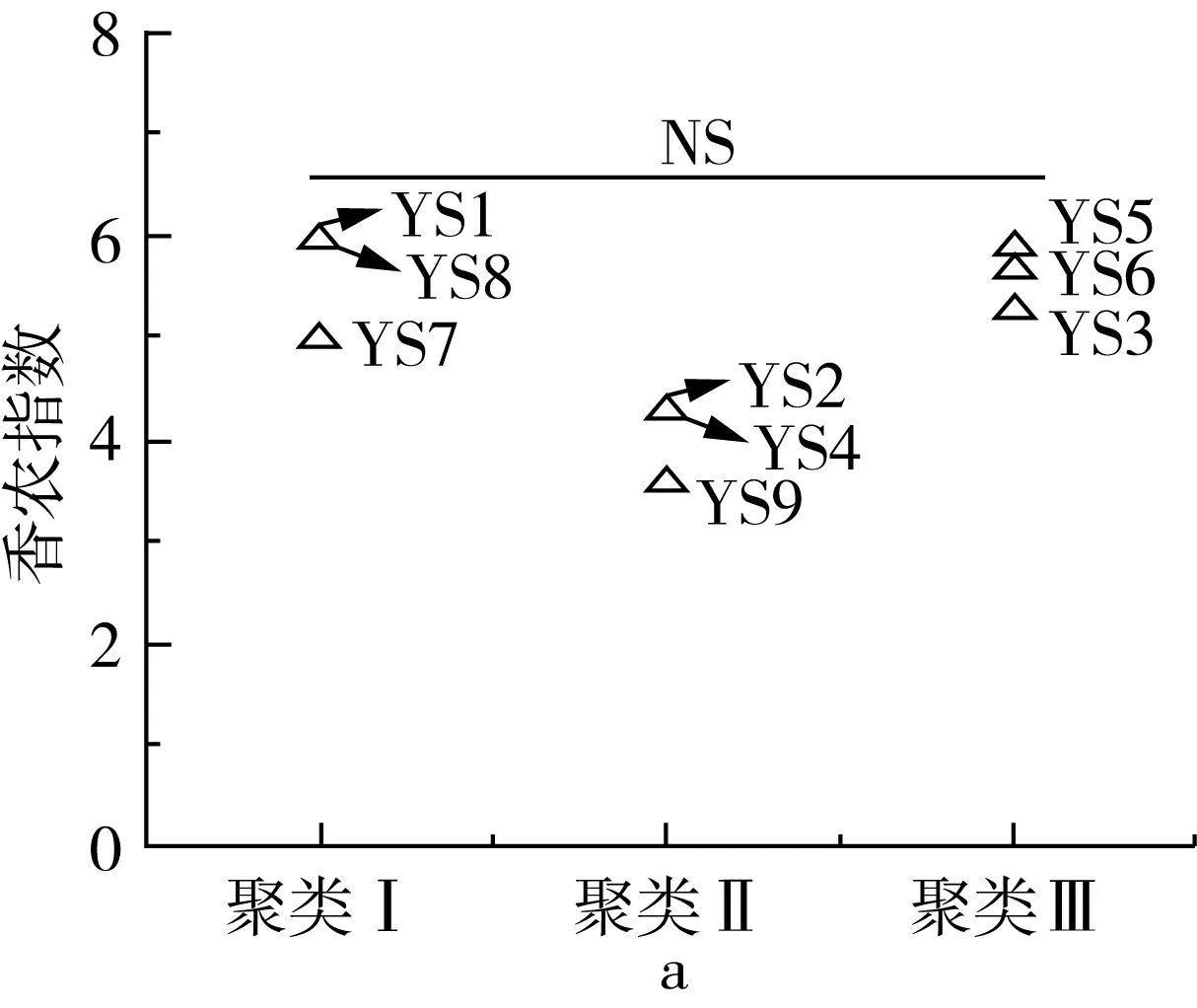
图2 不同聚类样品细菌香农指数 和发现物种数比较分析
由图1a可知,第一主成分和第二主成分的贡献率分别为60.03%和15.29%,9 个样品在空间排布上呈现出聚类趋势,YS1、YS7和YS8主要分布在右上角,YS2、YS4和YS9主要分布在左上角,YS3、YS5和YS6主要分布在X轴下方。由图1b可知,9 个样品亦呈现出明显的聚类趋势,其中聚类Ⅰ由YS1、YS7和YS8构成,聚类Ⅱ由YS2、YS4和YS9构成;聚类Ⅲ由YS3、YS5和YS6构成。由此可见,主坐标分析和聚类分析结果相同,这说明不同样品间细菌群落结构在存在差异的同时,亦具有一定的相似性。
在对各样品序列进行抽平的基础上,通过香农指数和发现物种数等α多样性指标对各聚类样品间细菌的多样性和丰度进行了评价,结果如图2所示。
由图2a可知,香农指数的分布范围在3.59~6.00之间,经Kruskal-Wallis检验发现,不同聚类间的样品其香农指数差异不显著(P>0.05)。由图2b可知,发现物种数的分布范围在385~703之间,隶属于聚类Ⅱ的样品发现物种数显著低于其他聚类(P<0.05),而聚类Ⅰ和聚类Ⅲ差异不显著(P>0.05)。由此可见,隶属于不同聚类的样品其细菌丰度存在一定差异。
2.2 基于门和属水平的细菌含量分析
本研究基于高通量测序结果分别从门和属水平上对糯米酸的细菌构成进行了分析,优势门和属的相对质量分数如图3所示。
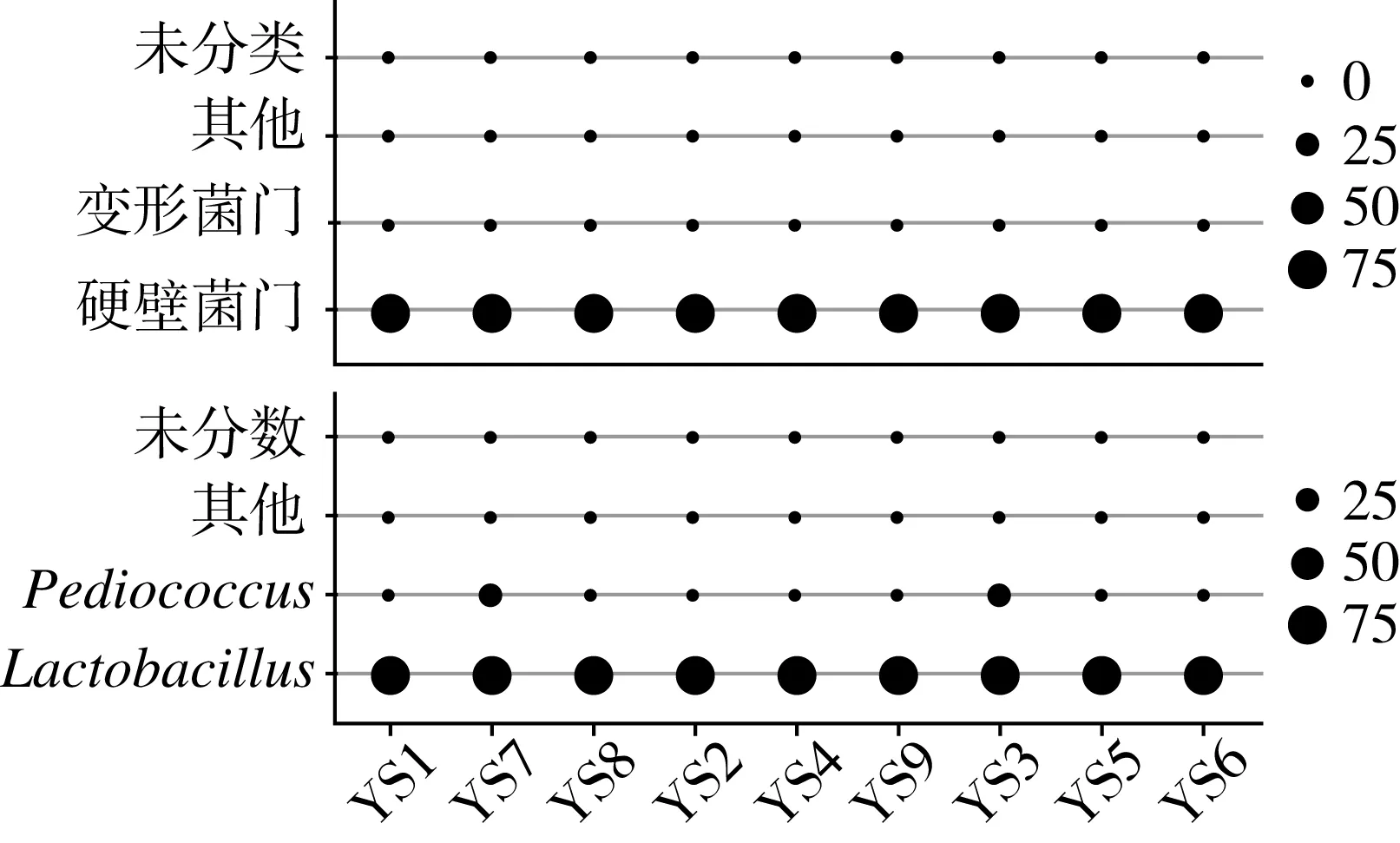
图3 糯米酸中优势细菌门和属的相对含量
由图3可知,硬壁菌门和变形菌门为糯米酸中的优势细菌门,其平均相对质量分数分别为97.45%和2.20%;隶属于Firmicutes的Lactobacillus(乳酸杆菌属)和Pediococcus(片球菌属)为糯米酸中的优势细菌属,其平均相对质量分数分别为89.36%和6.37%。Lactobacillus和Pediococcus均为乳酸菌,而两者的累计相对质量分数高达95.73%,由此可见,糯米酸中的细菌主要为乳酸菌,且以Lactobacillus为主。研究人员在解析其他发酵谷物制品细菌多样性时得到了相似的结论,王玉荣[2]发现Lactobacillus和Weissella(魏斯氏菌属)等乳酸菌为湖北省当阳地区鲊广椒中的优势菌属,且Lactobacillus对产品风味品质的形成具有积极的作用;莫玉花[20]发现湖南包谷酸辣子中蕴含了丰富的乳酸菌,分离了70 株乳酸菌同时优化了L.plantarum(植物乳杆菌)发酵包谷酸辣子的工艺条件。采用多相分类鉴定方法,本研究团队发现发酵谷物制品中的乳酸菌类群亦较为独特,将从湖北省当阳地区和恩施土家族苗族自治州鲊广椒中分离的2 株乳酸杆菌分别命名为“鲊广椒乳杆菌”[21]和“恩施乳杆菌”[22]。由此可见,Lactobacillus在以谷物为发酵基质的环境中有着较好的生存优势,这可能是与谷物在发酵过程中酸性逐渐增加及氨基酸含量明显上升有关[23],有研究表明Lactobacillus中的部分种自身含有的氨基酸脱羧酶能提高菌株的耐酸性,如L.brevis(短乳杆菌)中的谷氨酸脱羧酶能够将非必需氨基酸谷氨酸转化为功能性氨基酸γ-氨基丁酸[24]以维持细胞内pH稳态,从而提高菌株自身的耐酸性[25]。因而,在后续研究中开展以糯米酸和鲊广椒为代表的发酵谷物制品中乳酸菌菌种资源的收集,不仅对乳酸菌遗传多样性研究具有积极意义,亦可对发酵谷物相关产品的研发和生产提供菌株支持。经Kruskal-Wallis检验发现,不同聚类间样品优势门和属的相对质量分数差异不显著(P>0.05)。
2.3 基于OTU水平的细菌含量分析
若某一个OTU在聚类Ⅰ的3 个样品中均存在,但在聚类Ⅱ和Ⅲ中均不存在,则将其视为聚类Ⅰ的独特OTU[16],以此类推。各聚类中独特OTU的数量和平均相对质量分数如表1所示。
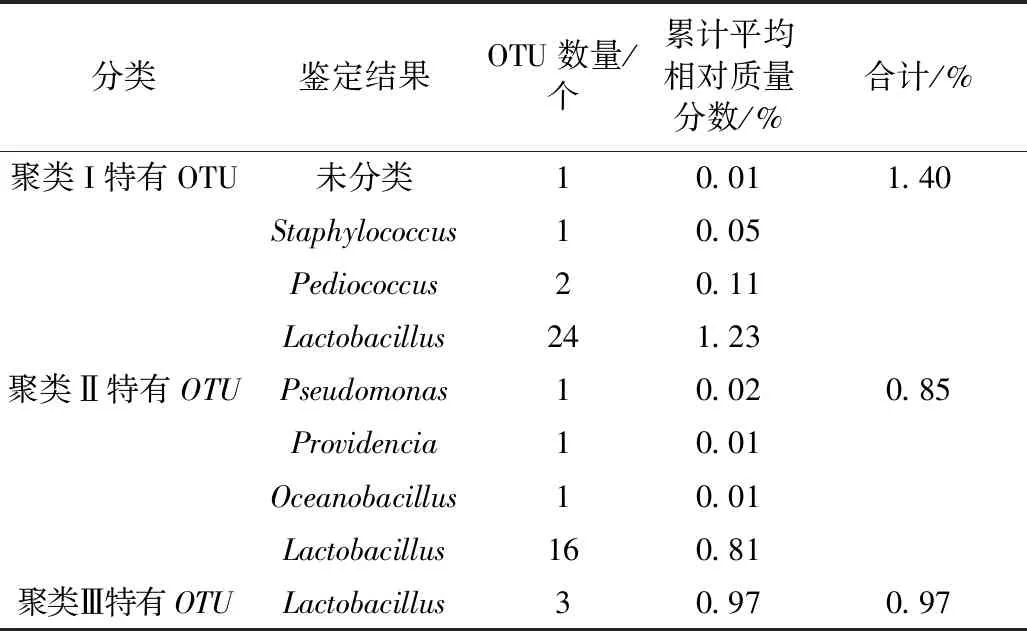
表1 各聚类中独特OTU的平均相对含量
由表1可知,聚类I中包含了28 个独特OTU,其中各有24 个和2 个被鉴定为Lactobacillus和Pediococcus;聚类Ⅱ中包含了19 个独特OTU,其中有16 个OTU被鉴定为Lactobacillus;聚类Ⅲ中包含了3 个独特OTU,均被鉴定为Lactobacillus。由此可见,隶属于不同聚类的糯米酸均具有以乳酸菌为主的独特细菌类群,但其含量较少,所有独特细菌类群的累计平均相对质量分数仅为3.22%。
若所有样品都含有某一OTU,则将该OTU定义为核心OTU[16],本研究共从6 256 个OTU中发现了5 个核心OTU,结果如图4所示。
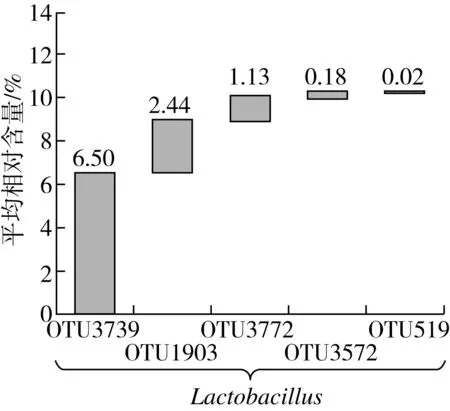
图4 核心OTU的平均相对质量分数
由图4可知,5 个核心OTU分别为OTU3739、OTU1903、OTU3772、OTU3572和OTU519,均鉴定为Lactobacillus,累计平均相对质量分数为10.27%。由此可见,不同聚类的糯米酸中共有一定量的乳酸菌类群,而该类群可能对糯米酸品质的形成具有重要作用。
2.4 细菌表型和基因功能预测
在对不同聚类糯米酸独特和核心细菌类群进行解析的基础上,本研究进一步预测了其表型和基因功能,表型结果分析如图5所示。
由图5a可知,糯米酸中细菌类群主要为革兰氏阳性菌,其相对质量分数在98.36%~99.92%之间,且不同聚类间革兰氏阳性菌相对质量分数的差异均不显著(P>0.05)。由图5b、和图5c可知,隶属于聚类Ⅰ、聚类Ⅱ和聚类Ⅲ的样品,厌氧菌的相对质量分数分别为96.05%、21.27%和55.61%,兼性厌氧菌的相对质量分数分别为3.23%、77.73%和44.23%,经Kruskal-Wallis检验发现,聚类I样品厌氧菌的含量显著高于其他2 个聚类(P<0.05),而兼性厌氧菌呈现出相反趋势(P<0.05);乳酸菌为具有产乳酸特性,无芽孢的革兰氏阳性细菌,且绝大部分为兼性厌氧或严格厌氧菌[26],这一现象与糯米酸中含有较高乳酸菌含量的结论相符合。由图5d和图5e可知,不同聚类样品间好氧菌和具有氧化胁迫耐受性能力细菌的相对质量分数均较低,且差异不显著(P>0.05)。糯米酸的发酵是在密封的坛子中完成,坛中空气耗尽后接近厌氧环境,这可能是导致糯米酸中好氧菌含量极少且细菌氧化胁迫耐受性差的主要原因。由图5f、图5g和图5h可知,具有移动原件、生物膜形成能力和致病潜力的菌群相对质量分数均较低,这也说明了糯米酸有着较好的食用安全品质。
本研究对糯米酸中细菌的基因功能亦进行了预测,所有细菌隶属于4 018 个COG,分别注释到了21 个功能大类,结果如图6所示。
由图6可知,糯米酸中细菌除了在翻译、核糖体结构与生物发生和转录等自身生长繁殖功能上有着
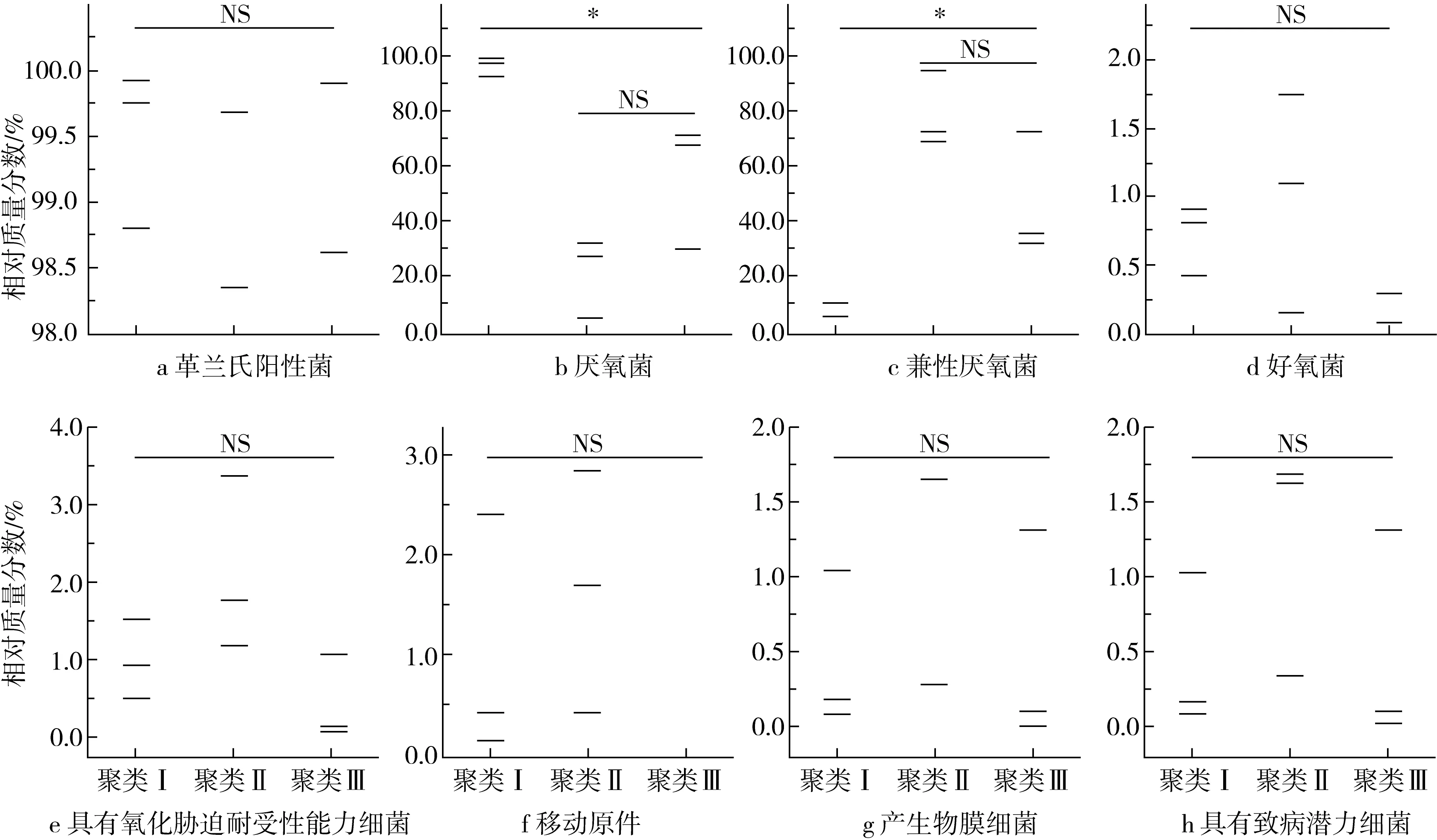
注:NS表示差异不显著;*表示差异显著(P<0.05)。图5 细菌表型预测结果
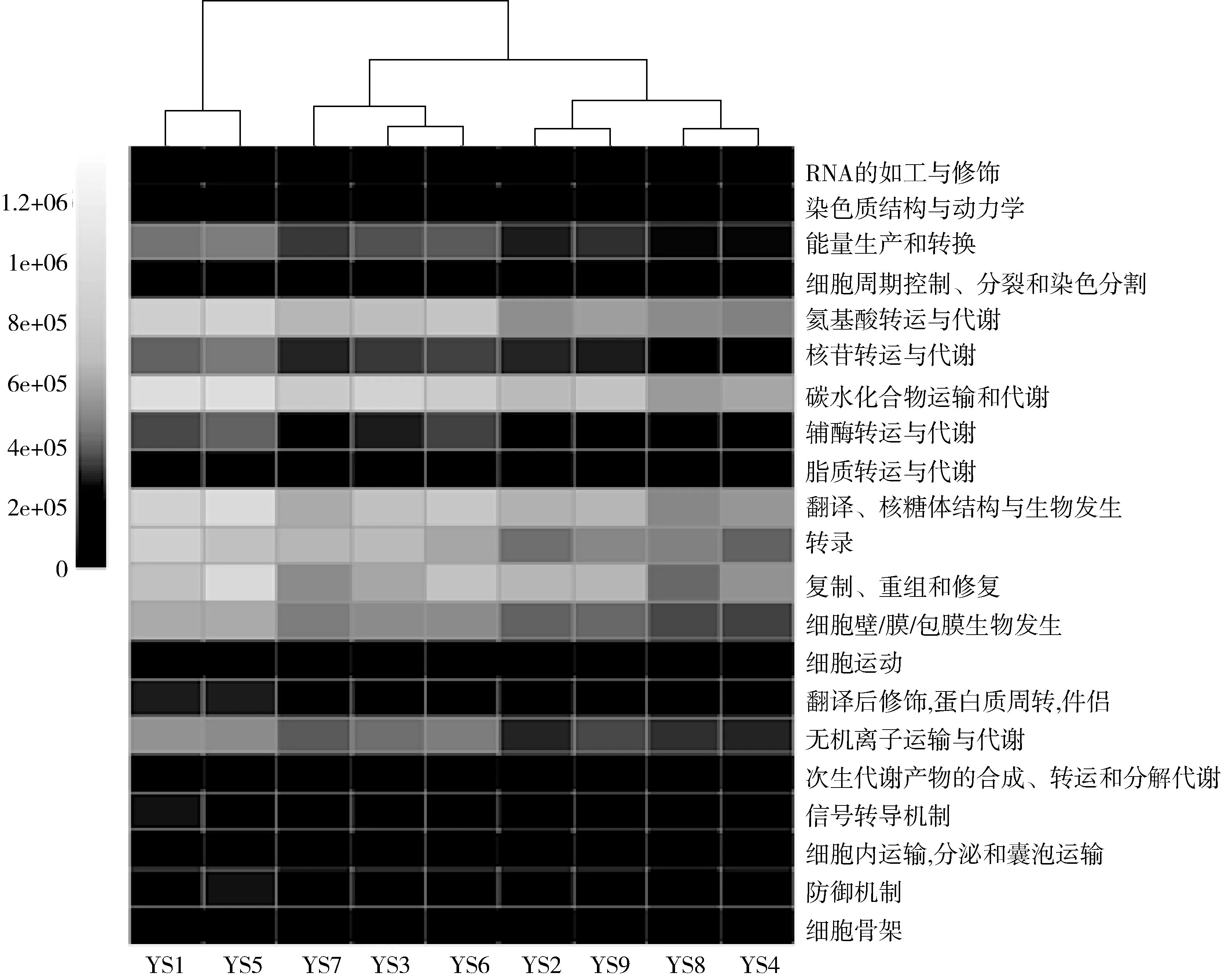
图6 糯米酸中细菌基因功能类别分析
较高的表达外,在氨基酸转运与代谢和碳水化合物运输与代谢功能上亦有着较高的表达,这可能与部分乳酸菌具有水解淀粉的能力[27]和可产生游离氨基酸[28]有关。由图6亦可知,糯米酸中细菌的细胞运动功能表达较低,这一结果与表型预测中其移动原件含量较低相一致。经Kruskal-Wallis检验发现,不同聚类在基因功能表达程度上的差异不显著(P>0.05)。由此可见,糯米酸品质的形成与其蕴含的细菌类群表型和功能性之间可能有着密切的关联。
3 结论
Lactobacillus和Pediococcus是糯米酸中主要的细菌类群,二者累计相对质量分数在总细菌类群中的占比超过了95%,且其主要以厌氧菌和兼性厌氧菌为主,在移动原件含量、生物膜形成能力和致病潜力等表型上的相对质量分数较低,但在氨基酸转运与代谢和碳水化合物运输与代谢等基因功能上具有高表达。由此可见,糯米酸中蕴含了丰富的乳酸菌资源。

