依帕司他联合甲钴胺对糖尿病周围神经病变患者神经传导功能及氧化应激的影响
孙 玲 汪 湲 张丰姣 康志强
(郑州市中心医院内分泌科 郑州 450001)
糖尿病周围神经病变(Diabetic peripheral neuropathy,DPN)为糖尿病(diabetes mellitus,DM)常见并发症之一,是指DM患者仅因糖尿病导致的周围神经功能障碍相关症状[1]。山梨醇可影响神经细胞正常功能,其在神经元内蓄积可使DM患者出现外周神经症状,而依帕司他属于醛糖还原酶抑制药,可通过抑制在多元醇代谢中促进葡萄糖转化为山梨醇的醛糖还原酶达到治疗DPN的目的,但无法有效修复受损神经组织,提示可采用联合用药[2~3]。而甲钴胺是内源性维生素B12,具有改善神经元传导、修复受损神经细胞的功效,故理论上依帕司他和甲钴胺在治疗DPN方面可发挥良好的协同作用[4]。基于此,本研究选取部分符合条件的DPN患者作为研究对象,并予以依帕司他、甲钴胺联合治疗,探讨其临床疗效,现报道如下。
1 资料与方法
1.1 一般资料
选择2017年6月~2018年6月郑州市中心医院收治的DPN患者150例,根据随机数表法分为观察组和对照组各75例。观察组男43例,女32例;年龄40~79岁,平均年龄(60.29±4.11)岁;DM病程4~11年,平均(8.16±1.17)年。对照组男44例,女31例;年龄41~81岁,平均年龄(60.53±4.29)岁;DM病程3~12年,平均(8.23±1.21)年。两组一般资料对比(P>0.05),具有可对比性。本研究经本院医学伦理委员会批准。
1.2 入选标准
纳入标准:(1)符合《糖尿病周围神经病诊断和治疗共识》[5]中DM诊断标准;(2)年龄18~80岁;(3)纳入研究前1个月未接受针对DPN的相关治疗;(4)无其他严重DM并发症;(5)均签署知情同意书。排除标准:(1)对本研究所用药物过敏;(2)合并其他严重疾病;(3)合并严重肝肾功能不全;(4)存在沟通理解障碍;(5)中途退出;(6)依从性低下;(7)治疗过程中出现严重不良反应。
1.3 方法
两组均予以常规降糖治疗,并进行饮食运动指导。对照组采用依帕司他片(山东达因海洋生物制药股份有限公司,国药准字H20050893,规格:50mg/片)治疗,饭前口服,50mg/次,3次/d。观察组在对照组治疗上加用甲钴胺片(北京星昊医药股份有限公司,国药准字H20060865,规格:0.5mg/片)治疗,口服甲钴胺片,0.5mg/次,3次/d。两组治疗时间均为30d。
1.4 评价指标
治疗前、治疗30d后评估神经传导功能、氧化应激指标、多伦多临床评分系统(Toronto clinical scoring system,TCSS)评分、神经病变自觉症状问卷(total symptoms score,TSS)评分。(1)神经传导功能:采用Nicolet EDX肌电诱发电位系统测定患者腓总神经以及正中神经的感觉神经传导速度(Sensory nerve conduction velocity,SCV)与运动神经传导速度(Motor nerve conduction velocity,MCV);(2)氧化应激指标:采集空腹静脉血5mL,以3000r/min的速度进行离心操作20min,使用日立7600全自动生化分析仪测定血清超氧化物歧化酶(superoxide dismutase,SOD)、还原型谷胱甘肽(Reduced glutathione,GSH)水平;(3)TCSS评分:该系统由神经反射、神经症状以及感觉功能组成,其中神经反射涵盖膝反射、踝反射,为双侧计分,0分表示无异常,1分表示存在减弱现象,2分代表消失,总分8分;神经症状由下肢针刺样感、麻木、乏力、疼痛与走路不稳及上肢相似症状组成,0分表示正常,1分表示有相应症状,分值范围在0~6分;感觉功能涵盖右侧拇指温度觉、痛觉、振动觉、触压觉、位置觉,0分为正常,1分为异常,总分5分。该系统总分为19分,分值越低其症状越轻;(4)TSS评分:该问卷涵盖患者疼痛、灼热感、感觉异常、麻木4种症状,根据症状的严重程度及发生次数进行评分,每项分值范围在0~3.66分,该问卷的总分为14.64分,其分值状况与其临床症状严重程度呈正相关。
1.5 统计学方法
2 结果
2.1 神经传导功能
治疗前,两组神经传导功能各指标比较,差异无统计学意义(P>0.05);观察组治疗后正中神经、腓总神经的MCV、SCV均高于对照组,差异有统计学意义(P<0.05),见表1。
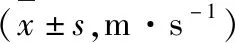
表1 神经传导功能比较
2.2 氧化应激指标
治疗前,两组氧化应激各指标比较,差异无统计学意义(P>0.05);治疗后,观察组SOD、GSH均高于对照组,差异有统计学意义(P<0.05),见表2。

表2 氧化应激指标比较
2.3 TCSS、TSS评分
治疗前,两组TCSS、TSS评分比较,差异无统计学意义(P>0.05);治疗后,观察组TCSS、TSS评分均低于对照组,差异有统计学意义(P<0.05),见表3。

表3 TCSS、TSS评分比较分)
3 讨论
DPN主要临床症状为对称性疼痛与感觉异常,通常见于下肢,若感觉障碍严重可引发下肢关节病或溃疡等继发症状,疼痛剧烈,且一旦运动神经受累,人体肌力可有一定程度的衰退,肌肉甚至可出现萎缩,可导致患者生活质量低下。故尽早采取科学针对性的措施非常重要,而积极探究高效治疗方案对DPN患者来说具有重要意义。
DPN发病机制尚未明确,通常认为是多种因素共同作用的结果,如高血糖、代谢紊乱、氧化应激等,其中高血糖为主要原因,氧化应激的作用也极其重要。DM患者机体若长期处于高血糖环境中,机体的自由基清除率将大幅度下降,与此同时游离自由基超量产生,即氧化因子与抗氧化因子失衡,进而引起患者神经元DNA、蛋白质及脂质损伤,对轴索运输及信号传导形成阻碍,氧化应激还可使神经营养因子水平下降,削弱受损神经纤维修复再生能力。同时,氧化应激反应可与其他导致DPN的其他因子发生协同作用,故改善机体氧化应激状态尤为重要。SOD是抗氧化金属酶,通过催化超氧阴离子自由基歧化产生氧与过氧化氢,维持氧化和抗氧化平衡,GSH可保障机体正常免疫功能,具备抗氧化作用,因此SOD、GSH均可良好反映机体氧化应激状态[6]。MCV、SCV则是反映机体神经功能的直接指标[7]。本研究结果显示,治疗后两组MCV、SCV、SOD、GSH均有所提升,但观察组各指标的上升幅度明显高于对照组,且与对照组相比,观察组TCSS、TSS评分较低,表明依帕司他联合甲钴胺治疗DPN的效果更佳。分析其原因在于,依帕司他可抑制醛糖还原酶活性,从而减少细胞内果糖和山梨醇含量,避免过度堆积,也可提高细胞内肌醇水平,恢复NA+、K+、ATP酶活性,从而治疗DPN,提高神经传导速度,改善氧化应激状态[8~9]。而甲钴胺可参与机体甲基转移,促进核酸与蛋白合成、轴索内输送、轴索再生和髓鞘形成,从而修复受损神经组织,促进患者神经功能恢复,弥补依帕司他在修复受损神经方面的不足,进一步促进患者神经传导功能恢复、改善氧化应激状态[10~11]。李平等[12]研究结果已证实,依帕司他治疗DPN的有效性和安全性,且治疗效果优于甲钴胺,而本研究结果显示依帕司他联合甲钴胺治疗DNP整体疗效明显优于依帕司他单一治疗,说明甲钴胺可协同依帕司他进一步提高DPN治疗效果。
综上所述,DPN患者采用依帕司他联合甲钴胺治疗的效果较为显著,可促进患者神经传导功能及氧化应激指标的改善,缓解患者的临床症状,值得临床推广。