人早幼粒细胞cDNA 文库中与GINS2 发生相互作用靶蛋白的筛选和鉴定
张 曦, 潘玉卿, 余 鑫, 郑亚婷, 郭成斌, 徐 娜, 王良晓, 何 亮, 杨 丽
(1. 云南省肿瘤医院 昆明医科大学第三附属医院检验科,云南 昆明 650118;2. 昆明医科大学第一附属医院检验科 云南省实验诊断研究所 云南省检验医学重点实验室,云南 昆明 650032)
白血病是骨髓造血干细胞恶性克隆所形成的血液系统肿瘤。在全球范围内,每年白血病的发病率和病死率约占所有病例的2.4%和3.2%[1]。在中国,白血病新发病例约为每年75.3/10 万[2]。伴15 号染色体早幼粒细胞基因( promyelocytic leukemia,PML) 和17 号染色体维甲酸受体基因(retinoic acid receptor alpha,RARα) 易位的急性早 幼 粒 细 胞 白 血 病 (acute promyelocytic leukemia,APL) 是急性髓细胞性白血病(acute myelocytic leukemia,AML)的一个特殊亚型,临床上常见发热、感染、贫血和细胞浸润等急性白血病症状。在APL 形成过程中,融合蛋白PMLRARα 并非一成不变地始终作为一个整体来发挥致癌作用,其致白血病的分子机制仍不清楚。前期研究[3]表 明:GINS2 基 因 能 与 缺 失 核 定 位 信 号(nuclear localization signal,NLS) 的 变 异 蛋 白PML (NLS-) 在全细胞内共定位表达,提示GINS2 在单个细胞水平干扰了野生型PML 的正常功能并参与了APL 的发生发展。GINS2 基因作为GINS(go-ichi-ni-san2)家族成员之一,与真核细胞的DNA 复制及损伤有密切关联,参与细胞周期的调控,并对细胞的增殖和凋亡起到关键作用[4]。目前国内外尚无关于GINS2 编码蛋白与人早幼粒细胞cDNA 文库互作蛋白筛选和鉴定的报道,为此本文作者使用前期构建成功的人早幼粒细胞cDNA文库[5]和诱饵质粒pGBKT7-GINS2[6],筛选出文库内与GINS2 发生相互作用的靶蛋白,为进一步阐释APL 发生的分子机制奠定基础。
1 材料与方法
1.1 主要试剂和仪器酵母双杂交系统购自美国Clontech 公司,诱饵质粒pGBKT7-GINS2 和人早幼粒细胞cDNA 文库由本实验室前期成功构建,大肠杆菌Top10 由本室冻存。酵母菌小量提取试剂盒购自美国Solarbio 公司;质粒小抽试剂盒购自日本TaKaRa 公司;酵母营养缺陷型筛选培养基(包括SD/-Trp、SD/-TrP/-Leu、SD/-Trp/-Leu/-His和SD/-Trp/-Leu/-His/-Ade 培养基),酵母完全培养基(YPDA),大肠杆菌LB 培养基,氨苄青霉素(100 mg·L-1)和卡那霉素(50 mg·L-1)均购自上海碧云天生物技术有限公司;其他化学试剂均为国产分析纯。PCR 热循环仪(美国Biorad 公司),台式超高速低温离心机和移液器(德国Eppendorf 公司),电转化仪(美国Bio-Rad 公司)。
1.2 文库质粒的转化及筛选从SD/-Trp 平板挑取单克隆菌落接种于50 mL 液体SD/-Trp 培养基中,30 ℃、225 r·min-1振荡培养18 h 后,将菌液转接至500 mL YDPA 培养基中,使初始600 nm 波长处吸光 度[A(600)]值 为 0.2。 继 续30 ℃、225 r·min-1振荡培养5 h 使A(600)为0.6。待菌液 恢 复 至 室 温 后,4 000 r·min-1离 心5 min 回 收 菌体。然后迅速用30 mL 无菌水重悬菌体并混匀,4 000 r·min-1离心5 min后弃上清。再用0.1 mol·L-1醋酸锂20 mL 重悬菌体,4 000 r·min-1离心5 min 后弃上清。 向离心管中依次加入50% 聚乙二醇PEG3350、1 mol·L-1醋 酸 锂、30 μg pGBKT7-GINS2 和25 μg 文库质粒。剧烈振荡1 min 至完全混匀后,42 ℃水浴热激25 min,然后转入30 ℃水浴复苏1 h。最终4 000 r·min-1离心5 min 回收菌体后,用8 mL 无菌水重悬菌体,吸取20 μ L 培 养物 经 梯 度 稀 释(10、 100 和1 000 倍) 后 涂布SD/-Trp/-Leu 平板3 块,用于检测文库转化效率。其余涂SD/-Trp/-Leu/-His/+5 mmol·L-13-氨基-1,2,4-三氮唑(3-aminotriazole,3-AT) 平板50 块。30 ℃培养4 d,观察文库质粒的转化结果并记录转化效率。
1.3 阳性克隆报告基因的检测行报告基因腺苷酸琥珀酸合成酶2(ADE2)和组氨醇氨基盐转移酶3(HIS3)检测时,从筛库平板中共挑取到15 个初始阳性克隆并接种至SD/-Trp/-Leu 平板中继续培养3 d。将上述初始阳性克隆分别用无菌水稀释后点种 至SD/-Trp/-Leu 和SD/-Trp/-Leu/-His/-Ade 平板,30 ℃培养4 d 后记录平板的显色结果。行报告基因β-半乳糖苷酶(LacZ)检测时,另取一份无菌水重悬后的阳性克隆点于滤纸片上,然后将其彻底浸入液氮中,90 s 后取出室温放置备用。将5 mL Z-buffer、70 μL X-gal 和24 μL β-巯基乙醇加入培养皿并混匀作为显色液,将上述滤纸放入其中反应5 h 后记录培养皿的显色结果。
1.4阳性克隆的测序比对挑选通过报告基因检测的10 个阳性克隆,将其分别转入SD/-Trp/-Leu 液体培养基,振荡过夜培养后采用酵母抽提试剂盒提取酵母质粒。将其转化入大肠杆菌Top10 新鲜感受态进行扩增。最后将含有阳性克隆的Top10 转化子放入含氨苄青霉素的LB 液体培养基扩增后提取质粒,并对质粒进行测序和基本局部比对搜索工具(basic local alignment search tool,BLAST)比对。
1.5 阳性克隆的回转验证将含有诱饵质粒pGBKT7-GINS2 的AH109 酵母菌作为受体菌制备感受态,分别将测序成功的8 个阳性克隆转化其中并涂布SD/-Trp/-Leu 平板。挑取平板上长出的转化子分别用无菌水稀释后点种至SD/-Trp/-Leu 和SD/-Trp/-Leu/-His/-Ade 平板,30 ℃培养5 d 后对阳性克隆回转验证的ADE2 和HIS3 报告基因进行检测并记录平板颜色。另取一份用无菌水重悬后待验证的8 个阳性克隆点于滤纸片上进行LacZ 报告基因的检测并记录平板颜色。
2 结 果
2.1 筛选文库的转化效率进行10、100和1 000倍梯度稀释的SD/-Trp/-Leu 平板上分别生长1 672、208 和19 个菌落,总的文库质粒转化个数为 (1 672/20+208/2+19/0.2) ×1/3×8 000=7.53×105个,转 化 效 率 为7.53×105/25 μg =3.01×104μg-1,完全满足筛选要求(图1)。

图1 cDNA 文库的转化效率检测Fig.1 Detection of transformation efficiency of cDNA library
2.2 阳性克隆ADE2、HIS3 和LacZ 报告基因的检测ADE2 和HIS3 报告基因的检测结果中,阳性对照在SD/-Trp/-Leu 和SD/-Trp/-Leu/-His/-Ade平板上均能正常生长,而阴性对照由于不能激活ADE2 和HIS3 报告基因,故在SD/-Trp/-Leu 平板上可以正常生长,但在缺乏组氨酸和腺嘌呤的SD/-Trp/-Leu/-His/-Ade 平板上不能生长。在挑取到的15 个初始阳性克隆中,1、2、5、6、7、8、9、11、14 和15 等10 个 克 隆 能 在SD/-Trp/-Leu/-His/-Ade 平板上生长,表明激活了HIS3 和ADE2报告基因,而3、4、10、12 和13 等5 个克隆则不能激活ADE2 和HIS3 报告基因(图2A 和B)。此外,检测报告基因LacZ 时,1、2、3、5、6、7、8、9、11、12、13、14 和15 等13 个克隆的由黄色变为绿色,表明其能激活LacZ 报告基因(图2C)。

图2 阳性克隆的ADE2、HIS3 和LacZ 报告基因检测Fig.2 Detection of reporter genes of ADE2, HIS3 and LacZ of positive clones
2.3 阳性克隆的测序和比对将通过3 个报告基因检测的10 个阳性克隆质粒进行测序,除8 和9 号克隆测序失败,将其余8 个阳性克隆的测序结果通过美国国家生物信息中心的BALST 网站(https://blast. ncbi. nlm. nih. gov/Blast. cgi) 进 行 比 对,得到8 个阳性克隆分别属于8 种不同的蛋白编码基因,分别是:RNA 结合基序蛋白39 (RNA binding motif protein 39,RBM39),作为类固醇激素受体介导的转录和选择性剪接;泛素样修饰因子激活 酶1(ubiquitin-like modifier activating enzyme 1,UBA1),催化泛素偶联的第一步且标记细胞蛋白降解;金属硫蛋白2 (metallothionein-2,MT2A),主要控制细胞内锌水平,影响凋亡和自噬途径;线粒体钙离子摄入蛋白1 (mitochondrial calcium uptake 1,MICU1),防止线粒体Ca2+超载而导致的细胞损伤及应激;N-乙基马来酰亚胺敏感性融合蛋白辅因子(NSFL1 cofactor p47 isoform x3,NSFL1C),介导高尔基体片段再生所必需的蛋白;脂肪酰基辅酶A 还原酶1(fattyacyl-CoAreductase1,FAR1),主要作为脂肪酸转化为脂肪醇所必需的蛋 白; 双 特 异 性 磷 酸 酶 1 (dual specificity phosphatase 1,DUSP1),在丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)/细胞外信号调节激酶(extracellular signal-regulated kinase,ERK2) 信号途径中发挥重要的生理功能;白细胞分化抗原14 (cluster of differentiation antigen 14,CD14),主要表达于单核/巨噬细胞表面且介导免疫反应。
2.4 阳性克隆的回转验证阳性克隆回转验证ADE2和HIS3报告基因时,菌液涂布SD/-Trp/-Leu和SD/-Trp/-Leu/-His/-Ade 平板后,生长状况良好且符合实验要求。8 个阳性克隆中除6 号外,其余均能激活ADE2 和HIS3 报告基因(图3A 和B)。而回转验证LacZ 报告基因时,8 种阳性克隆中除6 号外,其余均能激活LacZ 报告基因(图3C)。
3 讨 论
探寻白血病发病过程中的相关致病基因,对于减少放化疗导致的基因突变具有重要意义,并可为白血病的临床诊治提供实验室数据。在APL 发生发展过程中,尽管此类白细胞可被全反式维甲酸(all trans acid,ATRA)或砷剂诱导分化成熟,加之对白血病支持治疗的改进,患者的生存率已有了明显提高,但治疗前不明原因发热及完全缓解后因感染所致的高死亡率时有发生[7-10]。即使在发达国家,对复发难治性小儿白血病的治疗效果仍不乐观[11]。
由于变异蛋白PML(NLS-)在致APL 发病中与GINS2 基因存在关联,本课题组前期研究[12]通过PCR 法检测了GINS2 在白血病HL60、THP-1和U937 细胞株中的表达水平,结果显示:GINS2在白血病细胞株中普遍高表达。本课题组在前期研究[13]中 构 建 了 针 对GINS2 基 因 蛋 白 编 码 区(coding sequence,CDS) 的干扰序列,并靶向下调其在APL 细胞株HL60 中的表达,结果显示:白血病细胞的增殖能力明显受抑制且生长被阻滞在G2/M 期,相关的周期蛋白依赖性激酶1(cyclindependent kinases 1,CDK1) 和细胞周期蛋白B1(CyclinB1) 表达受到明显抑制。本文作者推测:GINS2 可能通过上调人共济失调毛细血管突变基因(ataxia telangiectasia mutated,ATM)、细胞周期检测点激酶2 (cell cycle checkpoint kinase 2,CHK2) 及抑癌基因p53 的表达水平而发挥作用[14]。一系列的研究[12-14]表明:GINS2 作为促癌因子在APL 的发生发展中起到关键作用。为此,本文作者将构建成功的诱饵质粒pGBKT7-GINS2与人早幼粒细胞cDNA 文库质粒共同转化至酵母AH109 感受态细胞中,经过对筛选到的阳性克隆进行测序、比对和回转验证,成功在细胞中筛选到了8 个能与GINS2 发生相互作用的靶蛋白,进一步通过研究相互作用蛋白的生物学功能阐释APL 的分子发生机制。
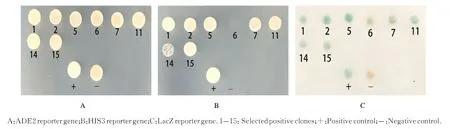
图3 阳性克隆的回转验证Fig.3 Secondary transfection validation of positive clones
本研究所筛选到的8 个基因中,RBM39 是RNA 结 合 蛋 白 家 族 (RNA-binding proteins,RBPs)的成员之一,在真核生物中RBM39 表达的蛋白可以与大量核心剪切体蛋白共定位表达,并能在类固醇激素受体介导的转录和选择性剪接中发挥重要作用[15]。研究[16]表明:RBM39 导致HOXA9靶基因的剪接改变,是AML 致病通路中所必需的一个重要转录网络。RBM39 也能作为磺胺类药物的作用靶点,为复发或难治性剪接体突变的AML患者提供有效的基因治疗手段[17]。UBA1 作为催化泛素偶联的起始酶标记蛋白质泛素化调节其降解,并参与DNA 的修复[18],而且还可作为白血病和多发性骨髓瘤的治疗靶点[19]。MT2A 是人金属硫蛋白家族(metallothioneins,MTs) 成员之一,是一类低相对分子质量、富含半胱氨酸并可被金属诱导的特异蛋白[20]。MT2A 的表达降低可下调细胞中锌水平并影响细胞凋亡,还可通过下调B 淋巴细胞瘤-2 基因相关蛋白X (Bcl-2 associated X protein,BAX)、半胱氨酸蛋白酶3(caspase-3)、半胱氨酸蛋白酶9(caspase-9)和半胱氨酸蛋白酶12(caspase-12)等凋亡蛋白的表达而抑制细胞凋亡[21]。MICU1 作为线粒体钙离子单项转运体(mitochondrial calcium uniporter,MCU)的亚基之一,对于线粒体基质内Ca2+的富集起到关键作用,而Ca2+作为细胞内重要信号分子,维持了细胞能量代谢、生长及增殖等多种功能[22]。而早幼粒细胞白血病蛋白PML 的功能失活直接导致了从内质网转移到线粒体的Ca2+减少,进而引起了细胞凋亡增加和不可控的细胞增殖乃至持续的细胞自噬发生[23]。NSFL1C 又被称为P47,是一种三聚体蛋白,能与P97 蛋白结合并介导高尔基体的有丝分裂和细胞再生[24],在PML 敲除后的小鼠胚胎成纤维细胞中高表达,且对细胞黏附和迁移起到关键作用[25]。FAR1 可以将脂肪酸转化为脂肪醇,这一过程是合成单酯和醚类脂类所必需[26]。DUSP1 所编码的蛋白是一种具有酪氨酸和苏氨酸双重特异性的磷酸酶,可以将MAPKs/ ERK2 脱磷酸化,从而参与 细 胞 生 理 过 程[27]。DUSP1 在AML 患 者 及 细 胞系中的表达与酪氨酸激酶3 串联重复序列有关联[28]。CD14 分子主要在单核/巨噬细胞膜表面表达,能与其他蛋白质协同作用并介导对细菌脂多糖的先天免疫应答[29]。
综上所述,本研究成功从人早幼粒细胞cDNA文库中筛选到8 个能与GINS2 发生相互作用的靶蛋白,其有可能成为APL 诊疗的新靶点。

