激活和阻断内侧前额叶皮质PrL 区5-HTR4 对帕金森病大鼠焦虑行为的改善作用
刘怡玮, 麻焕玉*, 高 凤△, 王兆龙#, 侯曜林▲, 崔晨凯*, 武 星*, 李立博, 张 莉
(1. 西安交通大学医学部生理学与病理生理学系,陕西 西安 710061;2. 西安交通大学第二附属医院康复科,陕西 西安 710004)
帕金森病(Parkinson’s disease,PD)是一种慢性神经退行性疾病,主要影响运动系统,其主要病理变化是中脑黑质致密部(substantia nigra pars compacta,SNc) 多 巴 胺(dopamine,DA) 能 神经元数量明显减少和纹状体DA 水平明显下降,影响基底神经节信息传递,从而使整个基底神经节环路功能紊乱[1]。PD 的主要运动症状合称为帕金森综合征,但是在此之前的数年时间,PD 患者表现出诸多不易被重视的非运动系统症状,如感觉障碍、认知困难、睡眠异常和焦虑等[2],并且此类症状并不能通过抗PD 药物得到有效缓解,同时上述症状随时间呈现进行性恶化,干扰患者的生活质量。目前,很多PD 非运动系统症状的病理生理学机制仍不清楚。
内侧前额叶皮质(medial prefrontal cortex,mPFC)可分为背侧和腹侧。背侧mPFC 参与运动调节,而腹侧mPFC 涉及多种情感的调控。腹侧mPFC 根据解剖位置又分为边缘前皮质(prelimbic cortex,PrL) 和边缘下皮质,PrL 在精神症状,如抑郁和焦虑的调节中发挥重要作用。mPFC 和脑内基底神经节之间有广泛的神经纤维联系,主要接受由腹侧被盖区(ventral tegmental area,VTA)和SNc 发出的密集多巴胺能纤维[3]。mPFC 还接受大 量 来 自 中 缝 背 核 的 5- 羟 色 胺(5-hydroxytryptamine,5-HT) 神 经 支 配[4-5]。同时,mPFC 的传出纤维投射到基底神经节的多个结构,尤其投射到VTA 和纹状体。已有研究[6-7]表明: mPFC 的 PrL 中 DA、 去 甲 肾 上 腺 素(noradrenaline,NE)和5-HT 能纤维传入的功能异常与PD 的发生发展有密切关联。5-HT 神经元通过复杂的纤维投射与PrL 众多亚区发生联系,并通过脑内表达不同5-HT 受体(5-hydroxytryptamine receptor,5-HTR) 对抑郁和焦虑产生复杂影响。形态学的研究[8-9]表 明: 5- 羟 色 胺 受 体 4(5-hydroxytryptamine receptor 4,5-HTR4) 在 额叶皮层、内嗅皮层、杏仁核和海马呈高水平表达,该受体在杏仁核的丰富表达提示其与焦虑行为的调节有密切关联。然而,PrL 中5-HTR4 在PD 相关焦虑中的作用目前尚未见报道。本研究以6-羟基多巴(6-hydroxydopamine,6-OHDA)毁损大鼠左侧内侧前脑束(medial forebrain bundle,MFB)建立PD 大鼠模型,通过核团给药、激动或抑制大鼠PrL 区5-HTR4,观察其对PD 模型大鼠焦虑样行为的影响,同时采用免疫组织化学染色研究MFB 损毁对大鼠焦虑相关脑区单胺类递质水平的影响,阐明PrL 区5-HTR4 在PD 相关焦虑样行为中的作用机制。
1 材料与方法
1.1 实验动物、主要试剂和仪器
雄性SD 大鼠320 只,体质量270~320 g,购于西安交通大学实验动物中心,动物生产许可证号:SCXK(陕)2018-001。实验实施过程中对大鼠的操作符合西安交通大学医学部生物医学伦理学要求,同时在符合统计学要求的前提下,尽量减少动物的使用数量。实验结束后,过量麻醉剂致死动物。
地昔帕明、6-OHDA、阿普吗啡(apomorphine,APO)、5-HTR4 激动剂BIMU8 和5-HTR4 拮抗剂GR113808 购自英国Tocris 公司,实验前溶于二甲亚砜(dimethyl sulfoxide,DMSO)。动物脑立体定位仪(SN-2N)和微电极推进器(SM-21)购自日本Narishige 公司,恒冷冰冻切片机(Cryotome FSE 型) 购 自 美 国Thermo Scientific 公 司,Olympus 生物显微镜(BX51) 购自日本Olympus公司,Image-Pro Plus 图像分析系统(version 5.1)购自美国Media Cybernetics 公司,超声粉碎仪(VCX150) 购自美国Sonics 公司,色谱软件工作站购自美国Agilent Technologies 公司,582 型抽吸泵、542 型自动进样器、MD150 型分析柱、电化学检测器、5020 型保护电极和5011 A 型双通道分析电极均购自美国ESA 公司。
1.2 实验动物分组及PD 模型制备
320 只雄性SD 大鼠随机分为假手术组和6-OHDA 损毁组,每组各160 只。通过左侧MFB注射6-OHDA 制备PD 模型大鼠,从而达到左侧SNc 区DA 神 经 元 完 全 毁 损。40 g·L-1水 合 氯 醛(400 mg·kg-1,腹腔注射)麻醉大鼠,脑立体定位仪固定其头部,备皮,暴露颅骨,根据Paxinos-Watson 的大鼠脑立体定位图谱确定左侧MFB(前囟后4.4 mm,旁开1.2 mm,深度7.8~7.9 mm)的位 置,钻 孔 备 用。 为 保 护NE 能 神 经,于6-OHDA 注射前30 min 给予地昔帕米溶液(5 mg·kg-1,腹腔注射)。将玻璃微电极使用立体定位仪定位于左侧MFB,在4 min 内微量缓慢注入4 μL 6-OHDA(3 g·L-1,溶于含0.2 g·L-1维生素C 的生理盐水),注射结束后给药玻璃微电极在注射部位停留5 min,随后消毒并缝合伤口。假手术组大鼠左侧MFB 给予含0.2 g·L-1维生素C 生理盐水溶液4 μL,其他操作与6-OHDA 损毁组相同。
采用去水吗啡皮下注射诱发旋转实验来判定大鼠PD 模型的成功建立。6-OHDA 注射2 周后,大鼠颈部皮下注射去水吗啡(0.05 mg·kg-1),若一定时间内大鼠向损毁侧的对侧(右侧)自发旋转频率大于35 圈/5 min,表明PD 模型建立成功。实验结束后对大鼠进行酪氨酸羟化酶(tyrosine hydroxylase,TH)免疫组织化学染色,如SNc 脑区的DA 能神经元减少95%以上,则其实验数据纳入统计分析。
1.3 PrL 导向给药套管埋置及局部药物注射
大鼠MFB 注射6-OHDA 或生理盐水2 周后,进行PrL 区导向套管置入手术。采用40 g·L-1水合氯醛(400 mg·kg-1)腹腔注射麻醉大鼠,使用脑立体定位仪定位左侧mPFC 的PrL 区(前囟前3.3 mm,旁开0.6 mm,深度1.6 mm)。暴露脑表面,在PrL 区上方开一直径约2 mm 的小孔,电极夹持器夹持不锈钢套管(长1.6 mm,直径0.6 mm),缓慢推进至PrL 脑区上方1 mm 处。套管露出部分使用牙科水泥固定于颅骨,为防止套管阻塞,待牙科水泥凝固后将备好的管芯插入套管内。大鼠恢复1 周后进行行为学实验。
行为学检测前10 min,将1 μL 微量注射器通过导向套管插入PrL 核团中心,注射针头尖端位于导向套管下方1 mm,通过导向套管向6-OHDA 损毁组和假手术组大鼠左侧PrL 内缓慢给予0.5 μL 下述 药 物: DMSO,BIMU8 (6.5、 13.0 和26.0 μg),GR113808 (2.5、5.0 和10.0 μg)。于1 min 内匀速完成药物注射,之后静置针1 min(利于脑区药物扩散吸收)。联合注射药物时,2 次注射药物间隔时间5 min。
1.4 行为学实验
行为学检测于大鼠MFB 损毁后第4 周进行。所有实验均在独立光线控制的环境中进行。固定检测时间为每天上午9:00 至12:00,所有实验由数码相机录制,对数据进行离线分析。
1.4.1 旷场实验 旷场为无盖的有机玻璃盒(100 cm×100 cm×40 cm),内壁和底部均为白色不透光不反光有机玻璃材质,其底部由黑线分割成25 个方格 (20 cm×20 cm),中心的9 格是中央区,剩余格是外周区。实验初始,将大鼠放置在旷场的中心位置,记录5 min 内大鼠的穿格数(反映水平运动能力)和直立次数(反映竖直运动能力)。记录大鼠在5 min 内中央区停留时间并计算其百分比(中央区停留时间/5 min×100%),反映大鼠的焦虑样行为变化。若中央区停留时间百分比降低,表明大鼠出现焦虑样行为。每只大鼠实验结束后,在旷场中喷洒150 mL·L-1乙醇去除残留气味干扰。
1.4.2 高架十字迷宫实验 高架十字迷宫正中间是一个正方形边长10 cm 的中央区,由四周2 个开放臂(50 cm×10 cm) 和2 个闭合臂(50 cm×10 cm)交叉构成。测试时,将大鼠面朝开放臂置于中央区,记录5 min 内大鼠进入开放臂和闭合臂的次数及相应的停留时间。焦虑行为由以下2 个参数判断:开放臂入臂次数百分比[开放臂进入次数/(开放臂入臂总次数+闭合臂入臂总次数)×100%]和开放臂停留时间百分比[开放臂停留时间/(开放臂停留时间+闭合臂停留时间) ×100%]。总入臂次数反映大鼠的运动能力,如果开放臂入臂次数减少、开放臂停留时间百分比降低,则提示大鼠有焦虑行为。
1.5 大鼠脑组织TH 免疫组织化学染色
行 为 学 实 验 结 束 后,40 g·L-1水 合 氯 醛(400 mg·kg-1)腹腔注射麻醉大鼠,灌注固定,取脑,加入300 g·L-1蔗糖,4 ℃过夜沉底。冰冻切片机连续冠状切片,切片厚度30 μm,切片隔3 张取1 张。采用SP 法进行常规免疫细胞化学染色,其中一抗为多克隆兔抗TH 抗体(1:1 000)。显微镜下观察大鼠脑组织SNc 和VTA 中DA 能神经元坏死程度,计算酪氨酸羟化酶免疫反应(tyrosinehy droxylase immunoreaction,TH-ir) 阳性神经元百分率。
1.6 大鼠脑组织中单胺类递质水平检测
建模成功后,在第4 周应用电化学-高效液相色 谱 检 测 法 (high performance liquid chromatography with electrochemical detection,HPLC-ED)检测2 组大鼠纹状体、mPFC、杏仁核(Amygdala,Amy) 和 腹 侧 海 马 (ventral hippocampus,vHip) 脑 组 织 中3 种 单 胺 类 递 质DA、 5-HT 和NE 水 平。 40 g·L-1水 合 氯 醛(400 mg·kg-1)腹腔注射麻醉大鼠后,迅速分离纹状体、mPFC、Amy 和vHip,按1 mL·4 mg-1脑组织配比加入高氯酸(0.3 mol·L-1),超声粉碎仪打碎匀浆,低温高速离心后,取上层清液,将上层清液与流动相按1∶2 比例混匀后上机检测。通过定量标准品溶液(美国Sigma 公司) 建立标准品曲线,计算脑组织中DA、5-HT 和NE 水平。
1.7 统计学分析
采用SigmaPlot 11.0 统计软件进行统计学分析。旷场实验中大鼠穿格次数、直立次数和中央区停留时间百分比,高架十字迷宫实验中开放臂入臂次数百分比、开放臂停留时间百分比和总入臂次数,大鼠脑组织中TH-ir 阳性细胞百分率及不同脑区DA、5-HT 和NE 水平均以表示。行为学数据组间比较采用单因素方差分析,之后采用Dunnett’s 检验进行多重比较;TH-ir 阳性细胞百分率及不同脑区DA、5-HT 和NE 水平2 组间比较采用两独立样本t检验。以ɑ=0.05 为检验水准。
2 结 果
2.1 旷场实验中各组大鼠自发运动能力
与假手术组比较,6-OHDA 毁损组大鼠穿格次数和直立次数均明显减少(P<0.01)。单因素方差分析结果显示:与PrL 内注射DMSO 组比较,对照组和6-OHDA 损毁组大鼠PrL 内注射BIMU8和(或)GR113808 后水平和垂直运动能力差异均无统计学意义(P>0.05)。见图1。
2.2 旷场实验中各组大鼠的焦虑行为
旷场实验中各组大鼠中央区停留时间百分比见图2。与假手术组比较,6-OHDA 损毁组大鼠中央区停留时间百分比明显降低(P<0.01)(图2A)。在假手术组,与PrL 内注射DMSO 组比较,PrL 内注 射BIMU8 (6.5、13.0 和26.0 μg) 和(或)GR113808(2.5、5.0 和10.0 μg)后大鼠中央区停留时间百分比差异无统计学意义(BIMU8:F=0.21,P>0.05;GR113808:F=0.10,P>0.05)(图2B 和D)。 在6-OHDA 毁损组,与PrL 内注射DMSO 组比较,PrL 内注射不同剂量BIMU8 后大鼠中央区停留时间百分比升高(F=9.61,P<0.01),注 射26.0 μg BIMU8 组 和 注 射10.0 μg GR113808/26.0 μg BIMU8 组大鼠中央区停留时间百分比差异有统计学意义(均P<0.05)(图2C);与PrL 内注射DMSO 组比较,PrL 内注射不同剂量GR113808 组大鼠中央区停留时间百分比升高(F=4.88,P<0.01),注射10.0 μg GR113808 组大鼠中央区停留时间百分比差异有统计学意义(P<0.05)(图2E)。
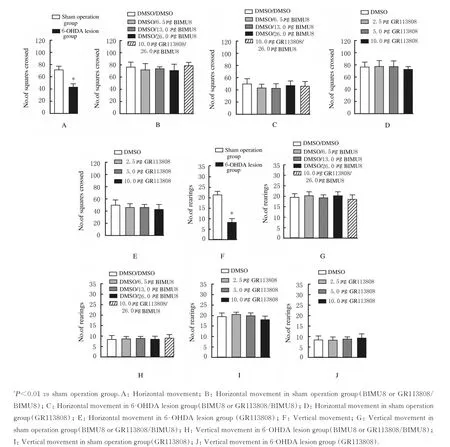
图1 旷场实验中各组大鼠自发运动能力Fig.1 Spontaneous locomotor activities of rats in open field test in various groups
2.3 高架十字迷宫实验中各组大鼠的焦虑行为
高架十字迷宫实验中各组大鼠开放臂入臂次数百分比和开放臂停留时间百分比见图3。与假手术组比较,6-OHDA 毁损组大鼠开放臂入臂次数百分比(P<0.01)和开放臂停留时间百分比均明显减少(P<0.05)(图3 A 和F)。
在假手术组,与PrL 内注射DMSO 组比较,PrL 内 注 射BIMU8 (6.5、13.0 和26.0 μg) 和(或)GR113808(2.5、5.0 和10.0 μg)组大鼠开放臂入臂次数百分比(BIMU8:F=0.10,P>0.05;GR113808:F=0.18,P>0.05)和开放臂停留时间百分比(BIMU8:F=0.02,P>0.05;GR113808:F=0.03,P>0.05)差异无统计学意义(图3B、D、G 和I)。在6-OHDA 损毁组,与PrL 内注射DMSO 组比较,PrL 内注射BIMU8(6.5、13.0 和26.0 μg)组大鼠开放臂入臂次数百分比和开放臂停留时间百分比升高(F=4.46,P<0.01;F=4.95,P<0.01),注 射26.0 μg BIMU8 和注射10.0 μg GR113808/26.0 μg BIMU8组大鼠开放臂入臂次数百分比和开放臂停留时间百分比差异均有统计学意义(P<0.01)(图3C 和H);在6-OHDA 损毁组,与PrL 内注射DMSO 组比 较,PrL 内 注 射 GR113808 (2.5、 5.0 和10.0 μg)组大鼠开放臂进入臂次数百分比和开放臂停留时间百分比升高(F=3.72,P<0.05;F=4.60,P<0.01),注射10.0 μg GR113808 组大鼠开放臂入臂次数百分比和开放臂停留时间百分比差异有统计学意义(P<0.05 或P<0.01)(图3E和J)。
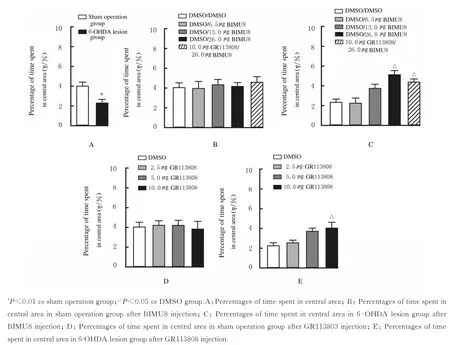
图2 旷场实验中各组大鼠中央区停留时间百分比Fig.2 Percentages of time spent in central area of rats in various groups in open field test
2.4 2 组大鼠脑组织TH 免疫组织化学染色结果
与假手术组比较,6-OHDA 损毁组大鼠SNc 和VTA 脑组织中TH-ir 阳性神经元丢失程度明显加剧。假手术组大鼠含维生素C 生理盐水注射侧(左侧) SNc 脑组织中TH-ir 阳性神经元百分率下降(4.82±1.10)%,6-OHDA 损毁组大鼠左侧SNc脑组织中TH-ir 阳性神经元百分率下降(96.03±0.37)%(P<0.01);假手术组大鼠含维生素C 生理盐水注射侧(左侧) VTA 脑组织中TH-ir 阳性神经元百分率下降(1.37±0.24)%,6-OHDA损毁组大鼠左侧VTA 脑组织中TH-ir 阳性神经百分率下降(37.06±0.84)%(P<0.01)。见图4。
2.5 2 组大鼠焦虑相关脑区单胺类递质水平
与假手术组比较,6-OHDA 毁损组大鼠损毁侧纹状体、Amy、mPFC 和vHip 脑组织中DA 水平均明显降低(P<0.01),而上述脑区的脑组织中NE和5-HT 水平差异无统计学意义(P>0.05)。见表1。
3 讨 论
本研究采用MFB 注射6-OHDA 的方法建立PD 大鼠模型,该方法是目前最常用的一种模拟黑质-纹状体通路DA 神经元丢失的动物模型。TH 免疫组织化学染色常用于确认6-OHDA 损毁MFB 后DA 神经元的坏死程度[10]。本研究中TH 免疫组织化学染色结果显示:6-OHDA 损毁MFB 后,大鼠SNc 区脑组织中TH-ir 阳性神经元几乎完全损毁,VTA 区脑组织中TH-ir 阳性神经元损毁约40%,表明MFB 损毁后,SNc 几乎全部和VTA 的部分DA 能神经元均产生明显的变性坏死。

图3 高架十字迷宫实验中各组大鼠的焦虑行为Fig.3 Anxiety behavions of rats in various groups in elevated plus-maze test
旷场实验是目前评估大鼠等啮齿类动物自发运动能力的常用实验方法。在本研究中,6-OHDA 单侧损毁MFB 的大鼠水平运动能力和垂直运动能力均大幅降低,表明DA 的缺失导致大鼠运动能力下降,与本课题组前期的研究[3,6-7,10]结果一致;而假手术组和6-OHDA 毁损组大鼠PrL 局部注射5-HTR4 激动剂BIMU8 或拮抗剂GR113808 后在旷场实验中的自主运动能力均无变化。本研究结果提示:BIMU8 和GR113808 对焦虑行为的影响与大鼠的运动能力无直接关联。
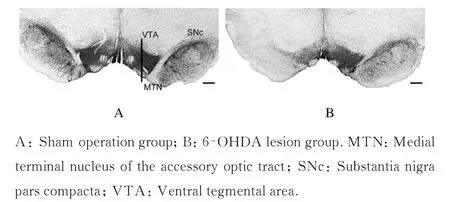
图4 2 组大鼠SNc 和VTA 脑组织TH 免疫组织化学染色结果(Bar = 400 μm)Fig. 4 Results of TH immunohistochemical staining of SNc and VTA in brain tissue of rats in two groups (Bar =400 μm)
焦虑是PD 最为常见的神经精神症状之一,可出现于PD 运动性表征之前[10]。但是PD 模型大鼠是否表现焦虑样行为,研究结果不尽相同。本研究的行为学研究结果表明: 与假手术组比较,6-OHDA 损毁组大鼠在旷场实验中央区停留时间百分比明显降低,高架十字迷宫实验中开放臂的进入次数和停留时间百分比也明显下降,提示单侧6-OHDA 损毁MFB 的PD 模型大鼠产生明显的焦虑样行为,与前期的研究结果[10-11]一致。
PD 患 者 或PD 模 型 动 物 大 脑SNc 和VTA 中DA 能神经元的变性坏死丢失,致使基底神经节环路进行性功能紊乱,并且黑质-纹状体通路变性还导致5-HT 递质系统的结构和功能改变[12]。研究[13-14]显示:中枢神经系统的单胺类神经递质的水平与焦虑和抑郁症状的发生发展有密切关联。单胺类递质系统功能紊乱是抑郁和焦虑等情感障碍产生的机制之一[15],PD 患者焦虑的产生与神经系统的改变有关[9]。有研究[16]表明:DA 与PD 患者焦虑样行为有密切关联,如PD 患者的社交恐惧症与持续的DA 神经递质和DA 受体抑制有关。腹侧纹状体中DA 转运体的降低与抑郁和焦虑症状有密切关联[17]。DA 神经元退化的啮齿动物表现出焦虑样行为。大鼠的焦虑样行为可能直接与mPFC 的DA能神经元退化有关。本研究结果表明:与同侧注射含维生素C 生理盐水的假手术组比较,6-OHDA 损毁组大鼠MFB 损伤同侧纹状体、mPFC、Amy 和vHip 中脑组织中DA 水平均明显降低,而5-HT 和NE 水平差异无统计学意义。纹状体、mPFC、Amy 和vHIP 在焦虑的发生发展中有重要作用[10,18]。上述研究结果提示:在PD 状态下,DA和5-HT 神经递质功能异常在PD 模型大鼠焦虑行为的调节中起重要作用。
研 究[6,19]表 明:腹 侧mPFC 参 与 焦 虑 样 行 为的调节。有研究[20]报道:电毁损大鼠腹侧mPFC,在旷场和高架十字迷宫实验中可诱发大鼠的焦虑样行为。而5-HT 系统参与认知功能、情绪情感和焦虑的调控[11]。5-HTR4 在额叶皮层、内嗅皮层、Amy 和海马组织中呈高水平表达[8]。大鼠PrL区5-HT 神经元参与调节类似焦虑的行为。研究[6]表 明:在PrL 区 注 射5-HT 受 体1A (5-HTR1A)激动剂可产生明显的焦虑样作用;而给予5-HTR1A 拮抗剂则产生了明显抗焦虑样作用。研究[21]显示:氟西汀在高架十字迷宫实验中发挥的抗焦虑作用与5-HTR4 的激活有关。 短期应用5-HTR4 激动剂的大鼠和长期应用选择性5-HT 再摄取抑制剂的大鼠表现出相同的抗抑郁和抗焦虑样行为[22]。5-HTR4 敲除小鼠在旷场实验中央区的停留时间缩短,提示产生焦虑样行为,5-HTR4 在焦虑的调节中起重要作用。 但mPFC 的PrL 区5-HTR4 在正常大鼠焦虑行为以及PD 相关焦虑中的作用目前还所知甚少。
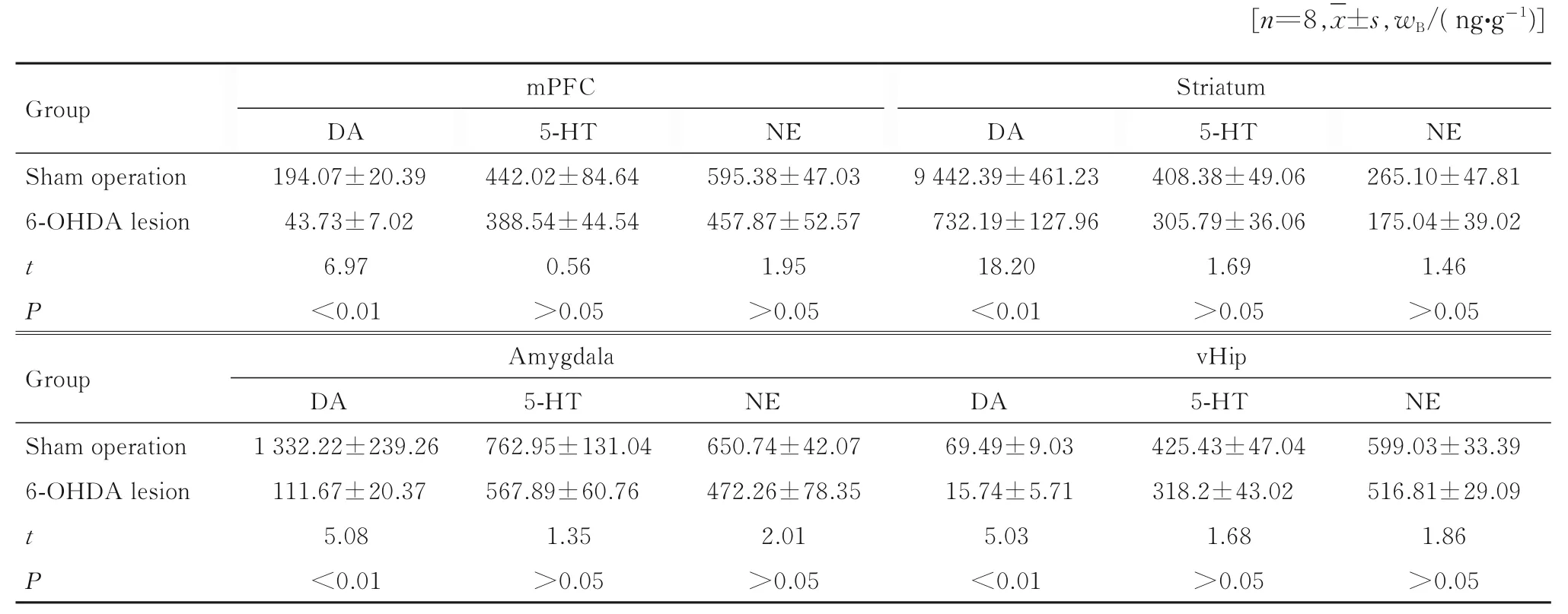
表1 2 组大鼠毁损侧mPFC、纹状体、Amy 和vHip 脑组织中DA、5-HT 和NE 水平Tab.1 Levels of DA, 5-HT and NE in mPFC, striatum,and Amy in brain tissue in injured sides of rats in two groups
本研究结果表明:假手术组大鼠mPFC 的PrL区注射5-HTR4 激动剂BIMU8 或拮抗剂GR113808对其焦虑样行为均无影响,与上述研究报道不一致。研究[23]表明:基底外侧杏仁核局部给予5-HTR4 激动剂RS67333 或拮抗剂RS23597,均对ACPA (CB1 受体激动剂) 诱导的焦虑行为无影响。上述研究结果的不一致可能与以下因素有关:给药方式、药物注射的部位和剂量及焦虑行为的检测手段等。
本研究结果表明:6-OHDA 毁损组大鼠PrL 内注射5-HTR4 激动剂BIMU8 和(或) 拮抗剂GR113808 后,旷场实验中大鼠在中央区的停留时间以及在高架十字迷宫实验中的开放臂入臂次数和开放臂停留时间百分比均增加,提示6-OHDA 毁损组大鼠PrL 内注射5-HTR4 激动剂或拮抗剂均有明显的抗焦虑样作用。上述结果提示:PrL 脑区的5-HTR4 在PD 相关的焦虑调节中发挥重要作用。
PrL 与焦虑相关的脑区,如缝核和Amy 具有直接的纤维联系,并调节这些脑区的神经活动。研究[24]表明:焦虑状态下缝核5-HT 神经元过度活动。本课题组前期研究[25]也证实:PD 状态下,缝核5-HT 神经元电活动增强。杏仁核与情感活动有重要关系,而PrL 还可以抑制杏仁核的神经元活动[26]。本课题组前期的研究[3]证明:杏仁核对于PD 模型大鼠焦虑样行为有重要的意义。因此本文作者推测:大鼠PrL 脑区给予5-HTR4 激动剂或拮抗剂后,焦虑相关核团的活动可能受到调节,从而影响大鼠焦虑样行为的表达,而其具体机制尚需要进一步研究。

