人肝细胞生长因子基因慢病毒载体的构建及其在骨髓间充质干细胞中的表达
徐宠俊, 何荷蕃, 林 群, 章 涛
(1. 福建医科大学附属第二医院麻醉科,福建 泉州 362000;2. 福建医科大学附属第一医院麻醉科,福建 福州350005;3. 福建医科大学免疫实验室,福建 福州350004)
神经病理性疼痛(neuropathic pain,NP)是一种以神经损伤、神经兴奋和伤害性神经元过度活跃为特征的慢性疼痛状态。目前临床主要使用药物治疗,但效果并不理想。随着对NP 所涉及的生物学过程的深入了解,新的治疗方案也不断出现。神经胶质细胞占中枢神经系统的70%,主要包括小胶质细胞和星形胶质细胞2 种类型,神经胶质细胞的激活和神经胶质细胞相互作用在NP 发展过程中起关键作用[1]。研究[2]显示:小胶质细胞抑制剂米诺环素可通过抑制脊髓胶质细胞的激活减轻氧化应激和炎症反应,从而减轻慢性压迫性损伤大鼠的NP,表明抑制脊髓胶质细胞的激活可以减少啮齿动物的NP。
肝细胞生长因子(hepatocyte growth factor,HGF)是一种来源于成纤维细胞和间充质细胞的多功能细胞因子。研究[3-6]显示:HGF 具有促血管生成,促进细胞增殖、迁移和侵袭,抗纤维化及抗细胞凋亡等功能。研究[7-8]表明:HGF 在体内具有保护外周和中枢神经系统神经元免受损伤及促进神经再生的作用。最新研究[9]显示:肌肉或鞘内注射重组质粒-HGF(pUDK-HGF)可以抑制脊髓胶质细胞的激活和炎症反应,通过外周或中枢机制减轻皮肤肌肉切开牵拉诱导的疼痛行为。因此HGF有可能成为临床上一种潜在的治疗NP 的药物。
裸质粒注射由于不能长时间表达、在体内浓度不高并可能引起排斥反应等,限制其在临床实验中的使用。近年来干细胞是各个学科研究的热点,其来源丰富,移植排斥反应少,且干细胞移植本身也对疼痛治疗有潜在疗效[10]。若将干细胞治疗与重组HGF 高表达结合起来,将对疼痛的治疗产生推动作用。因此本研究构建携带HGF 基因的慢病毒载体,并将慢病毒载体感染骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs),以期为后续建立稳定表达HGF 基因的BMSCs 细胞系,探讨HGF 在NP 治疗中的作用及机制奠定基础。
1 材料与方法
1.1 细胞和试剂
SD 大鼠BMSCs 由福建医科大学附属第一医院林群副教授惠赠。人胚肾293T 细胞购自中国科学院昆明细胞库,大肠杆菌感受态细胞DH5α 购自天根生化科技(北京)有限公司。pUC-HGF 质粒由日本大阪医学院生物医学研究中心TOSHIKAZU NAKMUM 教授惠赠,pNL-增强绿色荧光蛋白(EGFP)慢病毒载体、包装质粒pHELPER 和包膜质粒pVSVG 由福建医科大学免疫实验室章涛教授惠赠,限制性内切酶XbaⅠ、SalⅠ、AseⅠ、NotⅠ、PvuⅠ、NheⅠ、AgeⅠ、SpeⅠ及Klenow 酶 和T4 DNA 连接酶购自美国NEB 公司,质粒小量和中量抽提试剂盒购自德国Qiagen 公司,核酸胶回收试剂盒、逆转录试剂盒和PCR 试剂盒购自日本TaKaRa 公司,慢病毒浓缩试剂盒购自美国Biomiga 公司,胎牛血清、DMEM 和胰酶购自美国Hyclone 公司,ELISA 检测试剂盒Immunis HGF EIA 购自日本特殊免疫研究所,转染及其他试剂购于美国Invitrogen 公司。
1.2 pUC-HGF 质粒酶切鉴定及测序
pUC-HGF 质粒图谱见图1。选择SalⅠ酶行酶切鉴定,酶切体系(20 μ L):pUC-HGF 1 μ L,SalⅠ0.5 μL,10×Buffer3 2 μL,10×BSA 2 μL,ddH2O 14.5 μL。37 ℃酶切过夜后电泳观察。鉴定后送至生工生物工程(上海)股份有限公司进行基因测序。

图1 pUC-HGF 质粒结构示意图Fig.1 Schematic diagram of structure of pUC-HGF plasmid
1.3 慢病毒载体pNL-EGFP 质粒酶切鉴定及测序
pNL-EGFP 质粒图谱及酶切位点见图2。根据质粒图谱选择NheⅠ酶进行酶切鉴定。鉴定后送生工生物工程(上海)股份有限公司进行基因测序。
1.4 重组慢病毒载体pNL-HGF-EGFP 的构建及鉴定
1.4.1 目的基因片段的获取SalⅠ单酶切获取目的基因,电泳条带相隔太近,不易切割回收目的基因,故寻找添加一个酶切位点,该位点既不存在目的基因片段上,又可以将pUC 19 载体骨架切割成小片段。基因测序结果显示:AseⅠ酶切位点只存在于质粒pUC-HGF 的pUC 19 载体骨架上,用SalⅠ酶和AseⅠ酶酶切pUC-HGF 质粒获取目的基因片段(包含SRα promoter启动子、HGF cDNA 序列及polyA 尾,该片段可完整表达HGF 基因)。SalⅠ和AseⅠ双酶切体系(20 μL) 如下:pUCHGF 1 μL,SalⅠ0.5 μL,AseⅠ0.5 μL,10×Buffer3 2 μL,10×BSA 2 μL,ddH2O 14 μL。37 ℃酶切过夜后Klenow 酶补平黏性末端胶回收。
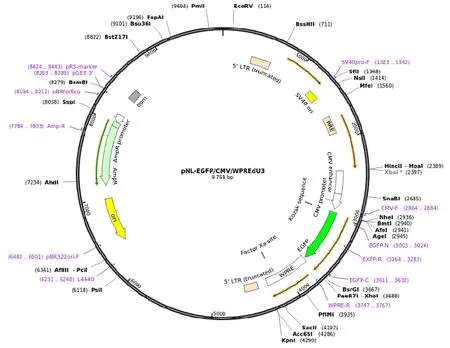
图2 pNL-EGFP 质粒结构示意图Fig.2 Schematic diagram of structure of pNL-EGFP plasmid
1.4.2 慢病毒载体pNL-EGFP 线性化 基因测序结果及pNL-EGFP 质粒图谱显示:pNL-EGFP 质粒只存在1 个XbaⅠ酶切位点(该位点可用于外源基因插入而不影响质粒其他基因的表达),用XbaⅠ单酶切载体,酶 切 体 系(20 μ L): pNL-EGFP 2 μL,XbaⅠ0.5 μL,10×Buffer2 2 μL,10×BSA 2 μL,ddH2O 13.5 μL。37 ℃酶 切 过 夜 后Klenow 酶补平粘性末端胶回收。
1.4.3 目的基因片段和载体连接 取上述酶切回收产物进行连接反应。连接体系(10 μL):pUCHGF 酶切回收产物6 μL,pNL-EGFP 载体酶切回收产物2 μL,T4 DNA 连接酶1 μL,T4 DNA 连接酶Buffer 1 μL。4 ℃连接过夜后转化至大肠杆菌感受态细胞DH5α 中,均匀接种在含有相应浓度氨苄青霉素抗性的LB 培养板上,37 ℃恒温箱中培养过夜。
1.4.4 重组质粒鉴定及基因测序 挑取若干个单菌落进行质粒小量提取电泳,根据电泳结果挑选疑似重组的质粒,用PvuⅠ单酶切或者AgeⅠ+SpeⅠ双酶切鉴定。前期基因测序结果显示:pUC-HGF质粒中只存在一个PvuⅠ酶切位点和SpeⅠ酶切位点,分别位于3 592 bp 片段中的396 bp 位点和896 bp 位点上; pNL-EGFP 质粒中存在2 个PvuⅠ酶切位点,位于质粒的7 527 bp 和8 475 bp 位点上;只存在1 个XbaⅠ酶切位点和AgeⅠ酶切位点,分别位于质粒中的2 397 bp 位点和2 945 bp 位点上。由于采用平端连接,目的基因插入的方向不定,无论目的基因是以正向插入还是反向插入,HGF 基因均可表达,因为目的基因片段含有编码HGF 基因的完整的SRα promoter 启动子和polyA 尾,当目的基因以正向插入XbaⅠ酶切位点时,经PvuⅠ酶切可获得948(2 个PvuⅠ酶 切 位 点8 475 bp 与7 527 bp 之差)、4 077 和8 326 bp 片段,当目的基因以反向插入XbaⅠ酶切位点时,经PvuⅠ酶切可获得948 、5 526 和6 877 bp 片段;当目的基因以正向插入XbaⅠ酶切位点时,经AgeⅠ+SpeⅠ酶切可获得3 280 和10 071 bp 片段,当目的基因以反向插入XbaⅠ酶切位点时,经AgeⅠ+SpeⅠ酶切可获得1 480 和11 871 bp 片段。鉴定正确后送至生物工程(上海)有限公司进行测序鉴定,采用中量抽提试剂盒制备重组慢病毒载体。
1.5 慢病毒包装及滴度测定
转染前1~2 d,293T 细胞以6×106mL-1密度接种于直径为10 cm 的细胞培养皿中。待细胞密度达70%~80%时进行转染。参照lipofectamine 2000使用说明,pNL-HGF-EGFP(或pNL-EGFP) 与包装质粒pHELPER 及包膜质粒pVSVG 共转染293T 细胞,转染后8 h 更换完全培养基,继续培养48 h 后,收集细胞上清液中的慢病毒颗粒并进行浓缩,采用倍比稀释法检测病毒滴度。
1.6 慢病毒感染BMSCs
实验组用传代至第3 代大鼠BMSCs 进行感染,加入含感染复数(MOI) 为100 的pNL-HGFEGFP 慢病毒及感染增强剂聚凝胺的培养基,12 h更换培养基。同时以慢病毒pNL-EGFP 感染大鼠BMSCs 作为对照组。
1.7 RT-PCR 法检测各组BMSCs 中HGF mRNA表达水平
根据GenBank 人HGF 基因序列设计合成引物:上 游 引 物5′-AAGATTGTTATC-GTGGGAATGG-3′,下 游 引 物5′-CCTATG-TTTGTTCGTGTTGGAA-3′,扩增片段长度为352 bp。设计并合成内参GAPDH 引物:上游引物5′-CAAGGTCATCCATGACAACTTTG-3′,下 游 引 物5′-GTCCACCACCCTGTTGCTGTAG-3′,扩 增 片 段 长度为496 bp。实验组和对照组分别提取BMSCs 细胞RNA,进行RT-PCR,扩增参数为:94 ℃、30 s,55 ℃、30 s,72 ℃、1 min,共30 个循环。扩增产物经琼脂糖凝胶电泳分离,凝胶成像系统拍摄图片,经Band Scan 图像分析软件进行吸光度(A)值扫描分析,以HGF 条带A 值与内参GAPDH 条带A 值的比值表示HGF mRNA 表达水平。
1.8 ELISA 法检测各组BMSCs 细胞上清中HGF蛋白水平
实验组和对照组慢病毒分别感染大鼠BMSCs 48 h 后,收集上清,离心弃沉淀,将细胞上清稀释20 倍后,用ELISA 试剂盒检测HGF 蛋白浓度,于酶标仪上波长490 nm 或492 nm 处读取各孔的A 值,以A 值为纵坐标(Y),相应的HGF 标准品浓度为横坐标(X),绘制标准曲线,样品的HGF蛋白水平可根据其A 值由标准曲线换算出。
1.9 统计学分析
采用SPSS 20.0 统计软件进行统计学分析。实验组和对照组细胞中HGF mRNA 表达水平和蛋白水平均符合正态分布,以表示,2 组间样本均数比较采用t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 pUC-HGF 质粒酶切鉴定及基因测序结果
pUC-HGF 经SalⅠ单酶切后,凝胶电泳获得3 500 bp 的 片 段(包 含SR α promoter 启 动 子900 bp、 HGF cDNA 序 列2 300 bp 及polyA 尾300 bp) 和2 700 bp 的片段,见图3。基因测序结果显示:质粒图谱中人HGF cDNA 片段与GenBank (BC130286) 中人HGF 基因序列一致,且2 个SalⅠ酶切位点之间的序列长度为3 592 bp,与质粒图谱中的3 500 bp 长度大致相符,SalⅠ酶切位点与NotⅠ酶切位点间的300 bp 片段中含有基因转录的polyA 尾序列。

图3 pUC-HGF 质粒SalⅠ单酶切电泳图Fig. 3 Electrophoregram of single enzymatic digestion of pUC-HGF plasmid by SalⅠ
2.2 慢病毒载体pNL-EGFP 质粒酶切鉴定及基因测序结果
pNL-EGFP 质粒经NheⅠ单酶切后,凝胶电泳获得9 759 bp 片段(图4);基因测序结果显示:pNL-EGFP 质粒序列长度为 9 759 bp,与pNL-EGFP 质粒图谱上标注的序列长度相符。
2.3 目的基因片段的获取和重组质粒筛选
pUC-HGF 质粒经SalⅠ和AseⅠ双酶切后,凝胶电泳获得3 592 bp 的片段(包含SRα promoter 启动子、HGF cDNA 序列及polyA 尾)(图5)。pNLEGFP 质粒经XbaⅠ单酶切获得9 759 bp 的载体片段(图6)。挑取若干个单菌落进行质粒小量提取后电泳筛选重组质粒(图7)。
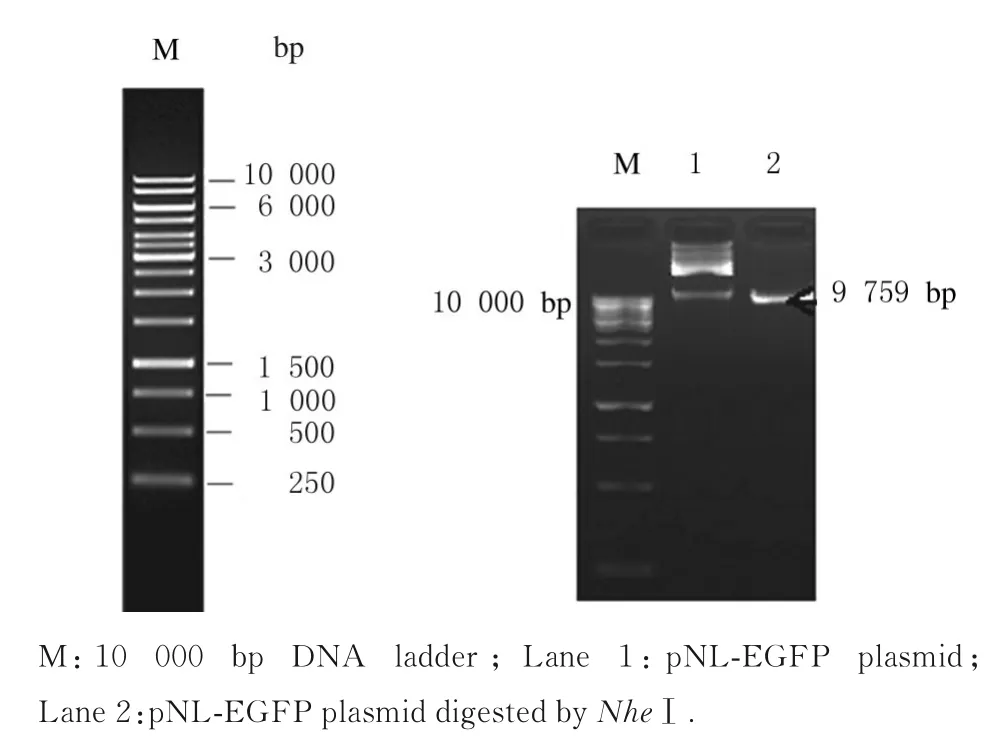
图4 pNL-EGFP 质粒NheⅠ单酶切电泳图Fig. 4 Electrophoregram of single enzymatic digestion of pNL-EGFP plasmid by NheⅠ

图5 pUC-HGF 质粒SalⅠ和Ase Ⅰ酶切电泳图Fig. 5 Electrophoregram of doube enzymatic digestion of pUC-HGF plasmid by SalⅠand Ase Ⅰ
2.4 重组慢病毒载体pNL-HGF-EGFP 酶切鉴定和基因测序结果
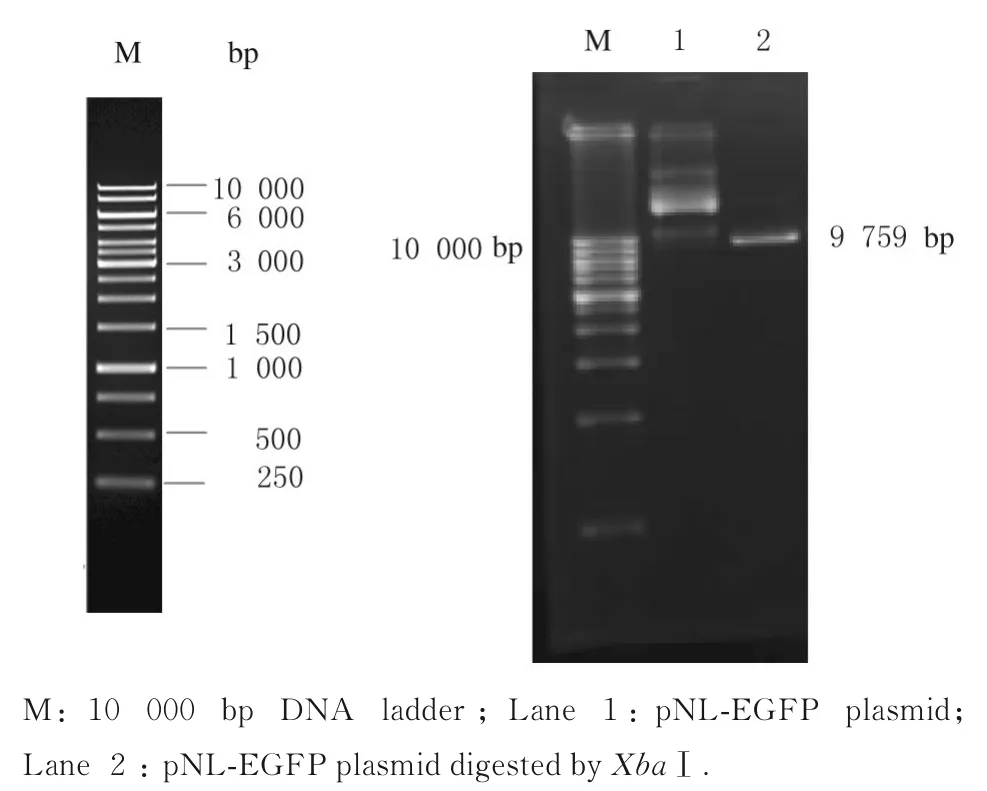
图6 pNL-EGFP 质粒XbaⅠ单酶切电泳图Fig. 6 Electrophregram of single enzymatic digestion of pNL-EGFP plasmid

图7 重组质粒pNL-HGF-EGFP 电泳图Fig. 7 Electrophoregram of recombinant plasmid pNLHGF-EGFP
pNL-HGF-EGFP 重组慢病毒载体经PvuⅠ单酶切或AgeⅠ和SpeⅠ双酶切鉴定(图8 和9),电泳图中的条带与预期计算的条带大致相符,提示目的基因插入方向正确。图8 中的11 871 bp 条带距离标准条带太远,可能是电泳上样浓度过高或者电泳时间过短,为确保重组质粒准确性,将重组质粒送至生工生物工程(上海)有限公司测序,测序结果显示目的基因插入的3 592 bp 片段与第一次pUCHGF 质粒送至生工生物工程(上海)有限公司测序的3 592 bp 片段序列完全一致。
2.5 pNL-HGF-EGFP 慢病毒感染293T 细胞感染效率和病毒滴度
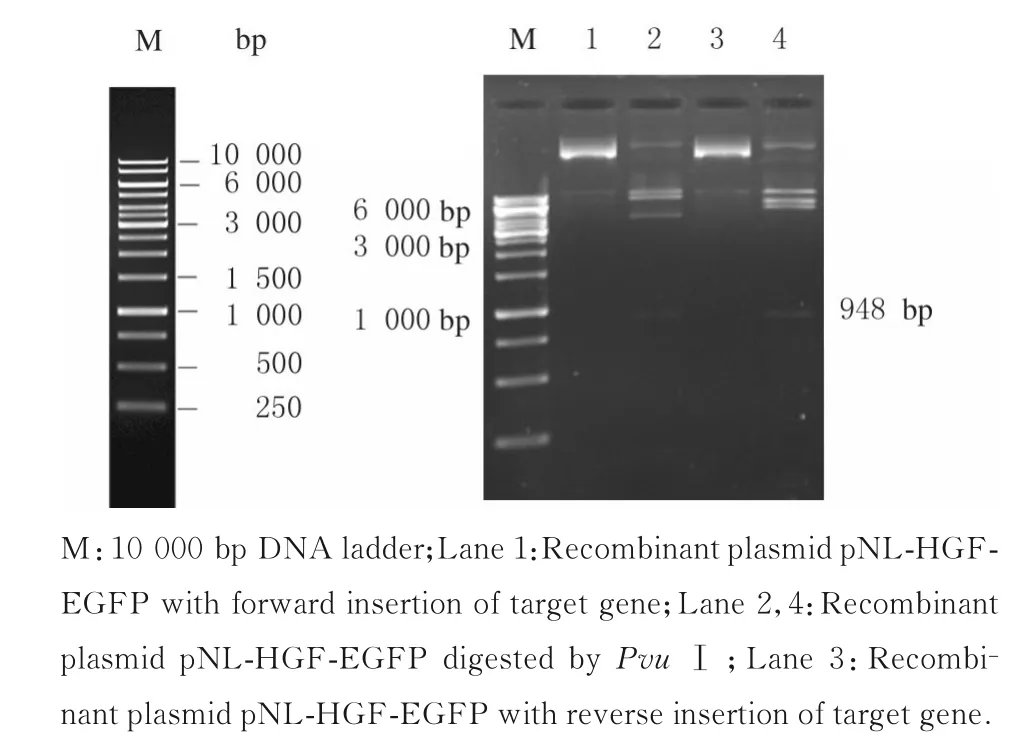
图8 重组质粒pNL-HGF-EGFP PvuⅠ单酶切电泳图Fig.8 Electrophoregram of single denzymatic digestion of recombinant plasmid pNL-HGF-EGFP by PvuⅠ
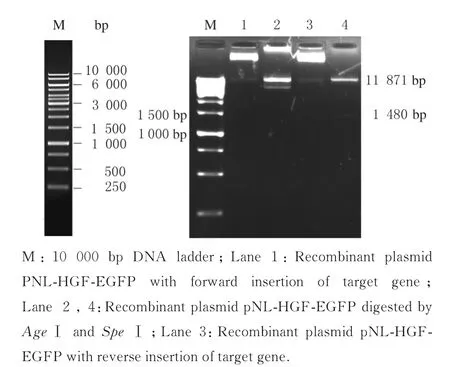
图9 重组质粒pNL-HGF-EGFP AgeⅠ和SpeⅠ双酶切电泳图Fig. 9 Electrophoregram of double enzymatic digestion of recombinant plasmid pNL-HGF-EGFP by AgeⅠand SpeⅠ
pNL-HGF-EGFP 感染处于对数生长期的293T细胞,感染48~72 h 细胞高表达绿色荧光蛋白(图10)。采用倍比稀释法检测病毒滴度,在荧光显微镜下观察并数出最后2 个荧光细胞克隆数,假设为X 和Y,则病毒滴度(TU·mL-1) = (X+Y×10)×1 000/2/X 孔的病毒液的含量(μL)。对照组病毒滴度为1.2×107TU·mL-1,实验组病毒滴度为1.5×106TU·mL-1。
2.6 各组BMSCs 中HGF mRNA 表达水平
RT-PCR 法检测结果见图11。1 号泳道为对照组,未扩增出条带;3 号泳道为实验组,扩增长度与预期扩增352 bp 的HGF 基因长度相符合;2 和4 号泳道为内参照GAPDH,扩增长度约496 bp,与预期相符。与对照组(0.177±0.055)比较,实验组BMSCs 中HGF mRNA 表达水平(4.934±0.098)明显升高(P<0.05)。

图10 荧光显微镜观察pNL-EGFP 和pNL-HGF-EGFP 慢病毒感染293T 细胞的形态(×10)Fig.10 Morphology of pNL-EGFP and pNL-HGF-EGFP lentivirus-infected 293T cells observed by fluorescence microscope(×10)
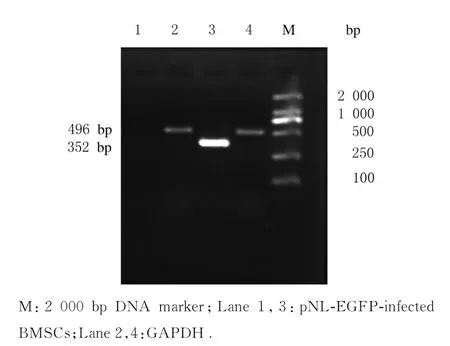
图11 RT-PCR 法检测各组BMSCs 细胞中HGF mRNA 表达电泳图Fig. 11 Electrophoregram of expressions of HGF mRNA in BMSCs in various groups detected by RTPCR method
2.7 各组BMSCs 上清中HGF 蛋白水平
实验组BMSCs 上清中HGF 蛋白水平为(115.44±22.16) μg·L-1,较 对 照 组[(1.32+0.53)μg·L-1]明显升高(P<0.05)。
3 讨 论
HGF 基因定位于人第7 号染色体的长臂上,包含18 个外显子和17 个内含子,是一种双链异二聚体结构,由一条具有氨基尾端的发夹环及kringle 结构的α 链和一条具有丝氨酸酶同源结构域的β 链经二硫键链接而成,其结构中含有728 个氨基酸。HGF 的所有生物学活性均通过高亲和力细胞表面受体c- MET 原癌基因介导。近年来,在坐骨神经慢 性 缩 窄 性 损 伤 (chronic constriction injury,CCI)[11-12]和肌腱损伤[13]的临床前模型中,HGF被证明可以减轻神经性疼痛。另有研究[14-15]报道:HGF 治疗可改善糖尿病患者神经病变的临床结果,降低疼痛评分,改善患者3 个月的生活质量。临床试验[16]表明:编码人HGF 基因的裸质粒pUDKHGF 能减轻严重肢体缺血(critical limb ischemia,CLI) 患者的疼痛。BARĆ 等[17]在临床上使用表达HGF 基因裸质粒pIRES/VEGF165/HGF 治疗CLI 患者,患者四肢注射pIRES/VEGF165/HGF耐受性良好,并降低了视觉模拟评分(visual analogue scale,VAS)值,提示pIRES/VEGF165/HGF 减轻了慢性皮肤创面引起的疼痛。因此,对HGF 在疼痛中作用的深入研究,可能为NP 寻找到可行的治疗靶点。
间 充 质 干 细 胞 (mesenchymal stem cell,MSC)是一类具有自我更新能力及多向分化潜能的干细胞,可从骨髓、脂肪和脐带血等组织中获取。最近的研究[18-20]表明:全身或局部注射MSC可以减少促炎细胞因子的释放,从而减轻NP。在啮齿动物疼痛模型的研究中,BMSCs 可缓解脊髓神经结扎引起的机械和热痛觉过敏[18],脂肪间充质干细胞(adipose tissue-derived stromal cells,ADSCs) 可减轻非机械性糖尿病周围神经病变导致的NP[19]。研究[20-21]表明:BMSCs 不仅可以改善NP 的症状,还可以调节神经损伤引起的炎症反应,激活抗炎因子表达,阻止炎症反应的恶性循环,抑制疼痛进展。
基因治疗是一种新的、可行的治疗疼痛的方法。非病毒和病毒载体已用于传递基因,编码诸如内 源 阿 片 类 药 物[22]、生 长 因 子[11]或 反 义RNA等[23]的候选治疗药物,直接将载体注射到目标部位或周围组织后,可减轻痛觉过敏和异常性疼痛。
鉴于HGF 和BMSCs 具有潜在缓解疼痛作用,本研究旨在构建HGF 基因修饰的BMSCs,以实现基因与细胞治疗相结合,为治疗NP 提供更加有效的治疗手段。如何将治疗基因有效转移至靶细胞组织中,使其以合适的水平表达,达到治疗效果成为基因治疗首要解决的问题。慢病毒载体是分子生物学实验中常用的基因运输工具,具有可感染分裂细胞和非分裂细胞,转移基因片段容量大,转染效率高,可将目的基因整合到宿主基因组中,能够长时间、稳定表达并且不易引发宿主免疫反应等诸多优点。尤其是基于慢病毒载体的基因转入CD34+造血干细胞(hemopoietic stem cell,HSCs) 已被应用于多种遗传病的治疗,包括异色性白细胞营养不良[24]、维斯科特-奥尔德里奇综合征[25]等,在上述试验中未报告与该载体相关的不良反应。因此慢病毒载体成为理想的基因治疗载体。
本研究选用自带绿色荧光报告基因的pNLEGFP 为载体,获取人HGF 基因序列后插入慢病毒表达载体,并在293T 细胞中包装病毒,成功构建含人HGF 基因的慢病毒表达载体pNL-HGFEGFP,通过感染BMSCs,证实该慢病毒载体能够介导HGF 基因在BMSCs 内正确表达。本研究结果为进一步探索疼痛相关疾病的基因-细胞联合治疗提供良好的基础。

