基于UPLC指纹图谱与色度值的桑白皮生品和炮制品的鉴别及炮制终点研究
黄梦婷 潘玲 邓李红 谢明晏 马永富 魏梅 程学仁 徐杰

摘 要 目的:為桑白皮生品和其炮制品(蜜桑白皮)的鉴别及蜜桑白皮炮制终点的确定提供参考。方法:采用超高效液相色谱(UPLC)法进行测定。色谱柱为Waters BEH Shield RP C18;流动相为乙腈-0.1%磷酸溶液(梯度洗脱);流速为0.30 mL/min;柱温为30 ℃;程序波长为280 nm(0~4 min)、320 nm(4~35 min)。使用《中药色谱指纹图谱相似度评价系统》(2012版)分别建立13批桑白皮和蜜桑白皮的UPLC指纹图谱以及进行相似度评价,并结合对照品图谱对色谱峰进行指认。测定13批桑白皮和蜜桑白皮粉末的色度值(L、a、b)并计算其平均总色度值(E),结合偏最小二乘法判别分析(OPLS-DA)法和聚类分析法分析桑白皮炮制前后指纹图谱和色度值的差异性;同时分析不同炮制时间下蜜桑白皮指纹图谱和色度值的动态变化规律,以确定其炮制终点。结果:桑白皮炮制前后指纹图谱存在明显差异,13批桑白皮和蜜桑白皮样品的相似度均在0.9以上。桑白皮、蜜桑白皮图谱中分别共标定了21、23个共有峰,其中峰1、峰2是桑白皮经蜜炙后新产生的化合物;同时,指认了峰2、峰7、峰14、峰19分别为5-羟甲基糠醛、桑皮苷A、氧化白藜芦醇、桑黄酮G。OPLS-DA分析结果显示,峰1、峰2、峰18、峰20的峰面积/称样量比值以及色度值(L、a、b)是影响蜜桑白皮炮制前后差异最主要的因素;以E范围75.84~80.88作为蜜桑白皮的炮制终点,确定炮制时间为22~34 min。结论:所建立的UPLC指纹图谱和色度值的测定方法可用于桑白皮生品和炮制品的鉴别以及蜜桑白皮炮制终点的确定。
关键词 桑白皮;蜜桑白皮;色度值;超高效液相色谱;指纹图谱;最小偏二乘法判别分析;聚类分析
ABSTRACT OBJECTIVE: To provide reference for the identification and processing end-point determination of raw Morus alba and its processed products (honey-processed M. alba). METHODS: UPLC method was adopted. The determination was performed on Waters BEH Shield RP C18 column with mobile phase consisted of acetonitrile-0.1% phosphoric acid solution (gradient elution) at the flow rate of 0.30 mL/min. The column temperature was set at 30 ℃. The program wavelengths were set at 280 nm (0-4 min) and 320 nm (4-35 min). Similarity Evaluation System for Chromatogram Fingerprint of TCM (2012 edition) was used to establish UPLC fingerprint and carry out similarity evaluation of 13 batches of M. alba and honey-processed M. alba. The chromatographic peaks were identified with reference substance fingerprint. The colorimetric value (L, a, b) of 13 batches of M. alba and honey-processed M. alba powder were determined, and average total colorimetric value (E) was calculated. OPLS-DA and cluster analysis were adopted to analyze the differences in fingerprints and colorimetric values of M. alba before and after processing. At the same time, the dynamic change rule of fingerprint and colorimetric value of honey-processed M. alba at different processing time points were analyzed to determine the processing end-point. RESULTS: There were obvious differences in fingerprints before and after processing, and the similarity of 13 batches of M. alba and honey-processed M. alba were all higher than 0.9. Totally 21 common peaks were calibrated for M. alba, and 23 common peaks for honey-processed M. alba; peak 1 and peak 2 were newly produced compounds of honey-processed M. alba. Peak 2, peak 7, peak 14 and peak 19 were identified as 5-hydroxymethylfurfural, mulberry glucoside A, oxidized resveratrol, mulberry flavonoids G. Results of OPLS-DA showed that the peak area-sample quantity ratio of peak 1, peak 2, peak 18, peak 20 and the chromaticity values (L, a, b) were the most important factors affecting the difference of raw and processed products of M. alba. When the E ranged 75.84-80.88 as the processing end-point of honey-processed M. alba, the processing time was determined as 22-34 min. CONCLUSIONS: The established UPLC fingerprint and colorimetric value determination method can be used to identify the raw and processed products of M. alba as well as determine the processing end-point of honey-processed M. alba.
KEYWORDS Morus alba; Honey-processed Morus alba; Chromaticity; UPLC; Fingerprint; OPLS-DA; Cluster analysis
桑白皮为桑科植物桑Morus alba L.的干燥根皮,性寒、味甘,归肺经,具有泻肺平喘、利水消肿的功效[1]。桑白皮的主要化学成分包含黄酮类、酚酸类、生物碱类等,具有降血糖、降血压、利尿等多种药理作用[2]。2015年版《中国药典》(一部)(后文简称“药典”)收载的桑白皮饮片包括生品(桑白皮)和蜜炙品(蜜桑白皮)[1]。桑白皮生品性寒,泻肺行水之力较强;用蜜炙法炮制后可减轻其寒泻之性,防止伤肺泻气,同时兼有润肺止咳的功效,适用于肺虚咳喘[3]。然而,药典仅在蜜桑白皮饮片鉴别项下作了简单的外观性状描述,并未明确规定蜜桑白皮的炒制时间,亦未规定指标成分的含量检测项,导致市面上蜜桑白皮饮片质量参差不齐,严重影响了其临床用药的安全性和有效性。
外观性状是评价中药材炮制品质量的重要依据之一,不同分析人员对外观颜色的分辨存在较大的主观性[4]。色度分析是利用国际照明委员会(CIE)色度空间系统对颜色进行客观表达,利用反映色度值的指标(L、a、b值)指示颜色在几何坐标轴中的位置,可用于中药炮制过程中饮片颜色的快速在线检测[5]。中药指纹图谱是对中药整体性化学特征的表达和反映[6]。目前,中药指纹图谱结合色度值测定在栀子、党参生品与其炮制品的鉴别、质量评价以及炮制过程控制等方面应用广泛[7-8]。鉴于此,本研究建立蜜桑白皮炮制前后的超高效液相色谱(UPLC)指纹图谱,同时采用测定色度值的方法对蜜桑白皮饮片粉末的颜色进行量化,通过考察不同炒制时间蜜桑白皮饮片指纹图谱和色度值的动态变化,为桑白皮生品和炮制品的鉴别以及蜜桑白皮炮制终点的确定提供理论依据和技术参考。
1 材料
1.1 仪器
H-class型UPLC仪(美国Waters公司);Milli-QDirect型超纯水系统(德国Merck股份有限公司);KQ-700DE型数控超声波清洗器(昆山市超声仪器有限公司);ME204E型万分之一分析天平(瑞士Mettler Toledo公司);DHG-9147A型电热恒温干燥箱(上海精宏实验设备有限公司);C21-WK2102型多功能电磁炉(美的集团有限公司)。
1.2 药品与试剂
桑皮苷A、氧化白藜芦醇对照品(成都普菲德生物科技有限公司,批号:18052901、15112017,纯度均为98.0%);5-羟甲基糠醛对照品(中国食品药品检定研究院,批号:111626-201902,纯度:99.2%);桑黄酮G对照品(四川省维克奇生物科技有限公司,批号:wkq20060105,纯度:97.0%);甲醇、乙腈(德国Merck股份有限公司,色谱级);磷酸(天津市科密欧化学试剂有限公司,色谱级);其余试剂均为分析纯,水为超纯水。
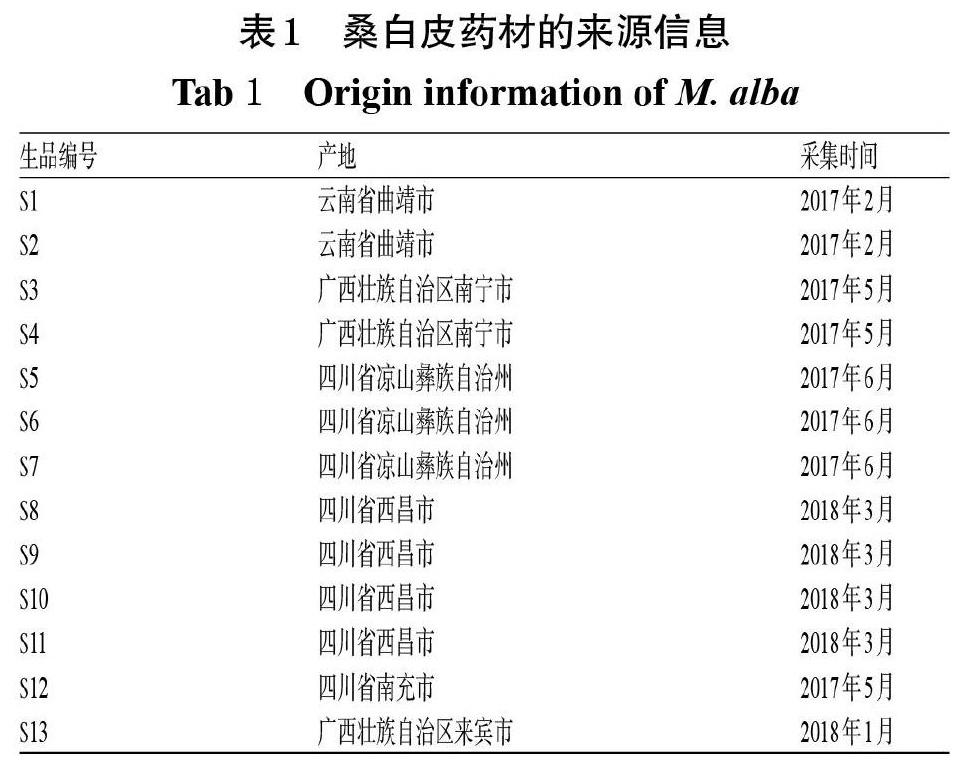
本研究共收集13批桑白皮药材,经广东一方制药有限公司魏梅主任药师鉴定均为桑科植物桑M. alba L.的干燥根皮,具体来源信息详见表1。
2 方法与结果
2.1 蜜桑白皮樣品的制备
分别取编号为S1~S13的桑白皮药材,按照2015年版《中国药典》(四部)通则0213蜜炙法[9]制备蜜桑白皮饮片,对应的饮片编号依次为M1~M13。
2.2 桑白皮和蜜桑白皮UPLC指纹图谱的建立及分析
2.2.1 色谱条件 色谱柱:Waters BEH Shield RP C18(100 mm×2.1 mm,1.8 ?m);流动相:乙腈(A)-0.1%磷酸溶液(B),梯度洗脱(0~2 min,2%A;2~12 min,2%A→20%A;12~14 min,20%A→30%A;14~18 min,30%A→48%A;18~22 min,48%A→53%A;22~27 min,53%A→60%A;27~30 min,60%A→87%A;30~30.01 min,87%A→2%A;30.01~35 min,2%A);流速:0.30 mL/min;柱温:30 ℃;程序检测波长:280 nm(0~4 min)、320 nm(4~35 min);进样量:1 μL。
2.2.2 混合对照品溶液和阴性对照溶液的制备 分别精密称取5-羟甲基糠醛、桑皮苷A、氧化白藜芦醇、桑黄酮G对照品各适量,置于同一量瓶中,加甲醇溶解制成质量浓度分别为75.392 0、63.994 0、129.203 2、78.919 2 μg/mL的混合对照品溶液。另取甲醇溶液,作为阴性对照溶液。
2.2.3 供试品溶液的制备 取桑白皮、蜜桑白皮粉末(过三号筛,下同)各0.5 g,分别置于具塞锥形瓶中,精密加入70%甲醇25 mL,称定质量,加热回流30 min;取出,放冷,再称定质量,用70%甲醇补足减失的质量,摇匀,用0.22 μm的微孔滤膜滤过,收集续滤液,即得。
2.2.4 精密度试验 取蜜桑白皮(编号:M14)粉末适量,按“2.2.3”项下方法制备供试品溶液,然后按“2.2.1”项下色谱条件连续进样6 次,记录色谱图。以桑皮苷A的色谱峰作为参照峰(S),计算得到各特征峰相对保留时间和相对峰面积的RSD均小于3.0%(n=6),表明仪器精密度良好。
2.2.5 重复性考察 取蜜桑白皮(编号:M14)粉末适量,共6份,分别按“2.2.3”项下方法平行制备供试品溶液后,然后按“2.2.1”项下色谱条件测定,记录色谱图。以桑皮苷A的色谱峰作为参照峰(S),计算得到各特征峰相对保留时间和相对峰面积的RSD均小于3.0%(n=6),表明该方法重复性较好。
2.2.6 稳定性考察 取蜜桑白皮(编号:M14)粉末适量,按“2.2.3”项下方法制备供试品溶液,分别于室温放置0、2、4、8、12、24 h时,然后按“2.2.1”项下色谱条件进样测定,记录色谱图。以桑皮苷A的色谱峰作为参照峰(S),计算得到各特征峰相对保留时间和相对峰面积的RSD均小于3.0%(n=6),表明供试品溶液室温放置24 h内稳定性良好。
2.2.7 桑白皮与蜜桑白皮UPLC指纹图谱的建立及共有峰的确定 取13批桑白皮和蜜桑白皮粉末适量,分别按“2.2.3”项下方法制备供试品溶液,然后按“2.2.1”项下色谱条件进行测定,记录色谱图和各特征峰的“峰面积/称样量比值”。分别将13批桑白皮和蜜桑白皮的色谱图导入《中药色谱指纹图谱相似度评价系统》(2012版)中,分别以编号为S1的桑白皮和编号为M1的蜜桑白皮的图谱作为参照图谱,进行共有峰匹配,设置时间窗宽度为0.1 min,采用中位数法结合多点校正分别生成桑白皮对照图谱R和蜜桑白皮对照图谱MR,并进行各样本色谱图与各自对照图谱的相似度评价。结果显示,13批桑白皮和蜜桑白皮的UPLC指纹图谱中分别共标定了21、23个共有峰。13批桑白皮与其对照图谱R的相似度依次为0.993、0.989、0.933、0.996、0.999、0.984、0.998、0.993、0.998、0.994、0.998、0.997、0.997,13批蜜桑白皮与其对照图谱MR的相似度依次为0.992、0.998、0.906、0.995、0.998、0.985、0.996、0.998、0.994、0.993、0.999、0.991、0.998,相似度均在0.9以上,符合指纹图谱的研究要求。13批桑白皮和蜜桑白皮的共有峰的峰面积/称样量比值见表2,UPLC指纹图谱叠加图见图1。
2.2.8 色谱峰的指认 分别吸取“2.2.2”项下制备的混合对照品溶液和阴性对照溶液,按“2.2.1”项下色谱条件进行测定,记录色谱图,并分别与桑白皮对照图谱R和蜜桑白皮对照图谱MR进行比对,进行色谱峰的指认,结果见图2。结果,共指认了其中4个色谱峰,分别为峰2(5-羟甲基糠醛)、峰7(桑皮苷A)、峰14(氧化白藜芦醇)、峰19(桑黄酮G)。
2.3 桑白皮和蜜桑白皮色度值测定
分别取13批桑白皮和蜜桑白皮粉末,每份约2 g,压制成厚度约为1 mm左右的薄片,以国际照明委员会认可的D65光源作为光源[6],以白色作为背景,对粉末图像进行色彩采集,并进行肉眼观察,采集样本见图3。然后,将采集好的图像导入Adobe Photoshop 6.0软件中,颜色模型选择“Lab型”,直接读取13批桑白皮和蜜桑白皮的色度值(L、a、b值),并计算平均总色度值(E)。色彩系统中L代表明亮度,L越大则明亮度越大,反之则明亮度越小;a代表红绿色度,+a为红色方向,反之为绿色方向,+a值越大则颜色越红,反之则颜色越绿;b代表黄蓝色度,+b为黄色方向,反之为蓝色方向,+b值越大则颜色越黄,反之则颜色越蓝;E为颜色的平均总色度值,E=(L2+a2+b2)1/2)[10]。平行3次测定,取平均值。采用SPSS 20.0统计软件对13批桑白皮和蜜桑白皮的色度值(L、a、b、E)进行单因素方差分析,P<0.05表示差异具有统计学意义。13批桑白皮和蜜桑白皮的色度值测定结果见表3。
结果显示,若单纯凭借肉眼看,并不能以粉末外观颜色很好地区分桑白皮生品和炮制品。但根据建立的色度值评价法,通过L、a、b值计算出总平均色度值E后能客观地将两者区分开来。除部分批次样品(编号为S5、S6、S9、S13)外,桑白皮生品的E值均显著高于对应批次的蜜桑白皮(P<0.05)。因此,本研究建立的色度值评价方法是鉴别桑白皮生品与炮制品的有效手段。
2.4 桑白皮和蜜桑白皮差异标志物分析
采用偏最小二乘判别分析(OPLS-DA)法对桑白皮炮制前后的差异标记物进行分析。分别将13批桑白皮和蜜桑白皮样品各色谱峰的峰面积/称样量比值及色度值(L、a、b)导入SIMCA 14.0软件中,得到的模型见图4、图5。由OPLS-DA得分图可知,13批桑白皮和蜜桑白皮呈现出明显的分類聚集现象。根据模型中变量权重的重要性(VIP)预测值来筛选具有统计学意义的差异标志物;在95%置信区间的前提下,选出VIP>1.0的因素作为差异性标志物[11]。其中,峰1的峰面积/称样量比值、峰2(5-羟甲基糠醛)的峰面积/称样量比值、L值、a值、b值、峰18的峰面积/称样量比值、峰20的峰面积/称样量比值的VIP值分别为1.805、1.776、1.581、1.498、1.368、1.134、1.081,均大于1。因此,上述因素是导致桑白皮与蜜桑白皮差异最主要的因素。
2.5 13批桑白皮和蜜桑白皮的聚类分析
将OPLS-DA分析得到的VIP值大于1的各项指标数据导入SPSS 20.0软件中进行聚类分析,聚类方法选择Ward法,测量区间选择平方Euclidean距离,得到聚类结果见图6。结果显示,桑白皮聚为一类,蜜桑白皮聚为另一类,该结果与OPLS-DA分析所得的结果一致,表明峰1、峰2(5-羟甲基糠醛)、峰18、峰20的峰面积/称样量比值以及色度值(L、a、b)均可以作为区分桑白皮与蜜桑白皮的关键指标。
2.6 蜜桑白皮炮制过程中UPLC指纹图谱和色度值的动态变化考察
2.6.1 蜜桑白皮饮片的炮制和取样 取桑白皮饮片,按100 g饮片 ∶ 25 g炼蜜的比例加入相当于0.75倍炼蜜质量的水稀释的炼蜜,拌匀后闷润至饮片完全润透。当入锅温度为100 ℃左右时,投入编号为S1的桑白皮饮片,开始计时,在炒制10 min时开始取样,之后每隔3 min取样1次,共计得到15个时间点的炮制样品(共炮制52 min),分别记为MSBP1~MSBP15,同时记录出锅温度。平行操作3次。蜜桑白皮炮制过程工艺参数见表4。
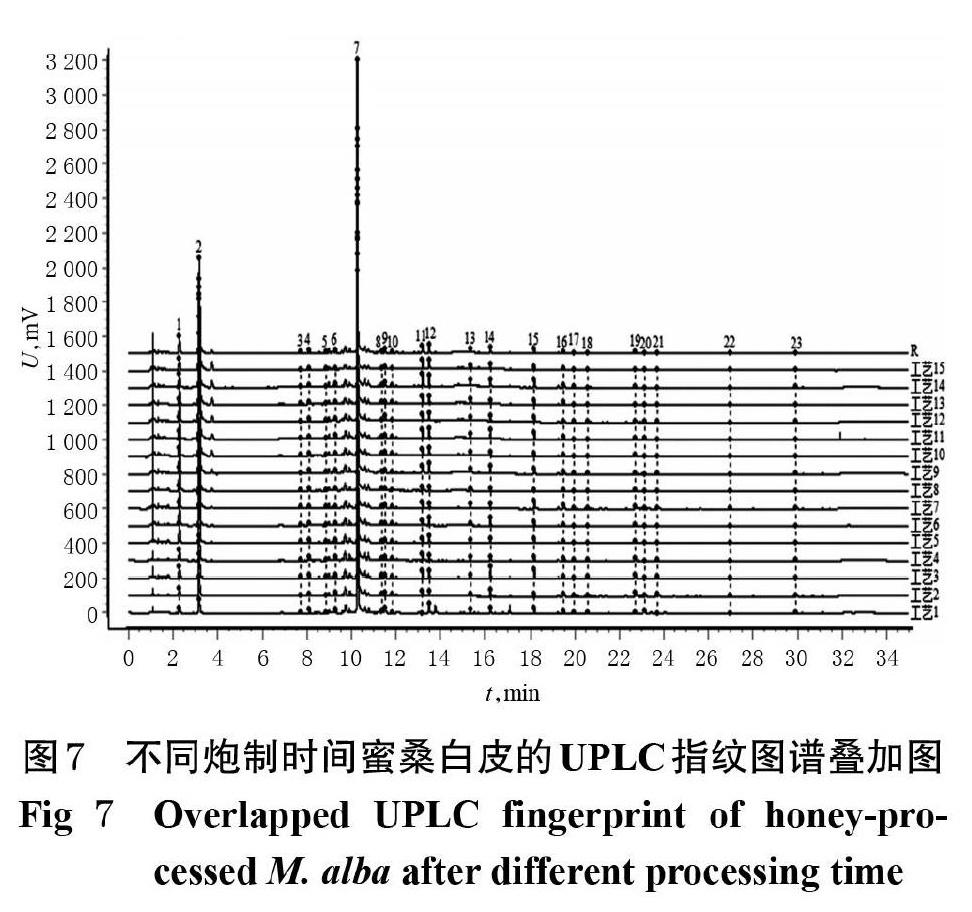
2.6.2 不同炮制时间蜜桑白皮样品的UPLC指纹图谱采集 取不同炮制时间的15批蜜桑白皮粉末,按“2.2.3”项下方法制备供试品溶液,然后按“2.2.1”项下色谱条件进行测定,记录色谱图并计算各特征峰的峰面积/称样量比值,结果见表5。将所有图谱导入《中药色谱指纹图谱相似度评价系统》(2012版)中,以样品编号为MSBP1的蜜桑白皮饮片粉末的图谱为参照图谱,进行共有峰匹配,设置时间窗宽度为0.1 min,采用中位数法结合多点校正生成蜜桑白皮对照图谱R,并进行各样品色谱图与对照图谱的相似度评价,不同炮制时间蜜桑白皮饮片的UPLC指纹图谱叠加图见图7。表5结果显示,随着炮制时间的延长,峰1的峰面积/称样量比值呈现出先增大后减小的趋势;与炮制10 min的样品相比,炮制34 min后峰1的峰面积/称样量比值增大了3.54倍;继续延长炮制时间至52 min,峰1的峰面积/称样量比值减小了1.15倍。峰2(5-羟甲基糠醛)的峰面积/称样量比值在炮制10~43 min内一直增大。峰3、峰18、峰20的峰面积/称样量比值总体呈现随炮制时间延长而逐渐下降的趋势。峰7的峰面积/称样量比值在炒制10~19 min内基本不变;炒制19 min之后,该比值开始逐渐下降;炒制34~37 min内,该比值下降较为明显。不同炮制时间的蜜桑白皮(MSBP1~MSBP15)与其对照图谱R的相似度依次为0.932、0.942、0.950、0.951、0.989、0.991、0.999、0.999、0.991、0.972、0.960、0.956、0.978、0.991、0.916,均在0.9以上,符合指纹图谱的研究要求。
2.6.3 不同炮制时间蜜桑白皮样品粉末的色度值测定 取编号为MSBP1~MSBP15的样品,按“2.3”项下方法对15批蜜桑白皮饮片粉末样品的色度值进行测定,根据公计算各样品的平均总色度值EMSBP,绘制炮制时间-色度值变化趋势图,详见图8、图9。结果显示,随着炮制时间的延长,蜜桑白皮粉末的颜色逐渐加深;编号为MSBP1~MSBP4的样品偏黄白色,编号为MSBP11~MSBP15的样品偏棕色至深棕色,均不符合药典对蜜桑白皮的性状要求。编号为MSBP5~MSBP10的样品(即炮制22~37 min者)处在深黄色至棕黄色之间,符合药典中蜜桑白皮饮片鉴别项下要求。色度值的动态变化结果显示,EMSBP在炮制10~22 min内基本不变,在炮制22~28 min内呈现下降趋势,在炮制28~37 min内保持稳定,之后随炮制时间的延长而逐渐下降。由此可见,EMSBP的变化基本可以直观反映蜜桑白皮整个炮制过程中颜色的变化规律:炮制10~22 min內,饮片粉末颜色变化不大,呈现黄白色,EMSBP在80.88~83.76之间;炮制22~28 min时,饮片粉末颜色开始发生明显变化,由黄白色向深黄色转变,EMSBP由80.88下降至75.62;炮制28~37 min时,饮片粉末颜色由深黄色缓慢转变至棕黄色,EMSBP在75.19~75.62之间,变化不大;当炮制时间超过37 min后,饮粉末片颜色明显加深,逐渐转变为棕色至深棕色,EMSBP由75.19下降至63.22。因此,当EMSBP处在75.19~80.88之间时(即炮制22~37 min者),蜜桑白皮的饮片颜色基本可以达到药典的要求。
3 讨论
3.1 炼蜜稀释倍数考察
本研究考察了蜜桑白皮炮制前炼蜜的稀释方法,分别为不加水和加0.3、0.5、0.75、1.0倍水稀释,均闷润3.0 h,观察炼蜜的流动性、饮片的闷润情况。结果,当加0.75倍量水稀释后炼蜜的流动性好,可完全润透饮片。
3.2 桑白皮生品与蜜桑白皮的鉴别
炮制时间是影响蜜桑白皮饮片质量的重要因素,而传统的外观颜色鉴别存在主观性,炮制临界点的控制较为模糊。不同批次、不同产地的桑白皮饮片颜色有深浅之别,不同炮制程度的蜜桑白皮饮片外观性状差别凭肉眼难以区分;而且桑白皮生品与炮制品物质成分的种类差异不大,简单的薄层色谱难以有效鉴别。本研究采用UPLC法建立了桑白皮炮制前后的指纹图谱,其中桑白皮标定了21个共有峰,蜜桑白皮标定了23个共有峰,13批生品中均未检测到峰1和峰2(5-羟甲基糠醛),可判定其为桑白皮炮制过程中新产生的成分。因此,峰1、峰2可以作为区分桑白皮生品和炮制品的特征性指标。同时,5-羟甲基糠醛(峰2)具有神经毒性,如过量则可能与人体蛋白质结合产生积蓄中毒,对人体横纹肌及内脏造成损害[11],故应作为蜜桑白皮饮片及其制剂的质量评价指标之一,对其进行限量控制可保证临床用药的安全性。此外,峰18、峰20的峰面积/称样量比值以及饮片粉末色度值(L、a、b)是通过OPLS-DA分析筛选出的导致蜜桑白皮生品与炮制品差异的关键因素,可作为蜜桑白皮饮片质量评价、炮制工艺考察等的重要指标。
3.3 蜜桑白皮炮制终点的确定
通过对桑白皮炮制前后样品指纹图谱的OPLS-DA分析结果可知,峰1、峰2、峰18、峰20的峰面积/称样量比值是反映桑白皮生品和炮制品差异的重要指标。因此,笔者重点关注桑白皮炮制过程中峰1、峰2、峰18、峰20的峰面积/称样量比值的变化规律后发现:随着炮制时间的延长,峰1的峰面积/称样量比值呈现出先增大后减小的趋势,在炮制34 min时该比值达到较高水平,说明炮制34 min是峰1代表的化学成分含量变化的关键节点,若炮制时间控制在34 min左右,可有效保留峰1化合物的含量;峰2(5-羟甲基糠醛)的峰面积/称样量比值在炮制10~43 min内一直增大,这可能与炼蜜或药物在加热炒制的过程中单糖发生脱水有关[12]。相关研究表明,5-羟甲基糠醛具有双向药理作用,既有抗氧化损伤[11]、抑制癌细胞扩散[13]、抗组织缺氧[14]等有利的药理作用,又有致敏性[15]、遗传毒性[16]等副作用,故在蜜桑白皮饮片性状达到要求的前提下,炒制时间不宜过长,避免5-羟甲基糠醛的累积而产生毒副作用。随着炮制时间的延长,峰18、峰20的峰面积/称样量比值总体呈现逐渐下降的趋势。此外,峰3的峰面积/称样量比值也随着炒制时间的延长而逐渐下降。峰7(桑皮苷A)是蜜桑白皮最主要的化学成分,其峰面积占总峰面积的65%以上。相关研究表明,桑皮苷A具有抗炎、镇痛、止咳、抗肿瘤、抗病毒、保护大脑等多种生物活性,是桑白皮的主要药效成分之一[17]。本研究结果显示,桑皮苷A的峰面积/称样量比值在炮制10~19 min内基本不变;炮制19 min之后,该比值开始逐渐下降;炮制34~37 min内,该比值下降较为明显。可知,当炒制时间超过34 min时不利于桑皮苷A的保留。
结合蜜桑白皮炮制过程中饮片指纹图谱各共有峰的峰面积/称样量比值和色度值的动态变化规律,为保证蜜桑白皮既符合药典的外观性状要求,同时避免炮制时间过长导致峰1、峰3、桑皮苷A(峰7)、峰18、峰20等成分含量的下降,以及防止5-羟甲基糠醛(峰2)的过度累积,笔者认为蜜桑白皮炮制结束时的EMSBP范围应在75.84~80.88之间,即炒制时间控制在22~34 min为宜。但由于不同批次桑白皮生品颜色存在差异,本研究以“EMSBP在75.84~80.88”作为蜜桑白皮的炮制终点是否具有广泛的代表性,有待扩大样本进行深入研究。
综上,本研究建立了桑白皮炮制前后的UPLC指纹图谱,同时采用色度值对蜜桑白皮粉末的颜色进行量化,筛选出了鉴别桑白皮生品和炮制品的关键指标;同时根据不同炒制时间下蜜桑白皮饮片指纹图谱和色度值的动态变化,初步确定了蜜桑白皮的炮制终点。本研究结果可为桑白皮生品和炮制品的鉴别、质量评价以及蜜桑白皮炮制工艺的优化提供有益参考。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:298.
[ 2 ] 王瑾,张会敏,石俊英.桑白皮黄酮类化学成分研究进展[J].药学研究,2012,31(7):420-422.
[ 3 ] 李群,张会敏.桑白皮蜜炙前后水提液指纹图谱对比研究[J].时珍国医国药,2014,25(6):1380-1382.
[ 4 ] 刘红亮,晏仁义,郭健,等.厚朴“发汗”前后药材颜色及气味差异的数值化研究[J].中国中药杂志,2013,38 (1):45-48.
[ 5 ] 刘得鹏,王云,王国有,等.焦栀子炮制过程中饮片色泽变化与美拉德反应的相关性分析[J].中国中药杂志,2020,45(10):2382-2388.
[ 6 ] 刘娟汝,刘晓梅,刘雨诗,等.基于色度分析原理的青黛有效成分含量与其色度值的相关性分析[J].中国实验方剂学杂志,2019,25(23):165-170.
[ 7 ] 王清浩,王云,张雪,等.基于“表里关联”的米炒党参炮制过程质量传递规律研究[J].中草药,2019,50(12):2848-2855.
[ 8 ] 李晓庆,王云,张雪,等.基于表里关联的栀子饮片炮制过程中表观颜色变化与其内在成分含量的相关性分析[J].中国实验方剂学杂志,2018,24(13):1-5.
[ 9 ] 國家药典委员会.中华人民共和国药典:四部[S]. 2015年版.北京:中国医药科技出版社,2015:31.
[10] 柴冲冲,毛民,袁金凤,等.不同方法软化切制后的黄芩饮片颜色与5种黄酮类成分含量的相关性研究[J].中国中药杂志,2019,44(20):4467-4475.
[11] LI W,QU XN,HAN Y,et al. Ameliorative effects of 5-hydroxymethyl-2-furfural (5-HMF) from Schisandra chinensis on alcoholic liver oxidative injury in mice[J]. Int J Mol Sci,2015,16(2):2446-2457.
[12] 周倩,孙立立.蜜炙对甘草化学成分影响研究[J].中国药学杂志,2013,48(10):768-772.
[13] 梅国栋,赵玲,陈建平,等. 5-HMF抑制A375细胞增殖的信号转导通路[J].中国科技论文,2014,9(9):1005-1008.
[14] HE YL,LI MM,WU LY,et al. Enhanced hypoxia-indu- cible factor (HIF)-1α stability induced by 5-hydroxyme- thyl-2-furfural (5-HMF) contributes to protection against hypoxia[J]. Mol Med,2015,20(1):590-600.
[15] YAMADA P,NEMOTO M,SHIGEMORI H,et al. Isolation of 5- (hydroxymethyl) furfural from Lycium chinense and its inhibitory effect on the chemical mediator release by basophilic cells[J]. Planta Med,2011,77(5):434-440.
[16] ZHU J,CHEN L,DONG Y,et al. Spectroscopic and molecular modeling methods to investigate the interaction between 5-hydroxymethyl-2-furfural and calf thymus DNA using ethidium bromide as a probe[J]. Spectrochim Acta A Mol Biomol Spectrosc,2014,124 (7):78-83.
[17] 伍春.桑枝中桑皮苷A的分离纯化工艺及其活性研究[D].重庆:西南大学,2012.
(收稿日期:2020-10-12 修回日期:2020-11-27)
(编辑:林 静)

