基于高分离度和高色谱峰纯度的红参UPLC指纹图谱研究
冯伟红+李春+吉丽娜+杨立新+荣立新+陈两绵+易红+王智民


[摘要]采用UPLC建立红参指纹图谱。采用Waters Acquity BEH C18( 2.1 mm ×50 mm,1.7 μm)色谱柱进行分离,乙腈-水为流动相,梯度洗脱,检测波长203 nm。通过对22批红参进行测定,建立了红参的UPLC指纹图谱,并定义了26个共有峰。采用对照品比对,指认了其中的11个共有峰,它们分别是人参皂苷Rg1、人参皂苷Re、人参皂苷Rf、人参皂苷Rh1、人参皂苷Rg2、人参皂苷Rb1、20(S)-人参皂苷F1、人参皂苷Rb2、人参皂苷Rb3、20(S)-人参皂苷Rg3、20(R)-人参皂苷Rg3。其中的20(S)-人参皂苷Rg3和20(R)-人参皂苷Rg3这一组差向异构体是红参的特征成分,它们不仅可以用于区分红参与人参,同时也可用于红参炮制的过程控制。采用“中药色谱指纹图谱相似度评价系统”对22批红参UPLC指纹图谱进行了相似度评价,结果 18批样品的相似度大于0.9。与文献报道的红参指纹图谱测定方法比较,该研究所建立的方法具有高效、专属性强、分离度高、色谱峰纯度高、方法简单易行的特点,可用于人参类药材的品种鉴定和质量控制,并为上述药材质量标准的提升提供了理论依据。
[关键词]UPLC; 红参; 人参皂苷; 指纹图谱; 高分离度; 高色谱峰纯度
[Abstract]This study is to establish the UPLC fingerprint of red ginseng. The separation was performed on a Waters Acquity BEH C18 column (2.1 mm × 50 mm,1.7 μm), with the mobile phase consisting of acetonitrile and water for gradient elution. The detection wavelength was set at 203 nm. The UPLC fingerprint of red ginseng was established by using sample chromatography of 22 different purchase areas and 26 common peaks were found. Compared with the reference substances, 11 of the common peaks were identified as ginsenosides Rg1, ginsenoside Re, ginsenoside Rf, ginsenoside Rh1, ginsenoside Rg2, ginsenoside Rb1, 20(S)-ginsenoside F1, ginsenoside Rb2, ginsenoside Rb3, 20(S)-ginsenoside Rg3 and 20(R)-ginsenoside Rg3, respectively. It is worth noting that 20(S)-ginsenoside Rg3 and 20(R)-ginsenoside Rg3 are the characteristic ingredients of red ginseng, and they could be used not only for distinguishing red ginseng and ginseng, but also for process controlling of the preparation of red ginseng. The similarity was analyzed with′ Similarity Evaluation System for Chromatographic Fingerprint of Chinese Materia Medica, and the similarity of 18 batches samples is up to 0.9. Compared to the literature methods, the method is simple, time-saving,specific for the separation of ginsenosides from red ginseng. So, this method could be used for the species identification and quality control of ginseng, red ginseng and American ginseng, and it will alsoprovide a theoretical basis of raising quality standards of the above mentioned Chinese herb medicines.
[Key words]UPLC; red ginseng; ginsenosides; fingerprint chromatogram; good separation; good purity
doi:10.4268/cjcmm20162015
红参为五加科植物人参Panax ginseng C. A. Meyer的干燥根及根茎经蒸制后的干燥品。具有大补元气,复脉固脱,益气摄血的作用,用于体虚欲脱,肢冷脉微,气不摄血,崩漏下血[1]。
长期以来,红参的质量评价方法与人参和西洋参类似,均以人参皂苷类成分为检测指标,2015年版《中国药典》中人参、红参和西洋参的质量控制依然是采用HPLC方法[1],仅仅测定药材中人参皂苷Rg1、人参皂苷Re和人参皂苷Rb1这3个主要成分的含量,人参和红参分别以含人参皂苷Rg1和人参皂苷Re的总量分别不得低于0.3%和0.25%,人参皂苷Rb1均不得低于0.2%加以控制,而西洋参则以这3种人参皂苷的总量不得低于2.0%进行质量控制。这种法定标准显然远远落后于行业发展的需求。
近年来,文献已报道的对人参、红参和西洋参的质量评价主要从多成分含量测定研究[2-12]和指纹图谱研究[13-29]2个方面进行。多成分含量测定研究通常同步测定人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rc、人参皂苷Rb2、人参皂苷Rb3和人参皂苷Rd这7个成分,一般情况下,虽然西洋参的含测增加了特征性成分拟人参皂苷F11[14],人参增加了标志性成分人参皂苷Rf[2-7],红参增加了特征性成分人参皂苷Rg3[8-10],但因为也仅仅是测定有限的几个主要成分,因此仍不能反映这些药材中皂苷类成分的概貌,所以还需要指纹图谱作为补充。
从已有文献可知,人参类药材指纹图谱多采用HPLC-DAD分析检测[13-25],少数采用HPLC-ELSD[26-27],但后者仅仅限于西洋参的研究。HPLC分析时间通常为80~120 min,确定的共有峰数目多在11~30个,最多指认了11个色谱峰[23],而且所指认的成分均为人参类药材多成分含测中通常定量的成分,对其他含量较低或者分离困难的成分仍然没有明确。近年来,也有人采用UPLC-DAD对人参类药材的指纹图谱进行了研究,分析时间较HPLC方法大大缩短(通常为12~30 min),但选定的共有峰仅有12~15个,指认色谱峰数目也只有8~10个[17,24,26]。因此,虽然分析时间缩短,但在人参类药材皂苷类成分整体表征上UPLC方法较HPLC方法并没有实质性突破,其原因还是各成分的分离度不够好,并没有真正发挥出UPLC的仪器优势。
综上所述,全面评价人参类药材质量的当务之急应该在指纹图谱的研究上有所突破。那么如何突破?改进色谱条件、提高色谱峰的分离度、提高色谱峰的纯度、增加共有峰数目、增加指认峰的数目就是需要突破的关键点。
因此,本研究以人参类药材中所含皂苷类成分相对最为复杂的红参为研究对象,采用Waters ACQUITY UPLC H-Class 超高效液相色谱仪和ACQUITY UPLC BEH C18填料色谱柱,建立了具有高分离度、高色谱峰纯度、操作简单、高效快速、易于重复的红参UPLC指纹图谱测定方法,所建立的方法可为提高人参、红参和西洋参的质量控制标准提供参考。
1 材料
美国Waters Acquity UPLC H-Class Core System,Acquity UPLC PDA Detector,Empower色谱工作站。KQ-100型超声波清洗器(昆山市超声仪器有限公司);KQ-250DE型数控超声波清洗器(昆山市超声仪器有限公司),功率250 W,工作频率40 kHz;XS205型1/10万天平(瑞士梅特勒-托利多仪器有限公司)。
对照品人参皂苷Rg1(批号110703-201027,按96.3%计)、人参皂苷Re(批号110754-200822,按88.8%计)、人参皂苷Rb1(批号110704-200420)、人参皂苷Rb2(批号111715-200802,按94.8%计)和人参皂苷Rb3(批号111686-201002,按92.7%计)均购自中国食品药品检定研究院,供含量测定用。人参皂苷Rf(批号R-040-120617)、人参皂苷Rc(批号R-008-120628)、人参皂苷Rd(批号R-009-120826)、人参皂苷20(S)-Rg3(批号R-010-120506)和人参皂苷Ro(批号R-032-130408)均购自瑞芬思生物科技有限公司,经面积归一化法测定,纯度>98%。
乙腈、甲醇均为色谱纯(HPLC级,美国Fisher公司),水为超纯水由Milli-Q Advantage A10超纯水系统(美国密理博公司)制备,其余试剂均为分析纯。
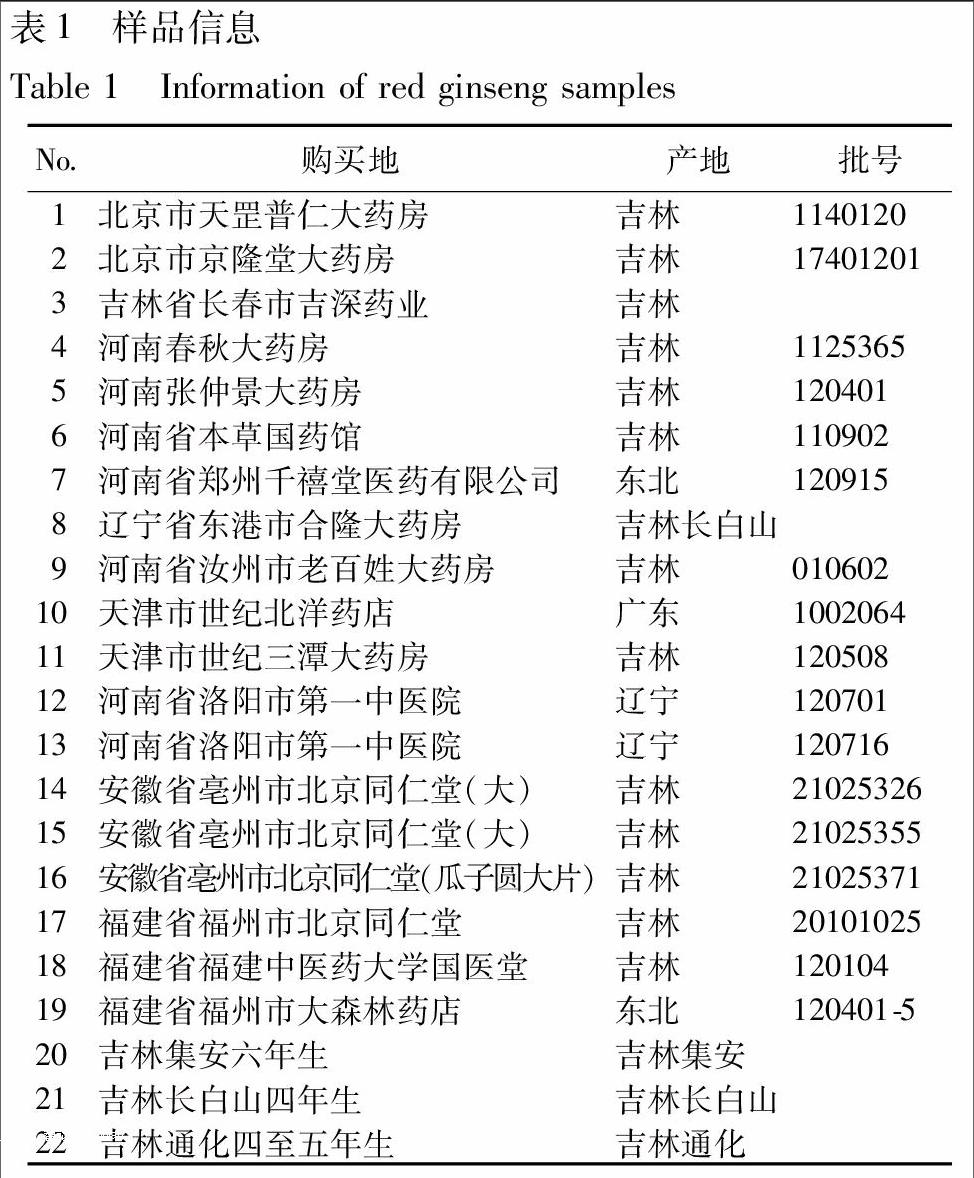
红参为购自各地药材商店/市场的市售饮片/药材。见表1。
2 方法与结果
2.1 指纹图谱的建立及方法学考察
2.1.1 色谱条件 色谱柱:Acquity UPLCBEH C18(2.1 mm×50 mm,1.7 μm);流动相:乙腈(A)-水(B),梯度洗脱,洗脱程序:0~2.2 min,19% A;2.2~3.5 min,19%~25% A;3.5~5.7 min,25% A;5.7~10 min,25%~33% A;10~12 min,33%~40% A;12~16 min,40%~50% A;16~19 min,50%~60% A;19~25 min,60%~100% A;25~30 min,100% A;检测波长203 nm;流速0.5 mL·min-1;进样量20 μL,柱温30 ℃。理论板数按人参皂苷Rb1峰计算应不低于1万,见图1。
2.1.2 供试品溶液的制备 取本品粉末(过40目筛)约0.5 g,精密称定,置100 mL锥形瓶中,精密加入甲醇50 mL,称重,超声处理(功率250 W,频率40 kHz)30 min,取出,室温放置1 h,再称重,用甲醇补足失重,摇匀,滤过。精密量取续滤液20 mL,减压蒸干,残渣加甲醇溶解并转移至5 mL量瓶中,加甲醇稀释至刻度,摇匀,过0.22 μm微孔滤膜,取续滤液,即得。
2.1.3 对照品溶液的制备 取对照品人参皂苷Rg1、人参皂苷Re、人参皂苷Rf、人参皂苷Rh1、人参皂苷Rg2、人参皂苷Rb1、20(S)-人参皂苷F1、人参皂苷Rb2、人参皂苷Rb3、20(S)-人参皂苷Rg3、20(R)-人参皂苷Rg3适量,精密称定,加甲醇制成每1 mL中分别含上述人参皂苷0.145,0.070 0,0.133, 0.110,0.053 0,0.096 0,0.062 5,0.039 0,0.075 0,0.180,0.047 0 mg的混合对照品溶液,备用。
2.1.4 精密度试验 取同一份红参(编号20)供试品溶液,按2.1.1项下方法连续进样6次,记录UPLC图谱。以人参皂苷Rb1为参照峰,分别计算各共有峰的相对保留时间和相对峰面积,并计算RSD。结果各共有峰相对保留时间的RSD均<2%,相对峰面积的RSD均<2%,测定结果符合中药指纹图谱的要求。表明仪器的精密度良好。
2.1.5 稳定性试验 取红参粉末(编号20)约0.5 g,按2.1.2项下方法制备供试品溶液,分别于供试品溶液制备后的第0,1,2,4,6,8,10,12,16,24 h按2.1.1项下方法进样,记录UPLC图谱。以人参皂苷Rb1为参照峰,分别计算各共有峰的相对保留时间和相对峰面积,并计算RSD。结果各共有峰相对保留时间的RSD均<2%,相对峰面积的RSD均<2%,测定结果符合中药指纹图谱的要求。表明24 h内,供试品溶液的稳定性良好。
2.1.6 重复性试验 取红参粉末(编号20)约0.5 g,平行6份,分别按2.1.2项下方法制备供试品溶液,按2.1.1项下方法进样,记录UPLC图谱。以人参皂苷Rb1为参照峰,分别计算各共有峰的相对保留时间和相对峰面积,并计算RSD。结果各共有峰相对保留时间的RSD均<2%,相对峰面积的RSD均<2%,测定结果符合中药指纹图谱的要求。表明本方法的重复性良好。
2.2 指纹图谱的建立与共有峰的确定
取22批红参样品,分别按2.1.2项下方法制备供试品溶液,按2.1.1项下确定的色谱条件进样,记录UPLC图谱。在22批红参的指纹图谱中共获得26个共有峰,经与人参皂苷对照品对照,对其中11个共有峰进行了指认,分别为:人参皂苷Rg1、人参皂苷Re、人参皂苷Rf、人参皂苷Rh1、人参皂苷Rg2、人参皂苷Rb1、20(S)-人参皂苷F1、人参皂苷Rb2、人参皂苷Rb3、20(S)-人参皂苷Rg3、20(R)-人参皂苷Rg3。
2.3 共有指纹峰的相对保留时间及相对峰面积
本研究中鉴于人参皂苷Rb1有法定供货渠道作保证,在红参中的相对含量较高,化学结构相对稳定、保留时间居中,且在本色谱分离中分离度、色谱峰纯度等方面均符合含量测定的要求,因此确定以人参皂苷Rb1为参照峰(峰10,S),其余各共有峰的保留时间和峰面积与S峰的比值定义为其余各峰的相对保留时间和相对峰面积。按以上方法计算22个产地药材的26个共有指纹峰的相对保留时间和相对峰面积,结果见图2,表2,3。
2.4 相似度评价
将所得到的22批红参UPLC色谱图数据导入国家药典委员会“中药指纹图谱评价系统”(2008版),通过软件分析,得到红参药材的UPLC指纹图谱。22批红参药材的相似度计算结果显示:22批红参药材与对照特征图谱相似度在 0.699~0.983,平均相似度为 0.896,RSD为 8.3%。22批药材中有 18批药材相似度大于0.9,有2批药材相似度在0.8~0.9,还有2批药材相似度在0.7~0.8,表明建立的红参UPLC指纹图谱较合理, 见表4。
3 结果与讨论
在流动相的选择上,曾采用相同的梯度洗脱条件分别对乙腈-水系统和乙腈-0.1%的甲酸水系统进行了筛选,结果发现在乙腈-0.1%的甲酸水系统下,基线波动较大,各色谱峰峰形较差,拖尾现象严重,而乙腈-水系统下则基线较平稳,能获得良好的色谱峰对称性,分离效果较理想,因此确定采用乙腈-水作为流动相系统组成进行色谱分离。
文献报道人参类药材供试品溶液的制备方法有固相萃取法[3]、正丁醇萃取法[28]和大孔树脂法[31],试验中发现,经过富集后的红参供试品溶液与采用直接超声提取法制备的供试品溶液的色谱分离效果基本一致,大孔树脂法损失较大,故采用超声提取法直接制备供试品溶液。
本研究建立的红参UPLC指纹图谱在短短30 min内实现了对红参的快速色谱分离,与以往文献报道的红参指纹图谱[20-26]相比较,具有高效、专属性强、分离度高、色谱峰纯度高、重现性强、方法简单易行的特点。该指纹图谱可同时对红参中48个共有峰进行检测,忽略掉含量相对较低的一些特征峰后,定义了26个特征峰,同时采用中药对照品对其中11个色谱峰进行了指认,其中不仅包括了红参中常见的原生皂苷人参皂苷Rg1、人参皂苷Re、人参皂苷Rf、人参皂苷Rb1、人参皂苷Rc、人参皂苷Rd、人参皂苷Rb2和人参皂苷Rb3,同时还涵盖了人参加热炮制后水解生成的次生皂苷,即人参皂苷Rh1、20(S)-人参皂苷Rg3、20(R)-人参皂苷Rg3、人参皂苷Rg2、人参皂苷F1。特别是其中红参的主要标志化合物20(S)- 人参皂苷Rg3和20(R)- 人参皂苷Rg3这一组差向异构体的检出和指认,可据此对红参的炮制工艺更好地进行过程控制。
中药指纹图谱技术作为一种中药质量评价模式具有整体性、宏观性和模糊性的特点,目前在国内外能被业界广为接受和采用,主要是基于指纹图谱的整体和宏观性,如果能与多指标成分定量更好地融
合在一起,使其模糊性逐渐清晰,将是中药质量评价未来发展的方向。本研究通过进行红参高分离度和高色谱峰纯度的色谱分离,最终建立了可同时进行多成分质量评价的特色红参指纹图谱。由于红参是人参类药材中所含成分相对较为丰富的品种,因此本研究建立的红参UPLC指纹图谱实际上也为人参、红参、西洋参及其他人参加工品的品种鉴定及质量控制提供了可行的方法,可为《中国药典》中红参的质量标准提高提供参考。
[参考文献]
[1]中国药典.一部 [S]. 2015.
[2]赵亮,吕磊,纪松岗,等. 高效液相色谱法快速测定人参中8种主要皂苷类成分的含量[J]. 第二军医大学学报,2008,29(12):1507.
[3]崔勇,李青,刘思洁,张冠英,等. 固相萃取-超高效液相色谱法同时测定人参中11 种人参皂苷的含量[J]. 中国卫生检验杂志, 2012,22(3):475.
[4]张翠英,陈士林,董梁. 超高效液相色谱法结合化学计量学分析评价4种商品人参的质量[J].色谱,2015,33(5):514.
[5]郜玉钢,郝建勋,臧埔,等. 高效液相色谱法测定农田人参中9种人参皂苷单体含量[J]. 食品科学,2012,33(2):189.
[6]林红梅,王晓郁,杨莉,等. 吉林省几个主要产区人参药材品质评价[J]. 吉林农业大学学报,2013,35(6):673.
[7]郭双双,杨利民,张一鸣,等. 微波辅助萃取人参总皂苷与单体皂苷含量分析[J]. 食品科学,2015,36(2):1.
[8]张颖,郝颖,杨立曼,等. 不同蒸制工艺对红参中人参皂苷类成分的影响[J]. 中国实验方剂学杂志,2013,19(21):16.
[9]刘志,阮长春,刘天志,等. HPLC 法同时测定林下参、鲜人参、生晒参和红参中 14 种人参皂苷 [J]. 中草药,2012,43(12):2431.
[10]张语迟,王淑敏,宋凤瑞,等. 市售高丽参与中国红参的质量评价 [J]. 长春中医药大学学报,2008,24(2):148.
[11]黄艳菲,孙美,许云章,等. 不同炮制方法对加拿大产西洋参中10种人参皂苷的影响[J]. 中国中药杂志,2014,39(20):3950.
[12]李波,任烨,杨正明,等. 加拿大产西洋参茎中9种人参皂苷和2种拟人参皂苷的含量变化研究[J]. 华西药学杂志,2015,30(1):74.
[13]李玲,黄晓燕,孙辉,等. 人参药材的高效液相色谱特征图谱及聚类分析[J]. 中南药学,2015,13(10):1068.
[14]阎正,苑若瑶,王春云,等. 人参HPLC指纹图谱的研究 [J]. 河北大学学报:自然科学版,2009,29(3):278.
[15]Zeng F,Wang X M,Yang M,et al. Fingerprint analysis of different Panax herbal species by HPLC-UV method [J]. J Chin Pharm Sci, 2007(16):277.
[16]徐世义,孙国祥,慕善学,等. 林下山参与野山参 HIJE 指纹图谱比较研究[J]. 中药材,2013,36(2):213.
[17]张翠英,董梁,陈士林,等. 人参药材皂苷类成分 UPLC 特征图谱的质量评价方法[J]. 药学学报,2010,45(10):1296.
[18]蔡萍,肖娟,张水寒,等. 红参超微饮片的指纹图谱研究[J]. 中华中医药杂志,2011,26(7):1513.
[19]唐晓晶,辛敏通. 朝鲜红参中人参皂苷类成分含量测定及指纹图谱研究[J]. 中国医药导刊,2013,15 (4):727.
[20]张聪,王智华,金德庄. 中国红参与高丽红参的指纹谱(HPLC-FPS)比较研究 [J]. 中成药,2001,23(3):160.
[21]刘唯芬,熊英,幕善学,等. 红参 HPLC指纹图谱研究[J]. 辽宁中医杂志,2009,36(7):1178.
[22]孙国祥,杨宏涛,刘唯芬,等. 集安红参HPLC数字化指纹图谱研究[J]. 中成药,2007,29(7):937.
[23]高燕霞,苏娟,金慧子. 红参高效液相色谱指纹图谱研究[J]. 药学实践杂志,2016,34(3):248.
[24]郑重,宋凤瑞,刘淑莹,等. 人参、红参皂苷类成分指纹图谱研究[J]. 质谱学报,2012,33(6):327.
[25]周婧,都晓伟,马宏跃,等. 西洋参药材高效液相色谱法指纹图谱的研究[J]. 时珍国医国药,2006,17(12):2381.
[26]王欢,曾凡琳,谢彩香. 西洋参 UPLC-UV-ELSD 指纹图谱研究[J]. 中草药,2016,47(1):143.
[27]董梁,张翠英,陈士林. 西洋参药材皂苷类成分 HPLC-UV-ELSD 特征图谱及模式识别研究[J]. 药学学报,2011,46(2):198.
[28]荆淑芹,姜海平,刘凤云,等. 生晒参、红参、林下参中 7种人参皂苷含量的比较[J]. 中华中医药学刊,2009,27(1):207.
[29]吴建梅,林宏,赵李宏,等. 同仁堂红参与高丽红参品质的初步比较研究——人参皂苷和人参多糖的含量测定 [J]. 中国中药杂志,2007,32(7):573.
[责任编辑 丁广治]

