蛞蝓提取物对环磷酰胺治疗肝癌的增效减毒作用
黄天敏 杨映霞 张宏亮 陈俐秀 黄湘 谢金魁 黄仁彬 杨玉芳

摘 要 目的:探討蛞蝓提取物(LE)对环磷酰胺(CTX)治疗肝癌的增效减毒作用。方法:将小鼠随机分为正常组,模型组,CTX组(0.02 g/kg),LE低、中、高剂量组(即LEL、LEM、LEH组,0.6、1.2、2.4 g/kg),CTX+LE低、中、高剂量联用组(即CTX+LEL、CTX+LEM、CTX+LEH组,剂量同各单药组),每组10只。除正常组外,其余各组小鼠均于左腋下接种小鼠肝癌细胞H22以复制荷瘤模型。接种24 h后,正常组和模型组小鼠灌胃生理盐水,各给药组小鼠分别灌胃相应药物,每日1次,连续10 d。末次给药后第2天,观察各组小鼠一般情况,测定体质量和胸腺指数(LI)、脾指数(SI),检测抑瘤率,并采用金氏公式评估联合用药的效果(q);检测模型组、CTX组和各联用组小鼠的白细胞(WBC)、红细胞(RBC)、血小板(PLT)计数以及血清中丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(ALT)、血肌酐(Scr)、尿素氮(BUN)含量,并采用比色法和酶联免疫吸附测定(ELISA)法分别检测上述各组小鼠肿瘤组织中丙二醛(MDA)含量和超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)活性以及血管内皮生长因子(VEGF)、肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)水平;采用免疫组化法检测模型组、CTX组和CTX+LEM组小鼠肿瘤组织中癌基因蛋白(p53、Bcl-2、Bax)的表达水平。结果:模型组小鼠精神不佳,且出现多饮、多食症状;其体质量、TI、SI虽较正常组无明显异常(P>0.05),但其WBC计数、AST含量均显著升高,ALT、BUN含量均显著降低(P<0.05或P<0.01)。与模型组比较,各给药组小鼠上述症状有所改善;各给药组的瘤体质量,CTX组的TI、SI以及各联用组的TI均显著降低,但LEL组、LEH组的瘤体质量,LE单用组及各联用组的TI、SI均显著高于CTX组,各联用组的瘤体质量均显著低于CTX组(P<0.05或P<0.01);各给药组的抑瘤率为29.58%~72.08%,CTX+LEL组、CTX+LEM组、CTX+LEH组的q值分别为1.03、0.97、0.86。与模型组比较,CTX组小鼠的WBC计数和AST、BUN含量,各联用组的MDA含量,各给药组的VEGF、TNF-α、IL-6水平以及CTX组和CTX+LEM组的Bcl-2表达水平均显著降低,各给药组的SOD、GSH活性以及CTX+LEM组的p53表达水平,CTX组和CTX+LEM组的Bax表达水平均显著升高(P<0.05或P<0.01);但各联用药组的WBC计数和AST含量以及CTX+LEM组的ALT含量,CTX+LEH组的SOD活性和CTX+LEM组的GSH活性均显著高于CTX组,CTX+LEH组的MDA含量,CTX+LEM组、CTX+LEH组的VEGF、TNF-α水平和各联用组的IL-6水平均显著低于CTX组(P<0.05或P<0.01)。结论:LE和CTX联用具有相加的抑瘤作用,且LE可减少CTX致小鼠免疫功能减退、骨髓抑制等毒性反应,具增效减毒的作用。这种作用可能与抗氧化应激、抑制血管生成和炎症因子分泌以及调控凋亡蛋白的表达有关。
关键词 蛞蝓提取物;肝癌;抗氧化应激;血管生成;细胞凋亡;增效减毒;小鼠
ABSTRACT OBJECTIVE: To investigate the effect of increasing efficacy and decreasing toxicity of Limax extract (LE) on cyclophosphamide (CTX) in the treatment of hepatocellular carcinoma. METHODS: The mice were randomly divided into normal group, model group, CTX group (0.02 g/kg), LE low-dose, medium-dose and high-dose groups (LEL, LEM, LEH group, 0.6, 1.2, 2.4 g/kg), CTX+LE low-dose, medium-dose and high-dose combination groups (CTX+LEL, CTX+LEM, CTX+LEH group, the same dose as single drug group), with 10 mice in each group. Except for normal group, other groups were inoculated with hepatoma cells H22 in the left armpit to establish tumor bearing models. After 24 h of inoculation, normal group and model group were intragastrically given normal saline, and administration groups were intragastrically given corresponding drugs, once a day, for 10 days. On the second day after the last administration, the general conditions of mice in each group were observed; the body mass, thymus index (LI), spleen index (SI) were measured; the tumor inhibition rate was detected. The effect (q) of combination therapy was evaluated by Kings formula. The counts of WBC, RBC and PLT, serum contents of ALT, ALT, Scr and BUN were detected in model group, CTX group and combination groups, and the contents of MDA, SOD and GSH, the levels of VEGF, TNF-α and IL-6 in the tumor tissue were detected by colorimetry and ELISA in above groups. The protein expression of oncogenes (p53, Bcl-2 and Bax) were detected by immunohistochemical method in model group, CTX group and CTX+LEM group. RESULTS: The mice in the model group were in poor spirit and had symptoms of excessive drinking and eating; although the body weight, TI and SI were not significantly abnormal compared with normal group (P>0.05), WBC count and AST content were significantly increased, ALT and BUN contents were significantly decreased (P<0.05 or P<0.01). Compared with model group, above symptoms of mice were all improved in administration groups. The tumor weight of administration groups, TI and SI of CTX group and TI of combination groups were decreased significantly, but tumor weight of LEL group and LEH group, TI and SI of LE single groups and combination groups were significantly higher than CTX group; tumor weight of combination groups were significantly lower than CTX group (P<0.05 or P<0.01). The tumor inhibition rates of administration groups were 29.58%-72.08%. The q values of CTX+LEL group, CTX+LEM group and CTX+LEH group were 1.03, 0.97 and 0.86, respectively. Compared with model group, WBC count, AST and BUN contents of CTX group, MDA contents of combination groups, VEGF, TNF-α and IL-6 levels of administration groups, the protein expression of Bcl-2 in CTX group and CTX+LEM group were decreased significantly; the activities of SOD and GSH of administration groups, the protein expression of p53 in CTX+LEM group and Bax in CTX group, CTX+LEM group were increased significantly (P<0.05 or P<0.01); WBC counts and AST contents of administration groups, ALT content of CTX+LEM group, SOD activity of CTX+LEH group and GSH activity of CTX+LEM group were all significantly higher than those of CTX group; MDA content of CTX+LEH group, VEGF and TNF-α levels of CTX+LEM group and CTX+LEH group, IL-6 levels of administration groups were all significantly lower than CTX group (P<0.05 or P<0.01). CONCLUSIONS: LE combined with CTX can increase the anti-tumor effect, and LE can reduce the toxicity of CTX induced immunosuppression and bone marrow suppression in mice, with effect of increasing efficacy and decreasing toxicity. The effect may be related to antioxidant stress, inhibition of angiogenesis and secretion of inflammatory factors, and regulation of apoptosis protein expression.
KEYWORDS Limax extract; Hepatocellular carcinoma; Antioxidant stress; Angiogenesis; Cell apoptosis; Increasing efficacy and decreasing toxicity; Mice
肝癌(Hepatocellular carcinoma)是目前我国排第4位的常见恶性肿瘤及致死病因排第3位的肿瘤。每年新发病例超全球肿瘤新发病例总数的一半,严重危害人们的生命健康[1-2]。肝癌发病机制复杂,其病因尚未完全阐明;加之现有化疗药物的安全性欠佳,可能导致患者机体免疫功能下降而使得治疗效果受到影响[3]。由此可见,肝癌的临床治疗仍然面临严峻的挑战,故寻找有效、安全的肝癌治疗药物备受学者关注。
蛞蝓Agriolimax agrestis L.属软体动物门腹足纲柄眼目蛞蝓科,因其形似蜗牛却无壳,浑身黏液,故俗称为“鼻涕虫”。研究表明,蛞蝓虫体中含有多糖类和蛋白类活性成分,其活性提取物对肺腺癌细胞A549、肉瘤细胞S180、宫颈癌细胞HeLa等均具有较好的体内外抑制作用,且毒性较低[4-5]。本课题组前期研究发现,蛞蝓提取物(Limax extract,LE)可抑制肝癌细胞H22的生长,具有一定的开发价值。
化疗是目前临床治疗肿瘤的主要手段,环磷酰胺(Cyclophosphamide,CTX)是应用最广泛的传统化疗药物之一,但CTX可通过血液循环激活其自身代谢产物丙烯醛,从而对机体正常细胞产生毒性作用,如骨髓抑制和免疫抑制等,治疗效果有限[3]。研究表明,中药联合化疗药物可提高抗肿瘤疗效和/或减少副作用[3,6]。同时,有研究报道LE联合化疗药物在体外对肝癌细胞具有凋亡诱导作用[7]。为进一步探索LE的体内抗肝癌作用,本研究通过建立H22荷瘤小鼠模型,研究LE对CTX治疗肝癌的增效减毒作用,旨在为临床抗肝癌联合药物方案的选择提供参考。
1 材料
1.1 仪器
Spectra Max Plus 384型酶标仪(香港分子仪器有限公司);TU-180型紫外-可见分光光度计(北京普析通用仪器有限责任公司);CKX41型倒置显微镜(日本Olympus公司);7100型全自动生化分析仪(日本Hitachi公司);XT-2000I型血细胞分析仪(日本Sysmex公司);EG1150型病理组织包埋机(上海莱卡仪器有限公司);FD-1A-50型冷冻干燥机(北京博医康试验仪器有限公司);H1850R型台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);ZNY-686型多功能提取浓缩机(青州市精诚医药装备制造有限公司);MS1型涡旋混匀器(广州仪科技术有限公司);HH-4型数字恒温水浴箱(常州国华电器有限公司);ML304T型万分之一电子天平[梅特勒-托利多国际贸易(上海)有限公司]。
1.2 药品与试剂
蛞蝓购自广西壮族自治区百色市灵山县农贸市场,经由广西医科大学第一附属医院药理学教研室黄仁彬教授鉴定为腹足纲柄眼目蛞蝓科动物蛞蝓A. agrestis L. 的冰鲜虫体,于-20 ℃冻存,备用。
注射用环磷酰胺(江苏恒瑞医药有限公司,批号:17011325,规格:0.2 g);丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、血肌酐(Scr)、尿素氮(BUN)检测试剂盒,总蛋白定量试剂盒以及还原型谷胱甘肽(GSH)、丙二醛(MDA)、超氧化物歧化酶(SOD)检测测试盒(南京建成生物工程研究所,批号:C009-2、C010-2、C011-2、C013-2、20171130、20171125、20171129、20180113);鲎试剂(湛江安度斯生物有限公司,批号:1711041);Triton X-114试剂(北京索莱宝科技有限公司,批号:T8210);血管内皮生长因子(VEGF)、肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)酶联免疫吸附测定(ELISA)检测试剂盒(上海源叶生物科技有限公司,批号均为E20171201A);兔抗人p53、Bcl-2、Bax单克隆抗体(福州迈新生物技术开发有限公司,批号:170705142C、170705100C、170705023D);PV6001兔二步法检测试剂盒、DAB显色试剂盒(北京中山生物技术有限公司);磷酸盐缓冲液(PBS,pH 7.4)、Mayors苏木精染液(武汉博士德生物工程有限公司);氯化钠注射液(中国大冢制药有限公司,批号:OB79B3,规格:10 mL ∶ 0.09 g;作生理盐水用);甲醛、二甲苯、乙醇等試剂均为分析纯或实验室常用规格,水为超纯水。
1.3 细胞
小鼠肝癌H22瘤株由广西医科大学药理学教研室提供。
1.4 动物
SPF级昆明种小鼠,雄性,体质量(20±2) g,由广西医科大学实验动物中心提供,动物使用许可证号:SYXK桂2014-0003。本研究经广西医科大学实验动物伦理委员会批准,研究方案符合我国动物实验伦理相关指导原则[8]的要求。
2 方法
2.1 LE的制备
将冻存的蛞蝓于室温下解冻1.5 h后,加入2倍量(mL/g)水,混合,匀浆。匀浆后,以2 000 r/min离心10 min,收集上清液。残渣按上述步骤重复提取1次,合并上清液。经鲎试剂检测内毒素后,加入Triton X-114试剂适量以去除内毒素,以3 000 r/min离心10 min,吸取上清液并将其置于-20 ℃冷冻过夜,再于-45 ℃冷冻干燥,得冻干粉。将上述冻干粉研磨,过20目筛,即得LE(每克虫体可得LE冻干粉0.138 25 g),于室温下密封保存,备用。
2.2 造模
将小鼠肝癌H22瘤株复苏,按文献方法[9]接种于小鼠腹腔,体内传代至第4代。抽取上述第4代接种肝癌H22瘤株小鼠第7天时的腹水,用生理盐水稀释,制成密度为2×107个/mL的肿瘤细胞悬液。于小鼠左腋皮下迅速单次接种该细胞悬液0.2 mL,并以接种后小鼠左腋下出现肉眼可见的瘤组织(大约于注射后6 d时)为造模成功。
2.3 分组与给药
将小鼠随机分为9个组,即正常组,模型组,CTX组(0.02 g/kg,以生理盐水制成相应药液,剂量设置参考文献方法[10]),LE低、中、高剂量联用组(即LEL、LEM、LEH组,0.6、1.2、2.4 g/kg,以提取物质量计;以生理盐水制成相应药液,剂量设置参考文献方法[10]),CTX+LE低、中、高剂量联用组(即CTX+LEL、CTX+LEM、CTX+LEH组,剂量及其设置依据同各单药组),每组10只。除正常组小鼠接种等体积生理盐水外,其余组小鼠均按“2.2”项下方法接种肿瘤细胞悬液以复制荷瘤模型。接种24 h后,正常组和模型组小鼠均灌胃生理盐水(0.2 mL/10 g),各给药组小鼠分别腹腔注射CTX或/和灌胃LE(腹腔注射和灌胃体积均为0.2 mL/10 g,各联用组总给药体积为0.4 mL/10 g),每日1次,连续10 d。
2.4 指标检测
2.4.1 抑瘤作用指标 末次给药后第2天,观察小鼠一般情况,称取其体质量并于眼球取血适量后,将其处死,剥脱瘤块,称取瘤体质量并计算抑瘤率:抑瘤率(%)=(C-T)/C×100%(式中,C为模型组小鼠的平均瘤体质量,T为各给药小鼠的平均瘤体质量)。采用金氏公式[11]来评估联合用药的效果(q):q=EAB/[EA+(1-EA)EB](式中,EA是A药的抑瘤率,EB是B药的抑瘤率,EAB是A、B两药联合使用时的抑瘤率)。当q为0.85~1.15时,表示两药作用相加;当q>1.15时,表示两药作用协同;当q<0.85时,表示两药作用拮抗[11]。剖取小鼠胸腺和脾脏,称其质量,计算胸腺指数(TI)、脾指数(SI):TI或SI(mg/10 g)=胸腺或脾脏质量/体质量。
2.4.2 肝、肾功能和骨髓抑制指标 对联合用药与单用CTX的治疗作用进行比较。取正常组、模型组、CTX组和CTX+LEL、CTX+LEM、CTX+LEH组小鼠的血样适量,使用血细胞计数仪检测其白细胞(WBC)、红细胞(RBC)、血小板(PLT)计数;另取血样适量,分离血清后,使用全自动生化分析仪检测小鼠血清中ALT、AST、Scr、BUN的含量,严格按相应试剂盒说明书方法操作。
2.4.3 肿瘤组织中MDA含量和SOD、GSH活性 对联合用药與单用CTX的治疗作用进行比较。取模型组、CTX组和CTX+LEL、CTX+LEM、CTX+LEH组小鼠的肿瘤组织适量,置于冰盘上,用4 ℃生理盐水清洗,用滤纸吸干后,用生理盐水于冰浴上制成10%的组织匀浆,于4 ℃下以3 500~4 000 r/min离心10 min。取上清液,采用考马斯亮蓝法测定蛋白含量,采用比色法以全自动生化分析仪测定MDA含量和SOD、GSH活性,严格按相应试剂盒说明书方法操作。
2.4.4 肿瘤组织中VEGF、TNF-α、IL-6水平 对联合用药与单用CTX的治疗作用进行比较。取模型组、CTX组和CTX+LEL、CTX+LEM、CTX+LEH组小鼠的肿瘤组织适量,按“2.4.3”项下方法制备肿瘤组织匀浆,以 3 000 r/min离心10 min。取上清液,采用ELISA法以酶标仪检测VEGF、TNF-α、IL-6水平,严格按照相应试剂盒说明书方法操作。
2.4.5 肿瘤组织中癌基因蛋白的表达 采用免疫组化法对抑瘤率最高的联合用药组与单用CTX的治疗作用进行比较。取模型组、CTX组和CTX+LEM组小鼠肿瘤组织适量,行常规切片(厚度约3 μm),脱蜡,经乙醇梯度水化,用3%过氧化氢溶液孵育以阻断内源性过氧化物酶;行抗原修复后,加入p53、Bcl-2、Bax一抗(稀释度均为1 ∶ 50),4 ℃孵育过夜;PBS清洗3次,加入二步法检测试剂50 μL,室温孵育15 min;PBS清洗3次,以DAB试剂显色;经水洗、苏木精复染、脱水、封片后,使用倒置显微镜观察。p53、Bcl-2、Bax均定位于细胞核,故以细胞核中出现明显的棕黄色颗粒者为阳性表达,不着色或着色浅而不显著者为阴性。采用Image J 1.48软件分析上述蛋白阳性表达的平均积分光密度(IOD)值,用以表示蛋白表达水平。
2.5 统计学方法
采用SPSS 22.0软件对数据进行统计分析。计量资料均采用x±s表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用t检验。P<0.05为差异有统计学意义。
3 结果
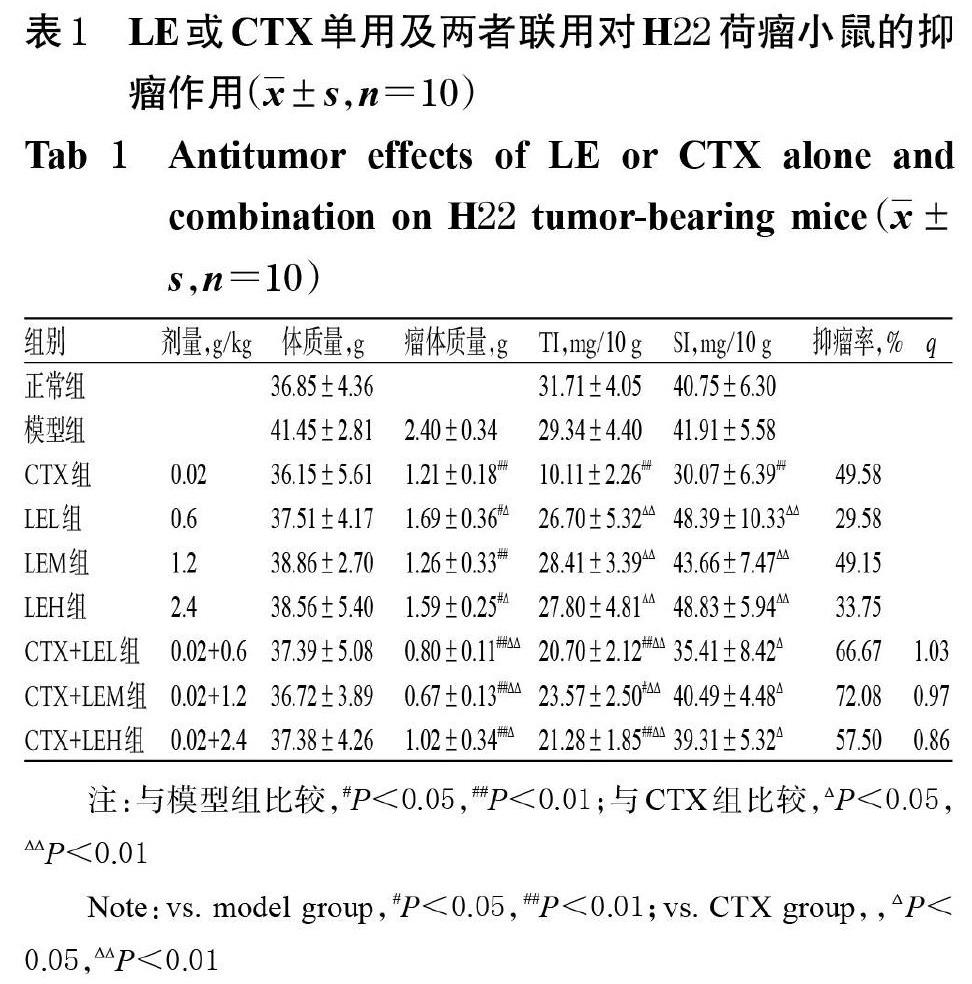
3.1 LE或CTX单用及两者联用对H22荷瘤小鼠的抑瘤作用
模型组小鼠精神不佳,且伴有多饮、多食的症状,但体质量、TI、SI与正常组比较差异均无统计学意义(P>0.05)。与模型组比较,各给药组小鼠精神状态良好,皮毛顺,饮水量、进食量正常,且各给药组的小鼠瘤体质量,CTX组的TI、SI以及各联用组的TI均显著降低;但LEL组、LEH组的瘤体质量,各LE单用组及各联用组的TI、SI均显著高于CTX组,各联用组的瘤体质量均显著低于CTX组(P<0.05或P<0.01)。各给药组的抑瘤率为29.58%~72.08%,CTX+LEL组、CTX+LEM组、CTX+LEH组的q值分别为1.03、0.97、0.86,提示两药联用时抑瘤作用相加,详见表1。
3.2 LE与CTX联用对H22荷瘤小鼠肝、肾功能和骨髓抑制的影响
与正常组比较,模型组小鼠的WBC计数、AST含量均显著升高,ALT、BUN含量均显著降低(P<0.05或P<0.01);与模型组比较,CTX组小鼠的WBC计数和AST、BUN含量均显著降低(P<0.05或P<0.01),而各联用药组小鼠上述各指标均无显著变化(P>0.05);与CTX组比较,各联用药组小鼠的WBC计数和AST含量以及CTX+LEM组小鼠的ALT含量均显著升高(P<0.05或P<0.01),详见表2。
3.3 LE与CTX联用对H22荷瘤小鼠肿瘤组织中MDA含量和SOD、GSH活性的影响
与模型组比较,各联用组小鼠肿瘤组织中的MDA含量均显著降低,各给药组的SOD、GSH活性均显著升高(P<0.05或P<0.01);与CTX组比较,CTX+LEH组的MDA含量显著降低,CTX+LEH组的SOD活性和CTX+LEM组的GSH活性均显著升高(P<0.05),详见表3。
3.4 LE與CTX联用对H22荷瘤小鼠肿瘤组织中VEGF、TNF-α、IL-6水平的影响
与模型组比较,各给药组小鼠肿瘤组织中的VEGF、TNF-α、IL-6水平均显著降低(P<0.05或P<0.01);与CTX组比较,CTX+LEM组、CTX+LEH组的VEGF、TNF-α水平以及各联用组的IL-6水平均显著降低(P<0.05或P<0.01),详见表4。
3.5 LE与CTX联用对H22荷瘤小鼠肿瘤组织中p53、Bax、Bcl-2蛋白表达的影响
与模型组比较,CTX+LEM组小鼠肿瘤组织中p53和各给药组Bax蛋白的表达水平均显著升高,各给药组Bcl-2蛋白的表达水平均显著降低(P<0.05或P<0.01);与CTX组比较,CTX+LEM组p53、Bax蛋白的表达水平均显著升高,Bcl-2蛋白的表达水平均显著降低(P<0.01),详见图1、表5。
4 讨论
肿瘤的发生机制复杂,治疗方案的个体化差异大,传统化疗药物往往无法取得满意的疗效,且其不良反应更是让部分患者难以耐受[12];随着抗肿瘤中药和化疗药物联合治疗在临床上的应用越来越多,研究发现,联合用药可增强化疗药物的疗效并降低不良反应、细胞耐药的发生率[13]。因此,从中药筛选出可以减少化疗药物的毒性作用、又可以增加抗肿瘤疗效的药物显得十分重要。基于LE本身具备一定的抗肿瘤活性,同时毒性低、安全性高的特点[7],本研究初步探索了其与CTX联合用药治疗肝癌的效果。结果显示,各给药组小鼠体内肿瘤细胞的生长均受到不同程度的抑制,提示CTX或LE单用及两者联用均表现出一定的抗肿瘤活性;此外,当CTX与不同剂量LE联合用药时,q值在0.85~1.15范围内,提示两药联合的抑瘤作用相加。
胸腺和脾脏作为机体重要的中枢免疫器官,与机体免疫表达密切相关;如果胸腺和脾脏功能受到不良影响,可能使免疫调节失衡,产生一系列免疫性疾病,故机体免疫功能的变化可由TI和SI反映[14]。与模型组比较,CTX组小鼠TI和SI均下降,不同剂量LE单用组TI未见明显改变,不同剂量联用组的TI下降,而其余各给药组的SI均未见明显变化;与CTX组比较,不同剂量联用组小鼠的TI和SI均明显升高。上述结果提示,LE可有效防止CTX治疗肝癌小鼠时引起的免疫抑制,并维持和提高其免疫功能。此外,大多数的抗肿瘤药物在起到治疗作用的同时,通常伴有骨髓抑制的毒副作用,其中WBC、RBC、PLT与骨髓抑制密切相关[15]。本研究显示,与模型组比较,CTX组小鼠的WBC计数明显降低,但RBC计数和PLT计数未见明显变化。这提示荷瘤小鼠出现骨髓抑制,但各指标有所差异,可能与粒细胞在机体的生存周期较短、红细胞和血小板的生存周期较长有关[16]。与CTX组比较,各剂量联用组的WBC计数明显改善,提示联合用药可以减少CTX治疗时所产生的骨髓抑制毒性。此外,本研究结果还显示,与模型组比较,CTX组小鼠血清中AST和BUN含量均显著降低,但各联用组小鼠的肝、肾功能指标均无明显变化,提示联合用药未增加化疗药物的肝、肾毒副作用。
氧化应激与肿瘤的产生、发展和转移有密切联系,大量研究都涉及了氧化应激引起的损伤及其参与细胞增殖、凋亡等过程[17-18]。MDA是脂类氧化最终产物,反映了机体氧化受损程度;SOD和GSH可清除氧自由基,减少或修复细胞损伤,具有调节细胞凋亡的功能[19]。本研究结果显示,各联用组小鼠肿瘤组织中MDA含量均较模型组显著降低,且CTX+LEH组显著低于CTX组;各给药组的SOD、GSH活性均较模型组显著升高,且CTX+LEH组的SOD活性、CTX+LEM组的GSH活性均显著高于CTX组,提示CTX+LEM组和CTX+LEH组表现出更明显的抗氧化应激作用,说明联合用药可能通过加强抗氧化应激作用来抑制肿瘤细胞的生长。
VEGF、TNF-α、IL-6等血管生成因子在参与血管生成过程中起到关键作用,而肝癌作为血管依赖性恶性肿瘤,其生长和转移与血管生成密切相关[20]。有研究指出,VEGF与其受体结合,可通过诱导正常内皮细胞的有丝分裂和趋化来增加血管的通透性,从而促进新生血管的形成和肿瘤细胞的生长[21]。炎症与癌症之间的功能关系已被广泛研究,炎症微环境被认为在肝癌发展的不同阶段都发挥着重要的作用[22-23]。有报道称,作为炎性细胞因子的TNF-α和IL-6在肝癌组织中呈高表达,使用CTX治疗肝癌可改变肿瘤生长的微环境,并有效地抑制炎症的发生,从而减少TNF-α和IL-6的分泌,延缓或阻断肿瘤的生长[24]。本研究结果显示,各给药组小鼠肿瘤组织中VEGF、TNF-α、IL-6水平均显著降低,且CTX+LEM组、CTX+LEH组的VEGF、TNF-α水平以及各联用组的IL-6水平均显著低于CTX组,与上述文献结果基本一致。这提示联合用药可以显著地抑制VEGF、TNF-α、IL-6的分泌,其中CTX+LEM组、CTX+LEH组的抑制作用更强,表明CTX联合LE治疗可以增强CTX抑制血管生成因子分泌的作用。
肿瘤细胞凋亡在癌症的发生和发展中起着重要的作用。有学者发现,许多受体介导的细胞信号转导和众多不同基因均参与了肿瘤细胞凋亡的激活,并分别调控肿瘤细胞的凋亡[25]。这些基因包括具有促进细胞凋亡作用的p53、Bax和具有抑制细胞凋亡作用的Bcl-2等。p53可上调Bax、下调Bcl-2的表达,影响肿瘤细胞的凋亡,改变线粒体的渗透性,从而影响下游促凋亡基因的功能[26]。本研究结果显示,与模型组和CTX组相比,CTX+LEM组p53、Bax表达水平显著升高而Bcl-2的表达水平显著降低,且CTX+LEM组p53、Bax蛋白的表达水平均显著高于CTX组,而Bcl-2蛋白的表达水平显著低于CTX组,提示联合用药可能增强CTX促肿瘤细胞凋亡的作用。
综上所述,CTX联合LE治疗肝癌模型小鼠可以增加CTX的抗肝癌作用,这可能与联合用药具有更强的抗氧化应激、抑制血管生成和炎症因子分泌以及调控凋亡蛋白表达有关,且联合用药毒性较小。本文结果可能为LE抗肝癌的作用机制提供新的思路,提示LE可能是一种潜在的治疗肝癌的药物,但尚需进一步研究探讨其具体作用机制。
参考文献
[ 1 ] CHEN W,ZHENG R,BAADE PD,et al. Cancer statistics in China,2015[J]. CA Cancer J Clin,2016,66(2):115- 132.
[ 2 ] BRAY F,FERLAY J,SOERJOMATARAM I,et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2018,68(6):394-424.
[ 3 ] ZONG S,LI J,YANG L,et al. Synergistic antitumor effect of polysaccharide from Lachnum sp. in combination with cyclophosphamide in hepatocellular carcinoma[J]. Carbohydr Polym,2018. DOI: 10.1016/j.carbpol.2018. 05.006.
[ 4 ] 陳根林.蛞蝓的药理研究进展[J].北方药学,2013,10(10):55-56.
[ 5 ] 王娟,曹建国,姚旭,等.蛞蝓有效提取物抑制宫颈癌HeLa细胞裸鼠移植瘤生长[J].中南医学科学杂志,2017,45(6):562-566.
[ 6 ] 李娇,郭美仙,张冰清,等.美洲大蠊提取物CⅡ-3对肝癌H22荷瘤小鼠作用研究[J].中华肿瘤防治杂志,2017,24(11):739-744.
[ 7 ] 吴波明,曾芳,黎运呈.蛞蝓提取物联合5-氟尿嘧啶对肝癌细胞HCCLM3的凋亡诱导作用[J].中华中医药学刊,2013,31(12):2787-2791.
[ 8 ] 国家质量监督检验检疫总局,国家标准化管理委员会.实验动物:福利伦理审查指南[S]. 2018-02-06.
[ 9 ] 魏伟,吴希美,李元建.药理实验方法学[M].4版.北京:人民卫生出版社,2010:1757-1759.
[10] 曾振东,韦金育,曾翠琼,等.蛞蝓对小鼠S180肉瘤的抑制及免疫调节作用[J].北方药学,2013,10(5):67-68.
[11] 牟卫伟,许焕丽.半枝莲乙醇提取物对顺铂抗肝癌的增效作用研究[J].中华中医药杂志,2017,32(1):306-308.
[12] NIE J,ZHAO C,DENG LI,et al. Efficacy of traditional Chinese medicine in treating cancer[J]. Biomed Rep,2016,4(1):3-14.
[13] 朱宏.参芪扶正注射液配合化疗治疗恶性肿瘤的临床效果分析[J].中国现代药物应用,2018,12(1):85-86.
[14] 曾繁强,徐永莉,江思华,等.红毛鸡干燥体醇提物对血虚模型小鼠的补血作用研究[J].中国药房,2016,27(31):4373-4375.
[15] CR?QUIT P,CHAIMANI A,YAVCHITZ A,et al. Comparative efficacy and safety of second-line treatments for advanced non-small cell lung cancer with wild-type or unknown status for epidermal growth factor receptor: a systematic review and network meta-analysis[J]. BMC Med,2017. DOI:10.1186/s12916-017-0954.x.
[16] 王庭槐.生理学[M]. 9版.北京:人民卫生出版社,2018: 66-72.
[17] DING K,LIAO Y,GONG D,et al. Effect of long non- coding RNA H19 on oxidative stress and chemotherapy resistance of CD133+ cancer stem cells via the MAPK/ERK signaling pathway in hepatocellular carcinoma[J]. Biochem Biophys Res Commun,2018,502(2):194-201.
[18] 吴丽珍,曹性玲,李欢,等.佛甲草对S180荷瘤小鼠氧化应激和肿瘤免疫的影响[J].重庆医学,2015,44(19):2613-2615.
[19] 凌娜,王帆,宋冬雪,等.硒化卡拉胶联合表阿霉素体内对H22肝癌小鼠抗肿瘤与抗氧化作用的研究[J].中国海洋药物,2016,35(6):52-57.
[20] CARBAJO-PESCADOR S,ORDONEZ R,BENET M, et al. Inhibition of VEGF expression through blockade of Hif1alpha and STAT3 signalling mediates the anti-angiogenic effect of melatonin in HepG2 liver cancer cells[J]. Br J Cancer,2013,109(1):83-91.
[21] CAO W,HU C,WU L,et al. Rosmarinic acid inhibits inflammation and angiogenesis of hepatocellular carcinoma by suppression of NF-κB signaling in H22 tumor-bearing mice[J]. J Pharmacol Sci,2016,132(2):131-137.
[22] GALUN E. Liver inflammation and cancer:the role of tissue microenvironment in generating the tumor-promoting niche (TPN) in the development of hepatocellular carcinoma[J]. Hepatology,2016,63(2):354-356.
[23] RAMU A,KATHIRESAN S,RAMADOSS H,et al. Gramine attenuates EGFR-mediated inflammation and cell proliferation in oral carcinogenesis via regulation of NF- κB and STAT3 signaling[J]. Biomed Pharmacother,2017. DOI:10.1016/j.biopha.2017.12.049.
[24] 馮越,鲍秀琦.关于TNF-α和IL-6在肝癌患者血清中表达情况的研究[J].世界最新医学信息文摘,2018,18(2):140.
[25] ZHANG YJ,PAN Q,YU Y,et al. MicroRNA-519d indu- ces autophagy and apoptosis of human hepatocellular carcinoma cells through activation of the AMPK signaling pathway via Rab10[J]. Cancer Manag Res,2020. DOI: 10.2147/CMAR.S207548.
[26] ZHANG J,HUANG K,ONEILL KL,et al. Bax/Bak activation in the absence of Bid,Bim,Puma and p53[J]. Cell Death Dis,2016. DOI:10.1038/cddis.2016.167.
(收稿日期:2020-05-15 修回日期:2020-09-25)
(编辑:张元媛)

