三种GC-1细胞DNA损伤模型的建立及比较分析
杨思琪,赵海霞,尤 旭,马琼艳,杨 圆,张 艳,叶 勇,吴 杰,袁 丁,张长城
(三峡大学医学院,湖北 宜昌 443002)
近年来,不育已被WHO确认为一个公共卫生问题,在普通人群中的发病率逐年增高。一项调查研究显示,全世界约有15%的成年夫妇患有原发性不育症,其中由男性因素导致的不育约占50%,而其具体成因机制尚不十分清楚[1]。研究发现,精原细胞损伤所致男性生精功能障碍是导致男性不育的主要原因[2]。另有研究显示,DNA损伤是导致精原细胞功能受损的主要原因之一[3-4]。近年来发现射线、活性氧(ROS)、化疗药物等都会导致睾丸生精细胞DNA损伤,从而导致睾丸功能障碍,但其研究主要聚焦在动物水平上,在细胞水平上研究甚少,且目前仍缺乏较好的细胞模型。因此,本研究以小鼠睾丸精原细胞株GC-1细胞为研究对象,采用UVB辐照、D-半乳糖(D-galactose,D-Gal)、博来霉素(bleomycin,BLM)刺激建立3种GC-1细胞DNA损伤模型并进行比较和评价,以期为防治因DNA损伤所致男性不育提供相应的实验模型。
1 材料与方法
1.1 材料与试剂
1.1.1细胞株 小鼠精原细胞株GC-1细胞购自上海通派生物细胞库。
1.1.2药物及试剂 D-Gal购于美国Sigma公司,批号:WXBC9497V;BLM购于瀚晖制药有限公司,批号:19012311;ECL显影液购自碧云天生物技术研究所;苯甲基磺酰氟(phenylmethanesulfluoride,PMSF)、RIPA裂解液、磷酸蛋白酶抑制剂购自武汉谷歌生物有限公司;BCA蛋白定量试剂盒购自北京普利莱基因技术有限公司;β-actin(批号:#4970L)、p-p53(批号:#12571)购自美国Cell Signaling Technology公司;γ-H2AX(批号:sc-101696)购自Santa Cruz公司;p21(批号:ab109199)购自美国Abcam公司;辣根过氧化物酶 (Horseradish Peroxidase,HRP)标记的山羊抗鼠 IgG、HRP标记的山羊抗兔二抗购自武汉科瑞科技有限公司。
1.1.3主要仪器 CKX41型光学倒置显微镜,日本Olympus公司;FORMA series Ⅱ二氧化碳培养箱,美国Thermo公司;SW-4T-2F型超净工作台,上海博讯实业公司医疗设备厂;TD25-WS型台式低速离心机,湖南省湘仪仪器有限公司;Centrifuge 5424 R型高速冷冻离心机,德国Eppendorf公司;Power Pac TM Basic电泳仪,美国Bio-Rad公司;Bioshine Chemic Q 4800化学发光凝胶成像自动显影仪,上海勤翔科学仪器有限公司;A1R+激光共聚焦显微镜,日本Nikon公司。
1.2 实验方法
1.2.1UVB辐照致GC-1细胞DNA损伤模型 将GC-1细胞接种于培养皿中培养至细胞密度达80%左右时,使用40 J·m-2辐照剂量辐照细胞,随后加入新配置的培养基,继续培养细胞0.5、1、2、4和6 h。
1.2.2D-Gal刺激致GC-1细胞DNA损伤模型 前期预实验结果发现,采用不同浓度(0、50、100、150、200和250 mmol·L-1)D-Gal刺激GC-1细胞不同时间后,DNA损伤修复相关蛋白表达均在150 mmol·L-1浓度达高峰,因此我们选择150 mmol·L-1D-Gal浓度刺激GC-1细胞0、1、3、6、12、24h来进一步建立DNA损伤模型。
1.2.3BLM刺激致GC-1细胞DNA损伤模型 不同浓度(2.5、5、10、25和50 mg·L-1)BLM刺激GC-1细胞0.5、1、2、4和6 h后收集细胞。
1.2.4Western blot法检测GC-1细胞DNA损伤相关蛋白γ-H2AX、p-p53和p21表达水平 收集上述不同处理组细胞,提取总蛋白,定量,蛋白水浴变性,将蛋白样品进行电泳并转印至PVDF膜,脱脂牛奶室温封闭1 h,分别加入兔抗γ-H2AX抗体(1 ∶1 000)、兔抗P-P53抗体(1 ∶2 000)、兔抗P21抗体(1 ∶1 000)和兔抗 β-actin 抗体(1 ∶5 000),4 ℃冰箱摇床孵育过夜;次日,TBST洗膜,加HRP标记的山羊抗兔二抗(1 ∶3 000),室温孵育1 h;TBST洗膜。ECL化学发光于凝胶成像系统中显影成像。
1.2.5免疫荧光法检测GC-1细胞γ-H2AX和8-OHdG蛋白表达及定位 将无菌圆形盖玻片放入24孔板中,将GC-1细胞悬液接种到无菌玻片上,按照“1.2.1”、“1.2.2”、“1.2.3”项下处理细胞后弃掉上清,PBS洗涤细胞20 min后,4%多聚甲醛固定细胞30 min后PBS洗涤20 min。后经0.1% Triton X-100打孔15 min,PBS洗涤细胞20 min。1% BSA于温度为25 ℃下封闭1 h,弃掉封闭液后,置于4 ℃冰箱孵育一抗。一抗孵育完成后,25 ℃复温30 min以上,PBS洗涤细胞20 min。37 ℃下避光孵育荧光二抗1 h,PBS洗涤细胞后,避光孵育DAPI(0.5 mg·L-1)5 min,PBS洗涤后封片,共聚焦显微镜下观察并拍照取图。
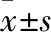
2 结果
2.1 不同处理因素对GC-1细胞γ-H2AX蛋白表达和定位的影响
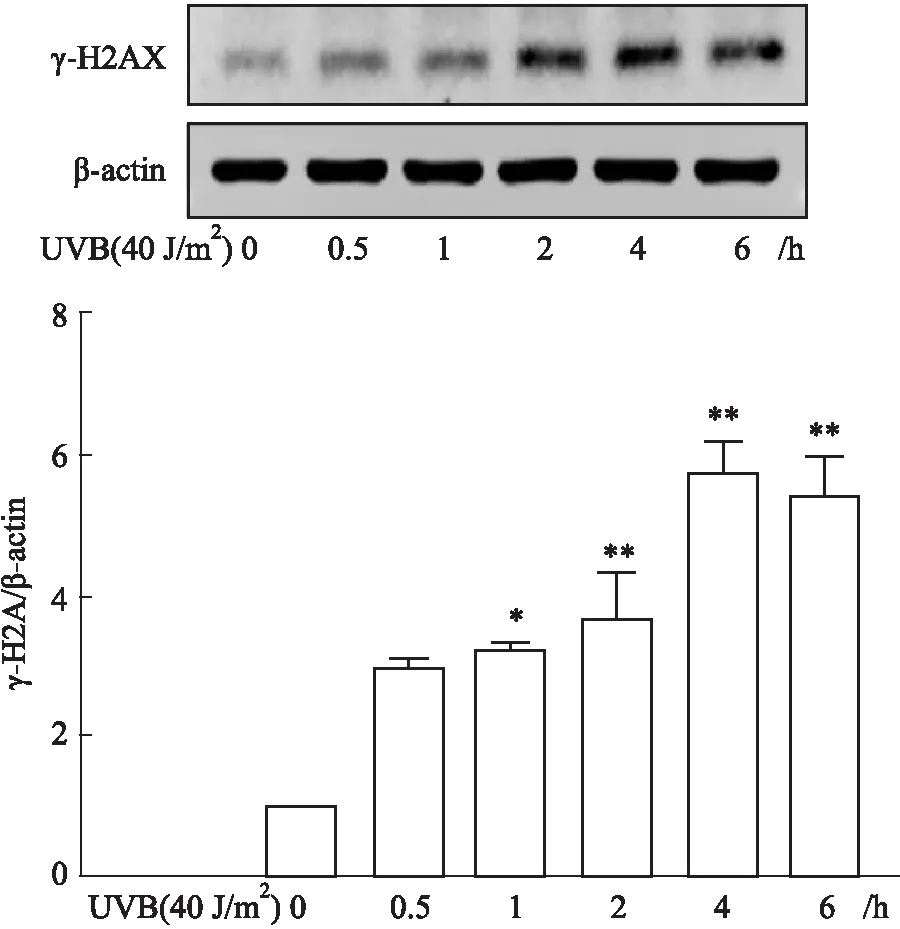
Fig 1 Effect of 40 J/m2UVB irradiation on expression of γ-H2AX protein in GC-1 n=3)
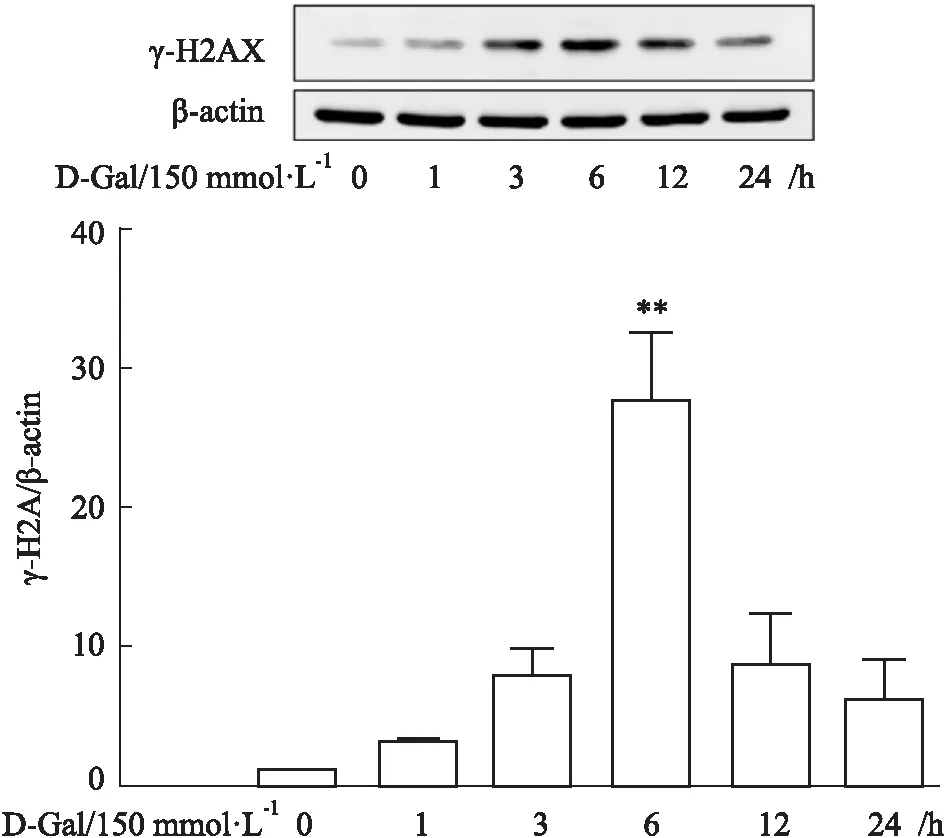
Fig 2 Effect of 150 mmol·L-1 D-Gal treatment on expression of γ-H2AX protein in GC-1 n=3)
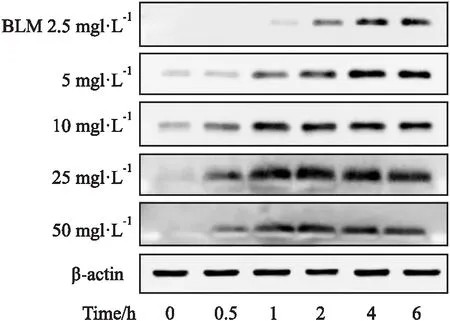
Fig 3 Effects of different concentrations of BLM on expression of γ-H2AX protein in GC-1 cells

Fig 4 Effects of different treatment factors on expression and localization of γ-H2AX protein in GC-1 cells (× 400)
2.1.1不同处理因素对GC-1细胞γ-H2AX蛋白表达的影响 Western blot结果显示,UVB辐照后,γ-H2AX蛋白表达水平在4 h达到高峰,随后开始下降;D-Gal处理GC-1细胞不同时间后,γ-H2AX蛋白表达水平在6 h达到高峰,随后开始明显下降;不同浓度BLM刺激GC-1细胞不同时间后,当BLM浓度在2.5~10 mg·L-1范围时,γ-H2AX蛋白表达水平逐渐升高,提示DNA损伤不断加重,当BLM浓度在25~50 mg·L-1范围时,γ-H2AX蛋白表达水平在2 h达到峰值,4 h开始下降,提示此时GC-1细胞损伤严重,细胞可能开始凋亡。
2.1.2不同处理因素对GC-1细胞γ-H2AX蛋白表达和定位的影响 为进一步观察不同处理因素对GC-1细胞DNA损伤的影响,我们采用免疫荧光法观察GC-1细胞γ-H2AX表达和定位。UVB辐照后,γ-H2AX荧光强度在4 h最强,随后减弱;150 mmol·L-1D-Gal处理GC-1细胞后,γ-H2AX荧光强度在6 h最强,随后开始减弱,24 h后荧光强度已接近正常水平;10 mg·L-1BLM刺激GC-1细胞不同时间后,γ-H2AX荧光强度持续增强。免疫荧光结果均与Western blot结果一致。

Fig 5 Effects of different treatment factors onexpression and localization of 8-OHdG in GC-1 cells (× 400)
2.2 不同处理因素对GC-1细胞8-OHdG表达和定位的影响免疫荧光结果显示,在未处理的GC-1细胞中未检测到荧光,UVB辐照和BLM刺激后,8-OHdG在胞核和胞质内均有表达,且随着处理时间延长,GC-1细胞核内表达逐渐增多,提示GC-1细胞氧化性DNA损伤不断加重,DNA修复酶来不及切割8-OHdG,导致愈来愈多的8-OHdG蓄积在细胞核内;D-Gal处理后,8-OHdG主要表达在胞质,在6 h达到高峰,随后开始下降。

Fig 6 Effect of UVB irradiation on expression of p-p53 and p21 protein in GC-1 n=3)

Fig 7 Effect of 150 mmol·L-1 D-Gal treatment on expression of p-p53 and p21 protein in GC-1 n=3)
2.3 不同处理条件对GC-1细胞p-p53和p21蛋白表达的影响Western blot结果显示,UVB辐照后,p-p53和p21蛋白表达水平逐渐升高,p-p53蛋白表达水平2 h后开始明显升高,p21在6 h开始明显升高;150 mmol·L-1D-Gal处理GC-1细胞不同时间后,p-p53蛋白表达水平在6 h达到高峰,p21蛋白表达水平在6 h开始明显增加,12 h达到高峰,24 h后p-p53和p21蛋白表达水平均下降;浓度为2.5、5、10 mg·L-1的BLM处理GC-1细胞不同时间后,p-p53和p21蛋白表达水平均逐渐升高,且趋势一致,而25和50mg·L-1浓度的BLM处理GC-1细胞不同时间后,p-p53和p21蛋白表达水平均在2 h达到峰值,4 h后p-p53表达量开始下降,p21蛋白几乎无表达。

Fig 8 Effects of different concentrations of BLM on expression of p-p53 and p21 protein in GC-1 cells
3 讨论
现有研究发现,不育症可由多种因素引起,如DNA损伤、职业和环境、遗传、下丘脑-垂体功能紊乱等[5-6]。射线、ROS、化疗药等都会导致睾丸生精细胞DNA损伤,从而导致睾丸功能障碍,降低男性生育力。紫外线辐照是最重要的DNA损害剂之一,特别是UVA和UVB,不仅可以被DNA直接吸收导致损伤,而且还可以被皮肤细胞中存在的生色团吸收。这一过程可导致ROS形成,从而间接造成DNA损伤[7]。D-Gal是一种生理性营养成分,在正常机体代谢中可转变为葡萄糖,参与葡萄糖代谢,但过量的D-Gal可导致细胞内代谢紊乱,使组织和细胞中氧化酶活性改变,产生一些氧化产物如ROS,导致生物大分子结构和功能的氧化损伤[8]。BLM是一种具有抗癌和其他临床应用的氧化还原活性药物,主要用于治疗睾丸癌、阴茎鳞癌等,也经常用作工具药,其作用机制主要是直接嵌入DNA的G-C碱基对中,还可以与DNA磷酸基相互作用,使其解链,而后导致氧自由基和羟自由基生成,引起DNA链断裂[9]。因UVB、D-Gal和BLM 3种因素导致DNA损伤的作用机理不同,其导致细胞DNA损伤的表现,损伤后修复的机制是否有差异尚有待探究。
研究发现,当细胞发生DNA损伤时,组蛋白H2AX Ser139位点被磷酸化为γ-H2AX并募集到损伤处,在细胞核中形成焦点,是DNA双链断裂早期的一个关键标记物[10-11]。因此,我们采用Western blot和免疫荧光法检测3种处理方式对GC-1细胞γ-H2AX蛋白表达和定位的影响。Western blot结果显示,UVB辐照后,GC-1细胞γ-H2AX蛋白表达在4 h达到高峰,D-Gal处理后GC-1细胞γ-H2AX蛋白表达在6 h达高峰,与免疫荧光结果一致。不同浓度BLM处理后γ-H2AX蛋白表达随时间延长持续升高,且BLM浓度越高,γ-H2AX蛋白表达达到高峰时间越短。随后,我们选取10 μg·L-1BLM不同时间刺激GC-1细胞,免疫荧光法检测γ-H2AX表达和定位,结果显示,10 mg·L-1BLM刺激后γ-H2AX表达持续上升,与Western blot结果一致。以上结果提示,3种处理方式对GC-1细胞DNA损伤程度不同,D-Gal处理后,GC-1细胞DNA损伤达到高峰的时间最长,提示DNA损伤较轻,而UVB辐照和BLM刺激后GC-1细胞DNA损伤较重。
当细胞DNA鸟嘌呤碱基受到ROS的攻击,其第8位碳原子会额外增加1个羟基,从而直接形成1个经过氧化修饰的产物8-OHdG,而后8-OHdG会被DNA修复系统中的糖基化酶识别并切除,之后被运出胞外,此,8-OHdG被认为是氧化性DNA损伤的标记物之一[12]。本实验采用免疫荧光法观察3种不同处理因素对GC-1细胞8-OHdG表达和定位的影响。结果显示,在未处理的GC-1细胞中未检测到荧光,UVB辐照和BLM刺激后,8-OHdG在胞核和胞浆内均有表达,且随着处理时间延长,核内表达逐渐增多,可能是GC-1细胞DNA损伤不断加重,DNA修复酶来不及切割8-OHdG,导致大量8-OHdG被蓄积在细胞核内;而D-Gal处理后,8-OHdG主要表达在胞质,在6 h达到高峰,随后开始下降,提示DNA氧化损伤开始减轻,DNA损伤修复启动。以上结果表明,相比于D-Gal处理组,UVB辐照和BLM处理组GC-1细胞DNA氧化损伤较重。
DNA损伤后,可激活细胞内DNA损伤应答反应,招募一系列损伤应答蛋白到损伤位点,介导细胞周期阻滞进而修复损伤的DNA或诱导凋亡清除无法修复的细胞,维持基因组稳定性[13]。当细胞发生DNA损伤时可激活p53,在DNA损伤较轻时活化的p53可以激活p21,引起细胞周期停滞,避免受损的DNA进行复制后在细胞内累积,而在DNA损伤较重时,活化的p53可直接诱导细胞凋亡[14-15]。研究发现[16],阿霉素可导致糖尿病性β细胞DNA损伤,γ-H2AX、53BP1及p21蛋白表达水平明显增加,而给予p21抑制剂后,细胞凋亡率明显增加。本研究结果显示,UVB辐照后,GC-1细胞p-p53蛋白表达水平2 h后开始上升,6 h后p21蛋白表达水平开始明显上升。其原因可能是UVB辐照GC-1细胞后细胞周期阻滞较滞后,而具体机制尚有待探究。D-Gal处理GC-1细胞不同时间后,p-p53蛋白表达水平在6 h达到高峰,p21蛋白表达水平在12 h达到高峰,24 h后p-p53、p21和γ-H2AX蛋白表达水平均接近正常对照组,此时8-OHdG表达量也相对较低,提示部分损伤的GC-1细胞可能已经被修复,而损伤较重的细胞则可能发生了凋亡。2.5、5、10 mg·L-1BLM处理GC-1细胞不同时间后,p-p53和p21蛋白表达水平均在2 h开始上升,趋势保持一致,其原因可能是BLM处理后,损伤细胞较多,p-p53直接激活p21,使细胞周期阻滞,为DNA损伤修复争取时间。25、50 mg·L-1BLM处理GC-1细胞不同时间后,p-p53和p21蛋白表达水平在2 h达到高峰,4 h后p-p53表达量开始下降,p21蛋白几乎无表达,其原因可能是高浓度BLM处理GC-1细胞4 h后,细胞DNA损伤较为严重而导致无法修复,p-p53直接诱导了细胞凋亡。
综上所述,因3种处理方式导致GC-1细胞DNA损伤机理不同,对GC-1细胞DNA损伤的程度也就存在差异,UVB辐照和BLM处理对GC-1细胞DNA损伤更重。此外,DNA损伤修复的机制亦存在一定的差异,UVB辐照和D-Gal处理后,GC-1细胞周期阻滞较滞后,而BLM处理后,GC-1细胞DNA损伤修复与周期阻滞同步进行。因此,在后续实验中,研究者可根据不同的实验目的来选择不同的DNA损伤模型。本研究旨在为后续在细胞水平上研究DNA损伤所致的男性不育及其分子机制奠定一定的实验基础,为后期研究男性不育的防治提供一定的实验依据。

