孤立性肠系膜上动脉夹层的治疗选择:单中心经验
李勇辉,彭新治,陈志波,沈润楠,黄楷*
孤立性肠系膜上动脉夹层(isolated superior mesenteric artery dissection,ISMAD)是指仅肠系膜上动脉受累而无主动脉病变的夹层[1]。“孤立性”用于区别主动脉夹层导致的孤立性肠系膜上动脉夹层。近年来,得益于影像技术的发展和广泛应用,尤其是计算机断层扫描血管造影(computed tomography angiography,CTA)的发展,越来越多的患者被诊断为ISMAD[2,3]。
ISMAD 是一类相对罕见的疾病。国外尸检的结果显示,ISMAD 的发病率约为0.09%[4]。ISMAD的治疗方式包括观察治疗,基于抗凝和禁食为基础的保守治疗,开放手术和腔内手术治疗[5]。然而,ISMAD 的最佳治疗方式仍未能确定。本研究拟通过总结我院治疗ISMAD 的病例,探讨ISMAD的治疗结果和处理经验。
1 研究对象与方法
1.1 病例收集
收集2014年4月至2020年6月期间中山大学孙逸仙纪念医院所有诊断为ISMAD 患者的临床资料和随访治疗,包括人口学资料、临床特征、影像学特征、治疗方式、治疗结果及随访结果。
1.2 诊断
所有ISMAD 均需要进过CTA 诊断。典型CTA征象为肠系膜上动脉可见撕裂的内膜片,肠系膜上动脉呈双腔样改变,而无主动脉夹层。
1.3 病变分型
根据Yun 分型[6]对ISMAD 的病变特征进行分型:Ⅰ型夹层:既有破裂入口和也有破裂出口,假腔内通畅,病变相对稳定;Ⅱ型夹层:既有破裂入口,而无出口,根据假腔内是否出现血栓可进一步分成Ⅱa 型和Ⅱb 型,病变不太稳定;Ⅲ型夹层:为肠系膜上动脉主干动脉闭塞,肠缺血坏死的风险较高。
1.4 治疗方案
观察治疗是指患者无需临床干预,但是需要观察有无腹痛表现,每半年到1年复查CTA,了解病变进展情况。保守治疗的方法包括了禁食、肠外营养支持、扩张血管等治疗。根据主管医师经验决定是否抗血小板或者抗凝治疗。在选用药物方面,住院期间的抗凝治疗选用用低分子肝素(每次量按100 U/kg 计算,频次为每12 小时注射1 次)。出院后抗凝选用利伐沙班(通常为每天口服10 mg)联合拜阿司匹林,或者联合使用波立维和拜阿司匹林双抗血小板治疗。
1.5 手术步骤
患者取平卧位,常规消毒双侧腹股沟及右上肢并进行铺巾。局部浸润麻醉成功后,Seldinger法穿刺右股动脉或者右肱动脉。导丝配合4F 或者5F 猪尾巴造影导管(Terumo,Japan),将导管尖端推送至第12 胸椎水平造影以明确主动脉是否有病变以及肠系膜上动脉开口。确定开口后,在数字减影血管造影(DSA)指引下,更换4F 或者5F Cobra 导管(Terumo,Japan),配合导丝超选进入肠系膜上动脉开口。再次于开口处造影,明确破口的位置、病变的范围、真腔情况及侧支循环情况。导管配合导丝继续推进以通过狭窄病变。成功跨过病变后,交换硬导丝,置入肾动脉指引导管。植入裸支架或者覆膜支架,以开通肠系膜上动脉的真腔。再次造影,明确真腔开通及侧支循环情况。撤除导丝、导管及鞘管。压迫穿刺止血,局部加压包扎。
1.6 随访时间及方法
患者于约定的时间(术后1月、3月、6月、1年及此后每年)到门诊随访。随访的内容包括询问患者症状、查体和必要时全腹部CTA 检查。如果患者无法到访,则考虑电话随访,随访的内容主要是询问患者症状及复查影像学结果。
1.7 统计学分析
在统计描述方面,针对连续性变量,符合正态分布者使用“均数±标准差”表示,不符合正态分布者使用“中位数(范围)”表示。分类变量则使用“例数(%)”表示。
2 结 果
该研究总共纳入29名患者,平均年龄为56.9±10.2岁。其中,28 名患者为男性,1 名患者为女性。因为ISMAD导致的腹痛而入院的患者有16人,另有14人因其他原因行CT 检查意外发现。20 名患者有吸烟史。16 名患者有高血压病史,2 名患者有糖尿病病史。
按照Yun 分型,分别有12 例Ⅰ型病变,8 例Ⅱa型病变,8 例Ⅱb 型病变以及1 例Ⅲ型病变。共有13 例(包括12 例I 型和1 例Ⅱb 型)接受观察治疗,5例(包括4例Ⅱa型和1例Ⅱb型)行保守治疗,11例(包括4 例Ⅱa 型、6 例Ⅱb 型和1 例Ⅲ型)行腔内治疗。病变类型与腹痛、治疗方式的关系见表1。接受保守治疗的患者中,4 例行拜阿司匹林+波立维双抗或者拜阿司匹林单抗治疗,1 例无抗凝或者抗血小板治疗。

表1 不同Yun分型ISMAD患者的腹痛情况及其治疗方式
接受腔内治疗患者中,有9 名患者植入支架。其中2 例于外院行支架植入,7 例于我院行支架植入。共植入支架12 枚,平均植入支架1.3 枚。在支架类型方面,1 名合并夹层动脉瘤的患者植入1 枚覆膜支架,其余支架均为金属裸支架。2 例患者在肠系膜病变远端形成血栓,遂行球囊扩张联合溶栓治疗。其中1例术中予200 000 U 尿激酶溶栓,另1 例术后放置导管溶栓,行300 000 U 尿激酶静脉持续泵入治疗,并于次日造影后拔除导管。
经过保守治疗或者腔内治疗,患者腹痛多在1 周内缓解。1 名Ⅲ型患者行腔内治疗后仍有明显腹痛,考虑有肠坏死,予以行剖腹探查+坏死肠管切除术。11 例行腔内治疗患者的情况见表2。
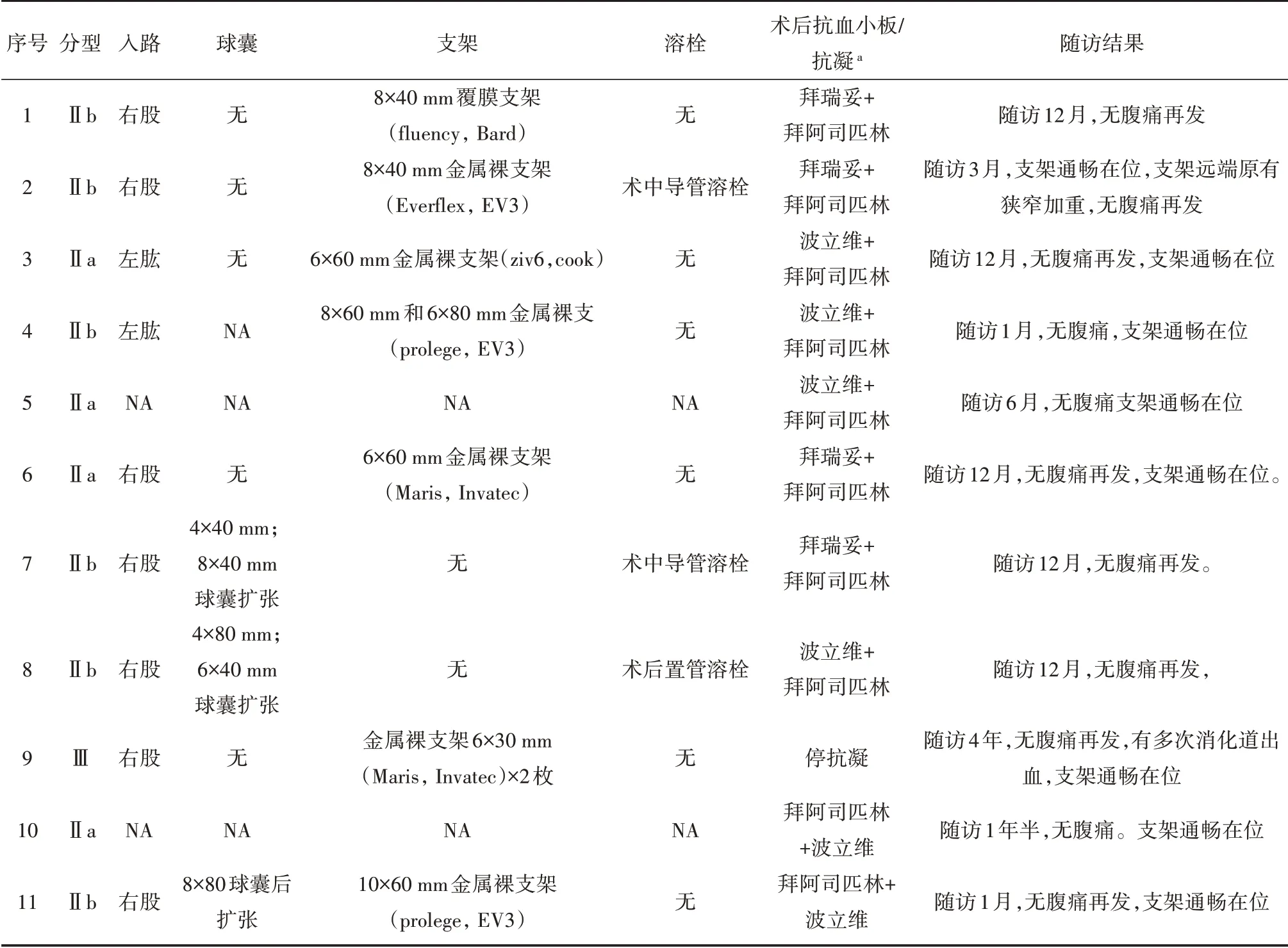
表2 11 例接受腔内治疗的术中情况及随访结果
中位随访12(1~48)月,4 名无症状患者失访。随访过程中,患者无腹痛发作或者腹痛复发的表现。9 例植入支架的患者中,CT 提示支架均通畅在位。1 名患者支架远端肠系膜上动脉原有的狭窄较前有所加重,而患者无肠缺血表现。另1名行腔内治疗并肠切除的患者(表2 的病例9),行双抗治疗过程中,反复出现黑便,予以停用抗血小板治疗。该患者随访4年,复查CT 提示支架通畅在位。未植入支架的患者中,1 例无症状患者CT提示真腔扩大,呈良性重构表现。1 名接受双抗血小板保守治疗的患者,随访过程中因“痔”停用抗血小板治疗。余患者病变未见明显进展。典型腔内治疗的病例见图1。
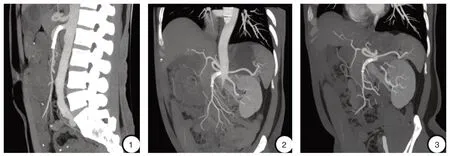
图1 植入支架后的随访资料 ①术后1月,CTA(矢状位)提示支架通畅在位;②术后3月,CTA(冠状位)提示支架通畅在位;③术后1年半,CTA(冠状位)提示支架通畅在位
3 讨 论
得益于CTA 的发展,越来越多的无症状ISMAD被诊断出来。此类无症状的患者,其肠系膜上动脉的狭窄程度相对较轻。在Yun 分型方面,这类患者的病变类型通常可分类为Ⅰ型[7]。本研究进一步证实,这些无症状的ISMAD,表现为更多的Ⅰ型病变。在随访过程中,无腹痛发作,影像学检查未见夹层范围扩大,体现了无症状ISMAD 较为良好的自然病程。因此,对于无症状的ISMAD 患者,观察治疗是合理的。
对于有症状的患者,有肠缺血的表现,往往提示肠系膜的狭窄程度较高。在Yun 分型方面,该类患者多归类为Ⅱ型。本研究结果证实,大多数症状性ISMAD患者为Ⅱ型病变。对于有症状的ISMAD,保守治疗是目前主流的治疗方式[8]。然而,对于该类患者,是否抗凝尚存在争议[9]。一方面,抗凝治疗有利于保留肠系膜上动脉的侧支循环,避免肠缺血表现加重。另一方面,抗凝影响假腔内血栓形成,使得夹层更不稳定,不利于ISMAD 的良性重构。本研究5 例患者接受保守治疗,不管是否行抗凝治疗,均可以获得类似的效果。近期一项荟萃分析的结果表明,抗凝治疗并不能改善ISMAD 患者的预后[10]。
在一项荟萃分析中,超过15%患者,通过标准的保守治疗,症状无法获得缓解[5]。此时,腔内治疗可能适用。除此之外,有学者提出,针对假腔内血栓形成,夹层瘤样扩张的病例,腔内治疗同样适用[11]。腔内治疗能够快速重建肠系膜的血供,从而快速缓解患者疼痛。本研究中,大多数病例在腔内治疗后腹痛症状获得缓解。表明腔内治疗快速恢复肠道供血的效果。而其相对早期的随访结果显示,腔内治疗术后无腹痛复发,具有较高的支架通畅率而无严重并发症出现。表明腔内治疗具有较好的安全性。
腔内治疗ISMAD,优选金属裸支架的原因在于覆膜支架不仅可能封堵肠系膜分支血管导致肠缺血坏死风险,而且通畅率相对较低。考虑肠蠕动可能增加支架移位风险,自膨支架可能更加适用[12]。覆膜支架仅考虑在合并瘤样扩张的病例。本研究中,也仅有1 例合并瘤样扩张者行覆膜支架植入。球囊和置管溶栓较少单独使用,球囊可能增加夹层逆撕的风险,溶栓可能增加夹层扩大的风险[13]。本研究接受球囊扩张的2 例患者,其病程均超过10 天,病变相对稳定,且术中使用的扩张的压力相对较低,并把握逐级扩张的原则。
开放手术治疗适用于并发腹膜炎的患者。在病变类型方面,Ⅲ型病变导致肠缺血坏死的风险最高[6]。对于此类病例的处理相对困难。本研究纳入Ⅲ型病变的病例,在腔内治疗开通肠系膜上动脉主干之后,其远端堵塞的分支血管无法处理。在进一步临床观察过程中,发现患者有腹膜炎表现,遂行坏死肠管的切除。开放手术应该作为保守治疗和腔内治疗有症状ISMAD 患者的补充。所有患者有肠坏死表现,均应及时行开放手术治疗。
本研究为回顾性分析,存在回顾性分析本身固有的缺陷。此外,本研究纳入的病例,相当一部分为无症状患者。有症状的ISMAD 患者中,大多选择了腔内治疗。随访时间较短,更长期的随访数据仍然较为缺乏。
4 结 论
观察治疗适用于大多数无症状的ISMAD 患者。保守治疗和腔内治疗可作为有症状性ISMAD治疗的主要治疗方式。开放手术治疗适用于出现肠坏死的患者。Yun 分型可指导ISMAD 患者的治疗选择。

