影响肥厚型心肌病患者血清CK-MB水平的危险因素分析
黄闯,王玺,卢文杰,邱春光
(郑州大学第一附属医院 心血管内科,河南 郑州 450052)
肥厚型心肌病(hypertrophic cardiomyopathy,HCM)为常染色体显性遗传病,人群中的发生率为1∶500[1-2],是青少年猝死的主要原因[3]。非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)反映机体脂质代谢紊乱状态[4],在人群中的发生率为40%,其中在患有NAFLD的人群中40%的为非肥胖患者[5]。有研究表明,在代谢紊乱人群中HCM的发病率高于正常人群,机体的代谢紊乱与心肌重构、心室肥厚相关[6]。另有研究表明,NAFLD为心血管疾病的危险因素[7]。但NAFLD和HCM之间的相关性研究较少,有动物实验表明HCM可以影响心肌对脂质的储存和利用,引起肝的脂质堆积,肝的脂质堆积又可引起肝脏合成葡萄糖,增加血糖水平,从而加重心肌细胞的损害,加快疾病进展[8]。肌酸激酶同工酶(creatine kinase MB,CK-MB)和心脏收缩舒张以及能量代谢有关,主要存在于心肌细胞细胞质中,细胞受损时释放入血。本研究旨在探讨影响HCM患者血清CK-MB水平的危险因素,并重点对合并NAFLD的HCM患者CK-MB水平进行分析。
1 资料和方法
1.1 研究对象选取2015年1月至2019年12月于郑州大学第一附属医院心内科就诊并行肝脏超声检查的138例具有完整血脂、糖化血红蛋白等检查资料的HCM患者作为研究对象。排除标准:(1)急性心肌梗死;(2)病毒性心肌炎;(3)严重的冠状动脉狭窄以及快速性室性心律失常;(4)严重的肝肾功能不全;(5)恶性肿瘤;(6)具有饮酒史,每周饮酒量大于140 g(女性>70 g);(7)酒精性肝硬化。患者对研究内容知情并签署同意书。本研究经郑州大学第一附属医院医学伦理委员会审批通过。HCM的诊断符合中国成人HCM诊断和治疗指南定义[9]。NAFLD的诊断根据肝脏超声检查特点进行判定[10]。
1.2 收集资料包括年龄、性别、吸烟史、高血压以及糖尿病病史,入院时的心脏以及肝脏超声检查结果,禁食8 h后于次日清晨抽取血液标本;收集化验结果包括CK-MB、肌钙蛋白(T/I)、总胆固醇、甘油三酯、低密度脂蛋白、高密度脂蛋白、糖化血红蛋白等;记录曲美他嗪、β受体阻滞剂、血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)/血管紧张素Ⅱ受体阻滞剂(angiotensinⅡreceptor blocker,ARB)、螺内酯、他汀药物的服药史。
1.3 分组方法对所有患者血清CK-MB水平的分析显示,其血清CK-MB水平的中位数为15 U·L-1,根据患者血清CK-MB水平,将CK-MB>15 U·L-1的患者纳入CK-MB(H)组(56例),将CK-MB≤15 U·L-1的患者纳入CK-MB(L)组(82例)[11]。

2 结果
2.1 基线资料CK-MB(H)组的糖化血红蛋白水平、梗阻型HCM占比、NAFLD患病率高于对照组,左心室直径小于对照组,差异有统计学意义(P<0.05)。两组余指标差异无统计学意义(P>0.05)。见表1。

表1 CK-MB(H)组和CK-MB(L)组临床资料比较
2.2 引起血清CK-MB水平升高的多因素logistic回归分析合并NAFLD、较高的糖化血红蛋白水平是CK-MB升高的危险因素(P<0.05)。较大的左心室直径是CK-MB升高的保护因素(P<0.05)。见表2。
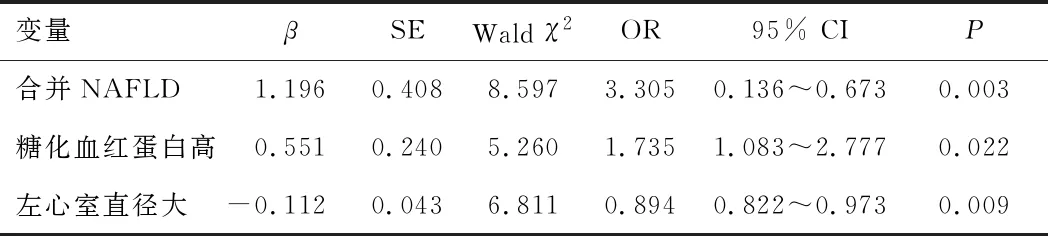
表2 HCM患者血清CK-MB升高的多因素logistic回归分析
3 讨论
HCM主要的组织病理学改变为左心室对称性或者不对称性肥厚、心肌细胞肥大、排列紊乱以及不同程度的纤维化[3]。研究表明,心肌纤维化的机制与心肌细胞的能量代谢障碍有关,心肌纤维化速度的加快可以引起心脏负性重构的进展,与心脏负性临床事件相关[12]。CK-MB与心肌细胞的收缩舒张以及能量代谢相关,主要存在于心肌细胞的细胞质内,心肌细胞受损时释放入血。Hamada等[11]通过对33例CK-MB水平较高组和44例CK-MB水平较低组20 a的随访观察发现,CK-MB水平较高组和CK-MB水平较低组相比,其心衰等不良事件的发生率显著增加,提示较高的血清CK-MB水平反映心肌细胞的持续损害,可能与心肌细胞的死亡、心肌纤维化以及左心室重构的加快相关,从而促进HCM病情进展,提升不良临床事件的发生率。通过研究引起CK-MB水平升高的危险因素并加以干预,对改善HCM患者的预后具有一定的意义。
NAFLD和机体的胰岛素抵抗相关,有研究表明,合并NAFLD可以增加对胰岛素受体的破坏速度,降低机体对胰岛素的敏感性[6,13]。胰岛素抵抗可以造成骨骼肌以及心肌等对葡萄糖的利用障碍[14],细胞转而利用脂肪酸,脂肪酸氧化产生大量的氧化自由基可能是心肌细胞受损的原因。相关动物实验也证实,HCM可以导致心肌对脂质的清除障碍,血脂水平的增加,同时造成肝脏合成葡萄糖增加[8]。有研究也表明血糖可以影响心肌微循环,较高的血糖水平可以造成心肌微循环障碍[15],进而加重心肌的损害。另外,NAFLD反映机体脂质代谢紊乱以及脂肪组织的长期慢性炎症,机体通过一些细胞因子的释放可以加快动脉粥样硬化的进展[16],可能通过造成心肌微循环障碍从而引起心肌细胞的损害[17]。综上,合并NAFLD可能通过以下途径影响HCM患者的血清CK-MB水平,增加HCM患者的心肌细胞损害程度:(1)NAFLD和胰岛素抵抗相关,通过影响血糖的水平加快对心肌微循环的损伤造成心肌微循环障碍,从而引起心肌细胞的损伤;(2)由于NAFLD患者机体对葡萄糖的利用障碍,大量的脂肪酸氧化分解产生大量的氧化自由基直接对心肌细胞造成损害;(3)NAFLD通过机体的炎症状态释放细胞因子,脂质代谢紊乱加快动脉粥样硬化进展速度,导致心肌微循环障碍,形成心肌细胞损伤。
本研究发现CK-MB(H)组左心室直径低于CK-MB(L)组,提示较高的CK-MB水平可能与心室壁厚度相关,较厚的心室壁厚度心肌微循环较差,心肌微循环障碍可以加快心肌细胞的受损[17]。本研究目前收集的患者心脏超声检查结果有不同的心室壁切面测量值,由于本研究为回顾性研究,无法保证不同患者测量时是相同的切面的心室厚度,而左心室直径统一是由左心室长轴切面基底段测得,因此,将左心室直径纳入研究观察对象,推测左心室直径小可能与左心室长轴切面基底段心室壁较厚有关。
本研究发现较高的糖化血红蛋白水平是引起CK-MB水平增加的危险因素。Wasserstrum等[18]指出合并DM的HCM患者具有较低的心功能等级,心脏舒张功能较差,心力衰竭等负性临床事件的发生率较高。糖化血红蛋白反映机体近期的总体血糖水平,其对血清CK-MB水平的影响可能与较高的血糖水平加快微血管受损引起心肌微循环障碍相关。
本研究具有一定的局限性:(1)本研究为回顾性研究,样本数量较少,需要大规模的多中心随机对照研究进行验证;(2)单次CK-MB测量可能存在测量误差;(3)本研究对非酒精性脂肪肝的诊断采取肝脏超声检查,可遗漏早期的肝脂肪变性,同时可能存在检查者的主观操作测量误差;(4)由于本研究为回顾性研究,无法保证超声测量室壁厚度位于相同的切面,未直接探究心室壁厚度对患者血清CK-MB水平的影响。
综上所述,NAFLD、较小的左心室直径以及较高的糖化血红蛋白水平与HCM患者较高的血清CK-MB水平相关,其可能增加心肌细胞的损害速度,对HCM患者生活方式的干预应纠正其体内的脂质代谢紊乱状态,同时对较高的血糖水平进行控制。

