植物乳杆菌FZU122产细菌素的分离鉴定及其抑菌活性
韩金志,姚思羽,沈 昊,孟晓洁,朱秋享,汪少芸
(福州大学生物科学与工程学院, 福建 福州 350108)
0 引言
乳酸菌已广泛应用于食品发酵与保鲜,大量研究表明,部分乳酸菌如植物乳杆菌、 棒状乳杆菌、 德氏乳杆菌等可产生胞外细菌素(抗菌肽)[1-4]. 目前,国内外关于Plantaricin、 Lactococcin、 Lactocin等乳酸菌源细菌素的分离纯化、 结构鉴定与抑菌活性等研究已有大量报道[5-6]. 乳酸菌细菌素因具有来源广、 抗菌活性强、 安全性高等特点,是一类具有广阔开发前景的绿色生物抗菌剂[2].
研究发现,大部分乳酸菌细菌素对革兰氏阳性菌(G+菌)具有抑菌活性,仅少数细菌素如Plantaricin MG、 Lactocin XN8-A等可抑制革兰氏阴性菌(G-菌)[5, 7]. 不同乳酸菌源细菌素的抑菌作用靶点和主要抗菌途径存在差异,对于G+菌主要通过破坏菌体细胞壁膜,使核酸、 蛋白质、 离子等细胞内容物泄漏或阻碍细胞壁合成等,导致细胞死亡. 如Lacticin Q可快速结合到菌体细胞膜外侧,并由细胞膜外侧向内侧迁移形成类似脂质触发器结构,在细胞膜上形成巨大环孔,导致胞内蛋白质泄露[8]. Lactococcin A等Ⅱa型细菌素可以与甘露糖磷酸转移酶系统结合,在细胞膜上形成孔洞,造成离子泄漏,最终导致细胞死亡[9-10]. Nisin通过与细胞壁主要组分肽聚糖合成中的重要中间物脂质Ⅱ结合从而抑制其生物合成; 此外,Nisin与脂质Ⅱ靶向结合,在细胞上膜形成孔洞,导致菌体溶解死亡[11-12]. 也有少数乳酸菌细菌素以菌体DNA、 生物被膜等为作用靶点,发挥抗菌作用. 如来源于干酪乳杆菌的细菌素F1可通过破坏菌体细胞膜并与DNA结合两种途径作用于金黄色葡萄球菌[13]. Lactocin AL705可作为群体感应抑制剂阻碍单增李斯特菌形成生物被膜从而发挥抑菌作用[14]. 目前,关于乳酸菌细菌素对G-菌抗菌作用途径研究的报道较少. 研究表明,此类细菌素主要通过破坏菌体细胞膜或干扰外膜正常生理功能等对G-菌发挥抑菌作用. 如Lactocin XN8-A主要以菌体的细胞壁膜为作用靶点,形成壁膜穿孔,对大肠杆菌发挥抑菌作用[6]. Plantaricin MG可消除鼠伤寒沙门氏菌细胞膜上的跨膜电位(ΔΨ)和pH梯度(ΔpH),并形成离子通道导致K+、 磷酸盐、 ATP以及紫外吸收物质等泄漏[15]. 当Nisin与EDTA联用时,EDTA螯合细胞外膜脂多糖中的Mg2+使脂多糖流失并导致细胞膜通透性增大,从而赋予Nisin对沙门氏菌等G-菌的抑菌作用[16].
目前,只有乳酸链球菌素(Nisin)和Pediocin PA-1两种乳酸菌源细菌素被批准可用作食品防腐剂,但在我国仅Nisin被允许应用于食品,而Nisin只对G+菌具有抑菌活性,限制了其在以G-菌为优势腐菌的食品保鲜中的应用. 本研究着重探讨从传统酸菜中筛选出一株产生细菌素且对G+菌与G-菌具有较强抑菌活性的植物乳酸菌,并对其发酵产生的植物乳杆菌素进行分离纯化、 结构鉴定及抑菌活性检测,可为从我国传统发酵食品中发掘乳酸菌细菌素提供参考.
1 材料与方法
1.1 试验材料
1.1.1材料
产自吉林省榆树市的传统发酵泡菜.
1.1.2试剂
LB肉汤培养基、 MRS肉汤培养基产自广东环凯生物科技有限公司; 乳酸菌鉴定生化管购自青岛海博生物技术有限公司; 氯化钠、 琼脂粉、 葡萄糖购自中国医药集团有限公司; 细菌DNA提取试剂盒购自美国Omega Bio-Tek公司; 乳酸钠链球菌素(Nisin)购自上海麦克林生化科技有限公司.
1.1.3菌种
本实验中所使用指示菌的名称、 编号、 培养条件以及来源等详细信息见表1.
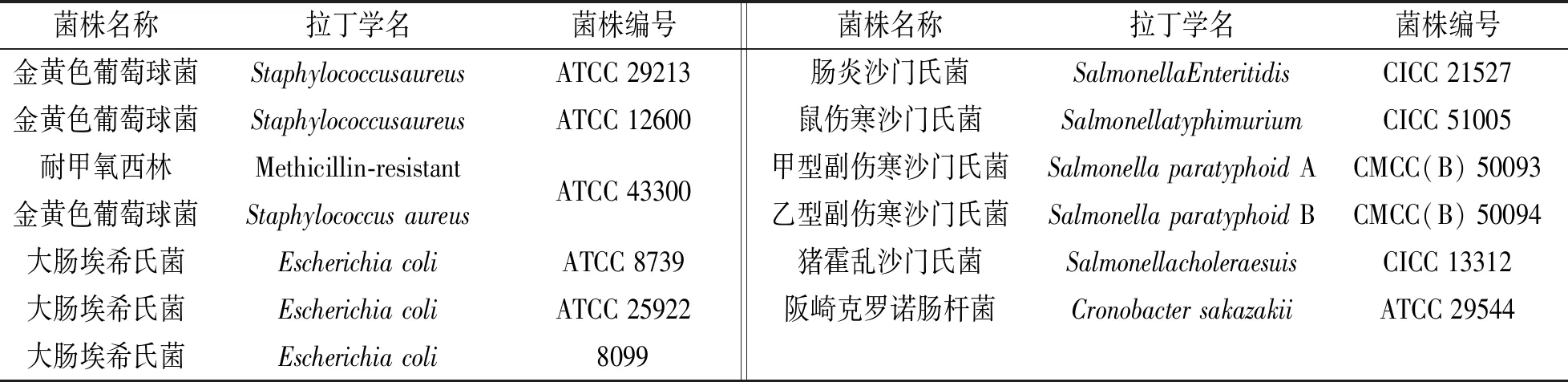
表1 指示菌信息
1.2 试验设备与仪器
本实验中所用到的主要仪器设备具体见表2.
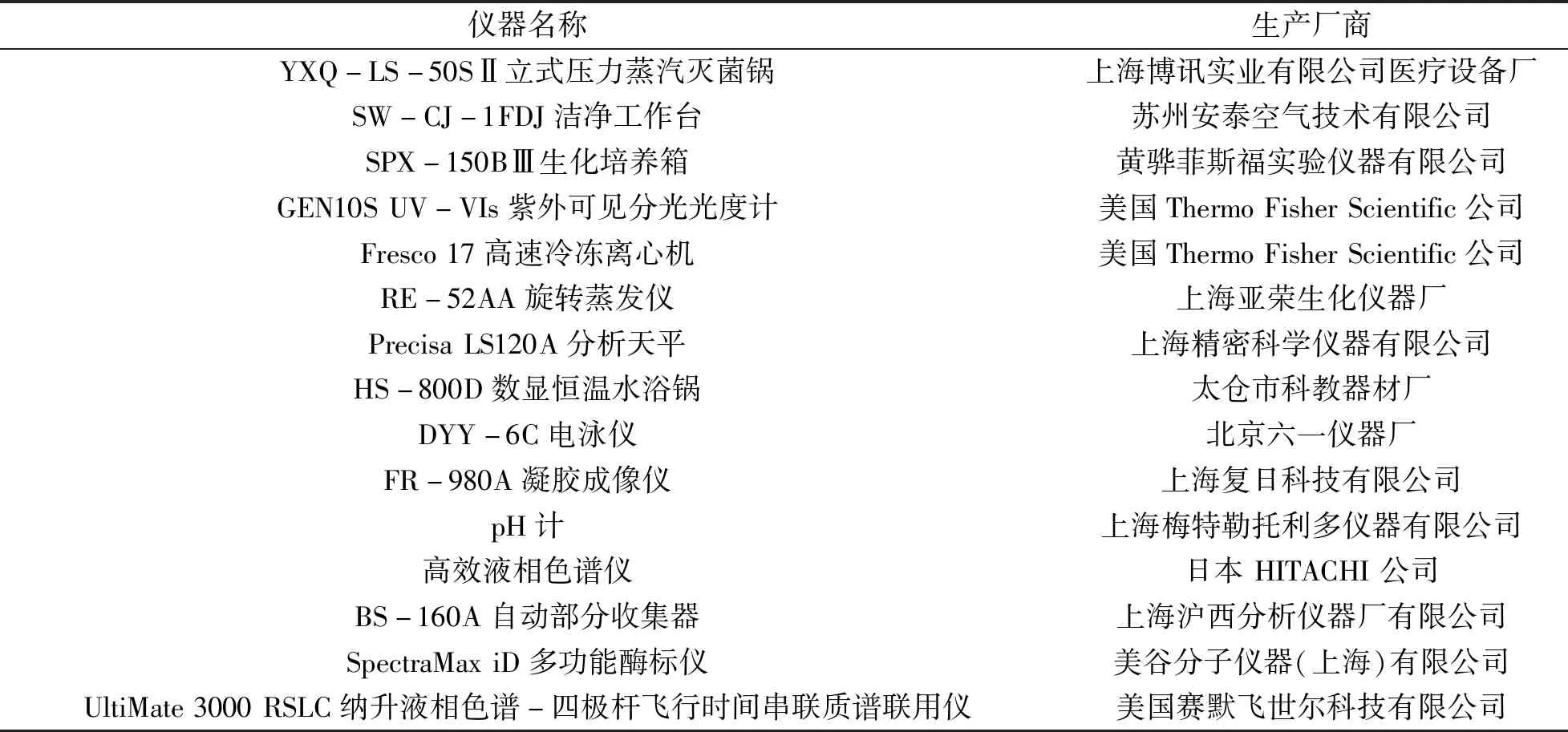
表2 主要仪器与设备
1.3 试验方法
1.3.1产抗菌物质乳酸菌的筛选
取10 g泡菜经破碎,加入无菌生理盐水梯度稀释后,涂布于MRS固体平板上,37 ℃条件下静置培养18 h. 挑取单菌落置于MRS液态培养基内,37 ℃条件下静置培养24 h,离心取上清,排除有机酸、 过氧化氢等物质干扰后,以金黄色葡萄球菌为指示菌通过测定抑菌圈,筛选产抑菌物质的菌株.
1.3.2主要生化反应鉴定
菌株划线接种于MRS琼脂平板,置于37 ℃恒温培养箱中培养48 h,用接种针挑取单菌落分别接种于七叶苷、 纤维二糖、 麦芽糖、 甘露醇等生化管中,用封口膜密封,37 ℃静置培养24 h.
1.3.3植物乳杆菌FZU122的16SrDNA测序分析
植物乳杆菌FZU122接种于MRS液体培养基,37 ℃条件下经活化、 转接培养至对数生长期. 取1~2 mL培养液9 600 r·min-1离心1 min,弃上清,菌体细胞使用细菌总DNA提取试剂盒,参照说明书提取利用总DNA. 采用16 S rDNA基因引物[F(5’- AGTTTGATCMTGGCTCAG-3’),R(5’-GGTTACCTTGTTACGACTT-3’)] 进行PCR扩增,取5 μL PCR产物以0.01 g·mL-1琼脂糖凝胶进行电泳.
1.3.4植物乳杆菌FZU122产抗菌物质抑菌谱检测
植物乳杆菌FZU122接种于MRS液体培养基,37 ℃条件下静置培养24 h,离心取上清,分别以耐甲氧西林金黄色葡萄球菌、 阪崎克罗诺肠杆菌、 鼠伤寒沙门氏菌等为指示菌,测定抑菌圈.
1.3.5醇沉水提法分离菌株FZU122发酵液细菌素
发酵液经9 600 r·min-1条件下4 ℃离心10 min,得到发酵液上清,然后用旋转蒸发仪在45 ℃条件下将其体积浓缩5~10倍. 在浓缩发酵液中加入95%无水乙醇,搅拌均匀,最终使无水乙醇的浓度为75%,于4 ℃静置醇沉12 h; 离心后弃去沉淀,保留上清,45 ℃条件下旋蒸浓缩3~5倍.
1.3.6SephadexLH-20凝胶层析分离FZU122细菌素
取50 g Sephadex LH-20干粉于65%(体积分数,以下同)乙醇中浸泡24 h,充分溶胀,装填入层析柱. 以超纯水(UP水)作为流动相,流速设定为0.5 mL·min-1,开启蠕动泵,平衡2~3个柱体积后,将流动相改为20%色谱级甲醇,将紫外检测器检测波长调节至280 nm,平衡至少2个柱体积至吸光值不变并调零. 样品稀释2倍,并过0.45 μm滤膜. 上样5 mL,用20%色谱级甲醇作为流动相,以0.2 mL·min-1等度洗脱,每管收集10 min,并检测各管洗脱液的抑菌活性.
1.3.7RP-HPLC分离纯化FZU122细菌素
将上述具有抑菌活性的组分,在50 ℃条件下旋蒸浓缩1倍左右,经0.22 μm滤头过滤. 流动相A设定为UP水,流动相B为色谱级甲醇. 梯度洗脱条件:0~30 min,甲醇5%~100%; 流速1 mL·min-1; 进样量20 μL,柱温为室温. 收集各个洗脱峰,浓缩后采用微量核酸蛋白测定仪测定多肽浓度,并以鼠伤寒沙门氏菌为指示菌,测定抑菌圈.
1.3.8Plantaricin-fzu122结构鉴定
收集抑菌活性物质送至上海交通大学分析测试中心,依据已报道的技术方法[17-18]采用纳升液相色谱-四极杆飞行时间串联质谱联用仪表征细菌素分子量、 氨基酸序列.
1.3.9Plantaricin-fzu122最小抑菌浓度测定
参考Han等[19]报道的方法测定Plantaricin-fzu 122对以上菌株的最小抑菌浓度(minimal inhibitory concentration, MIC). 指示菌株接种至LB液体培养基37 ℃、 180 r·min-1条件下培养至对数期,以新鲜的LB液体培养基将菌体细胞数值调至108(OD600=0.4~0.5),进一步稀释至105待用; 细菌素Plantaricin-fzu 122(纯度≥90%)经LB液体培养基稀释不同浓度后,以50 μL菌液和50 μL不同浓度抗菌肽溶液置于96孔板板孔内混合均匀,37 ℃条件下培养24 h,通过酶标仪测定菌液OD600值,以没有菌体生长所对应的细菌素浓度即为细菌素对于该菌株的MIC,同时以Nisin为阳性对照组.
2 结果与分析
2.1 产抗菌物质的乳酸菌筛选结果
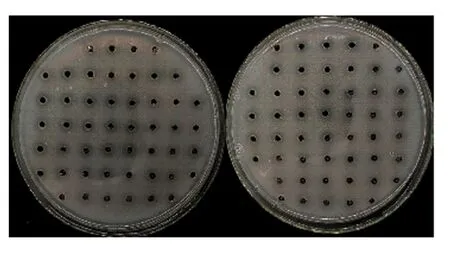
图1 琼脂扩散抑菌试验筛选结果 Fig.1 Results of antimicrobial test by well agar diffused method
以金黄色葡萄球菌为指示菌,经测定抑菌圈初步筛选得到98株产抑菌物质的菌株(见图1). 其中,62株菌的发酵液上清抑菌圈直径在8~10 mm之间,36株菌的发酵液上清抑菌圈直径均大于10 mm. 由发酵液上清抑菌圈直径均大于10 mm的菌株中选择其一进行后续研究,根据其初期编号将这株菌株命名为FZU122.
2.2 生物学鉴定结果
乳酸菌FZU122的生化检测结果如表3所示,株菌FZU122在所测试碳的水化合物中经发酵后均呈阳性,可初步判定菌株FZU122属于乳杆菌属.

表3 乳酸菌FZU122的生化检测结果
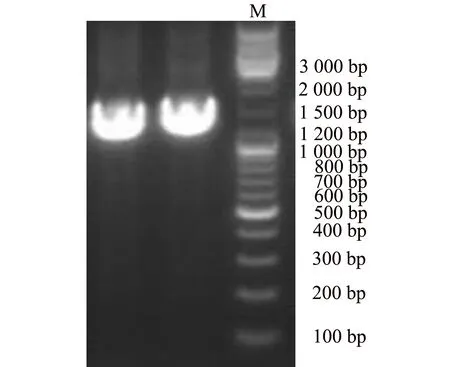
图2 乳酸菌FZU122总DNA的葡聚糖凝胶电泳图Fig.2 Sephadex gel electrophoresis of total DNA of Lactobacillus FZU122
菌株FZU122总DNA经16 S rDNA基因引物进行PCR扩增,取5 μL PCR产物进行0.01 g·mL-1琼脂糖凝胶电泳,电泳结果(见图2)显示PCR产物在1 500 bp处有一条明显条带.
菌株FZU122的PCR产物测序结果显示为一段由1 503 bp核苷酸组成的碱基序列. 经同源性比对,并采用MEGA X 10.1构建菌株FZU122的系统发育树(见图3),结果表明菌株FZU122经鉴定为一株植物乳杆菌(Lactobacillusplantarum),可命名为植物乳杆菌FZU122(L.plantarumFZU122).
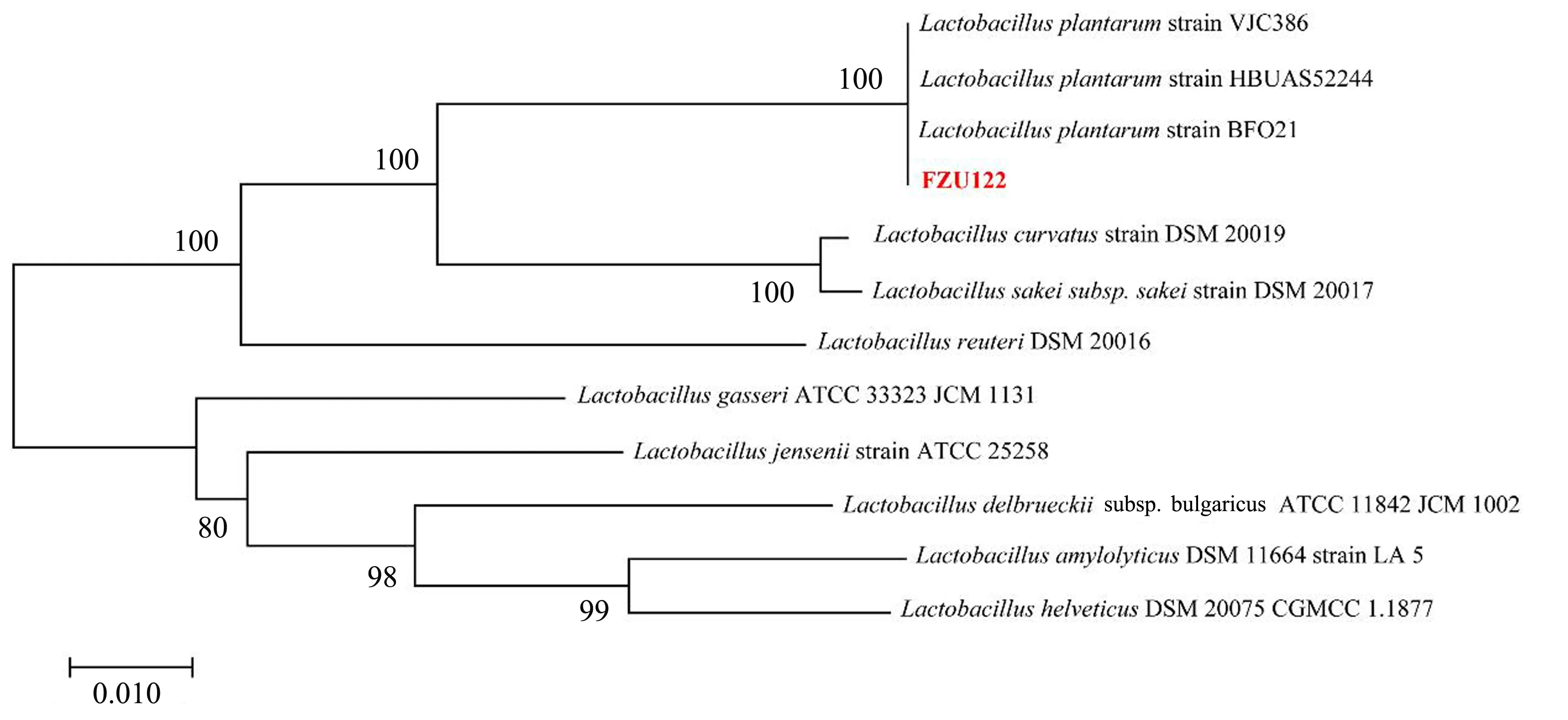
图3 乳酸菌FZU122系统发育进化树Fig.3 Phylogenetic tree derived from the 16S rDNA sequence of Lactobacillus plantarum FZU122
2.3 L. plantarum FZU122的发酵液上清抑菌谱

图4 L. plantarum FZU122发酵液上清的抑菌谱Fig.4 Antimicrobial spectrum of the fermentation supernatant of L. plantarum FZU122
L.plantarumFZU122的发酵液上清抑菌谱如图4所示,L.plantarumFZU122的发酵液上清对耐甲氧西林金黄色葡萄球菌、 猪霍乱沙门氏菌、 鼠伤寒沙门氏菌、 肠炎沙门氏菌、 阪崎克罗诺肠杆菌等食源性致病菌均具有抑菌活性. 这表明L.plantarumFZU122在发酵液中产生具有抑菌活性的物质.
2.4 Sephadex LH-20凝胶分离
L.plantarumFZU122发酵液粗提物经Sephadex LH-20凝胶色谱分离,各组分抑菌结果如图5所示. 由图5可见,第58管到第62管中的分离组分具有抑菌活性. 将抑菌活性较强的第60管分离组分合并收集,并采用旋转蒸发仪浓缩后置于4 ℃保存备用.
2.5 HPLC分析谱图及不同组分的抑菌活性
将上述经Sephadex LH-20凝胶柱分离的组分,采用反相HPLC进一步分离并获得不同组分的图谱. 收集不同保留时间的组分,经真空旋转蒸发仪干燥后采用UP水复溶,经抑菌试验结果显示,其中3号峰对应的分离组分对鼠伤寒沙门氏菌具有抑菌活性,如图6所示. 收集3号峰分离组分备用.
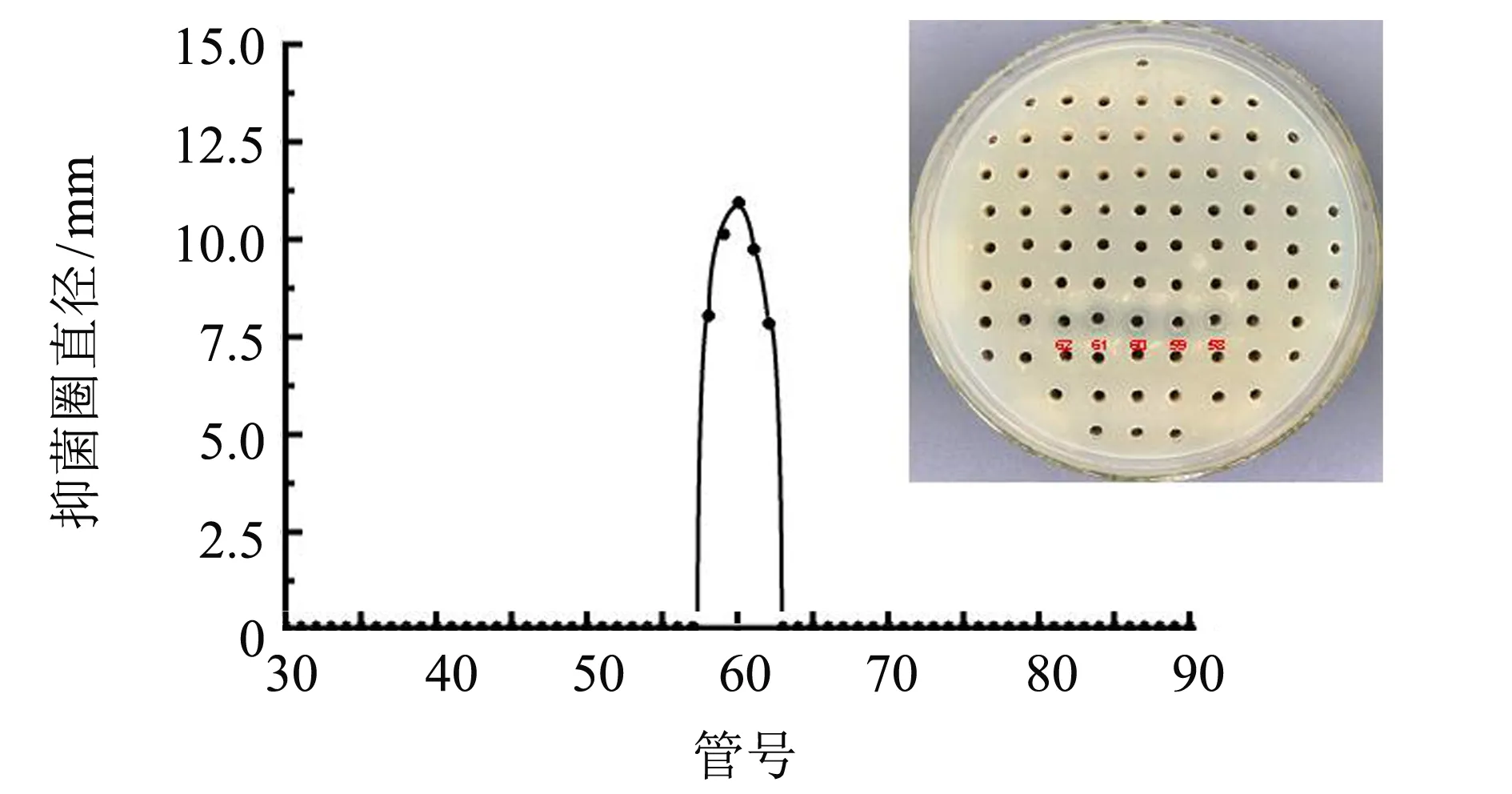
图5 发酵液粗提物经分离后各管分离液的抑菌圈Fig.5 Inhibition zones of the fractions in different tubes isolated from the fermentation supernatant

图6 粗提物经HPLC分析图谱及不同组分的抑菌活性Fig.6 HPLC analysis of the crude extract and the antibacterial activity of different fractions
2.6 细菌素Plantaricin-fzu 122的质谱分析结果
采用纳升液相色谱-质谱联用仪对上述3号峰分离组分进行质谱分析,结果如图7所示. 结果显示,鉴定到一条由10个氨基酸组成的多肽,其氨基酸序列为ARLGLPVHVV,相对分子质量为1 059.655 3,并带有2个正电荷,将其命名为Plantaricin-fzu 122.

图7 L. plantarum FZU122产细菌素Plantaricin-fzu 122的质谱分析结果Fig.7 QTrap LC-MS/MS of the fragment of Plantaricin-fzu 122 produced by L. plantarum FZU122
2.7 细菌素Plantaricin-fzu 122的最小抑菌浓度
最小抑菌浓度是常用于评估抗菌素抑菌活性的一项重要指标,列于表4. Plantaricin-fzu 122对12株指示菌均表现出不同程度的抑菌活性: 对鼠伤寒沙门氏菌的最小抑菌浓度为8 μg·mL-1,对于大肠埃希氏菌 ATCC25922、 甲型副伤寒沙门氏菌CMCC(B) 50093以及金黄色葡萄球菌ATCC 29213的最小抑菌浓度为32 μg·mL-1,对于其他指示菌的最小抑菌浓度则均为16 μg·mL-1. 其中,Plantaricin-fzu 122对金黄色葡萄球菌的MIC与Nisin相近,表明该细菌素对食品中常见致病菌均具有较强的抑菌活性.
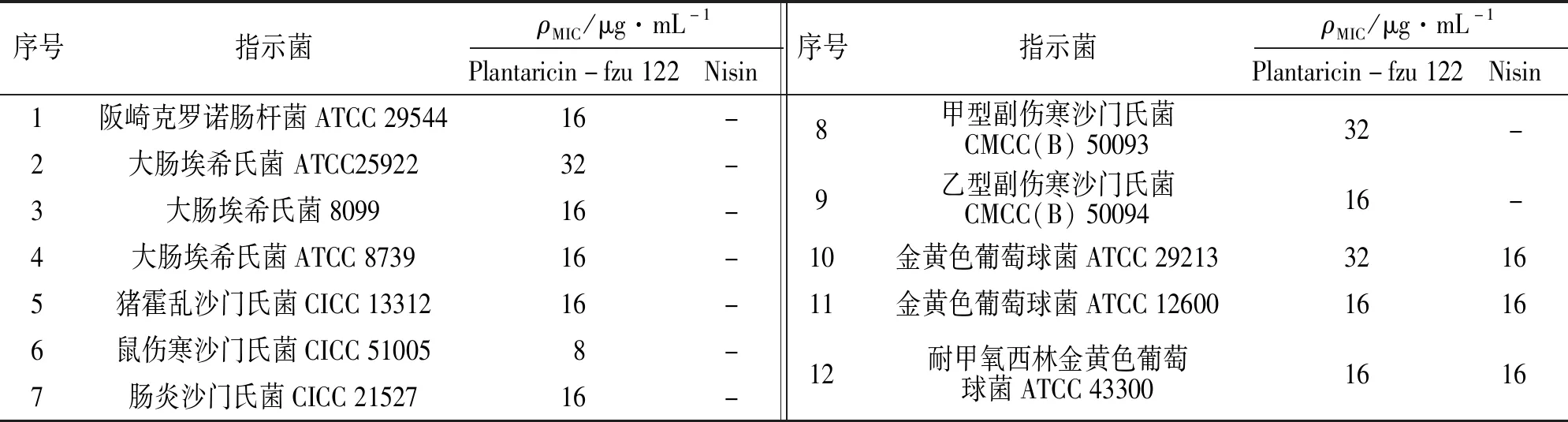
表4 Plantaricin-fzu 122的最小抑菌浓度
3 结语
微生物的污染繁殖与代谢活动是引起食品腐败变质与食源性疾病的最主要原因之一. 化学合成类食品防腐剂因存在食品安全风险,发掘、 绿色、 安全的乳酸菌源细菌素,用于食品防腐保鲜,控制食源性致病菌的滋生与污染,保障食品安全具有重要意义. Plantaricin-fzu 122是一种具有新氨基酸序列的植物乳杆菌素,绿色安全且抑菌谱广、 抗菌活性强,对大肠杆菌、 沙门氏菌以及金黄色葡萄球菌等多种食源性腐败与致病菌均具有良好的抑菌活性,是一类具有广阔开发潜力与应用前景的生物源食品防腐剂.

