吉林省鸡源携带多黏菌素耐药基因mcr-1大肠杆菌的流行病学调查
孙 赫,张桉潮,郭 越,黄 晨,张亚超,李 航,张 益,关松磊,张林波
(1.吉林农业大学生命科学学院,吉林 长春 130118 ; 2.辽源市经济技术合作局投资促进中心 , 吉林 辽源 136200;3.辽源市妇婴医院,吉林 辽源 136200)
多黏菌素是一种聚阳离子抗菌肽,被广泛用于治疗革兰阴性菌引起的全身感染,但是由于多黏菌素具有神经毒性和肾毒性等缺陷,从20世纪80年代开始,已经逐渐被低毒性的新型抗生素取代,只在畜牧养殖中用于预防和治疗畜禽胃肠道疾病。近年来,随着多重耐药革兰阴性菌的增多,尤其是耐碳青霉烯肠杆菌的出现,使人畜面临“无药可用”的威胁。多黏菌素作为抗击多重耐药革兰阴性菌感染的 “最后一道防线”显得尤为重要[1]。但是2015年,中国科学家首次报道了质粒介导的黏菌素耐药基因mcr-1(Mobile colistin resistance)[2],随后全世界40多个国家都出现了有关mcr-1的报道[3],mcr-1的广泛传播使人畜真正陷入了“无药可用”尴尬境地。目前为止,对于mcr-1阳性病原菌的一些流行病学特征还知之甚少,本文主要从吉林省范围内收集鉴定鸡源携带mcr-1耐药基因的大肠杆菌,重点分析mcr-1阳性大肠杆菌的流行特征,为今后深入开展耐黏菌素肠杆菌的耐药性、致病性等生物学研究提供参考资料。
1 材料与方法
1.1 菌株来源 从吉林省14个采集点的规模化养殖场采集鸡源肛门拭子样本273份,内脏样本124份,水样67份,土样54份,空气样本12份,通过分离纯化得到408株鸡源大肠杆菌。标准菌株ATCC25922,购自北京北纳创联生物技术研究院。本文中出现的菌株编号是根据采集地点自行编号,与菌株类型无关。
1.2 药物与试剂 多黏菌素B(Polymyxin B)、SanPrep柱式质粒DNA小量抽提试剂盒、柱式细菌基因组DNA抽提试剂盒、4S Green Plus核酸染料、DL-2 000 DNA Marker,均购自生工生物工程(上海)股份有限公司;LB肉汤、麦康凯琼脂、MH肉汤(MHB)、MH琼脂(MHA),均购自青岛海博生物公司;2×TaqMaster Mix,购自宝生物工程(大连)有限公司;Constar 96孔细胞培养板,购自北京思量长远生物科技有限公司。
1.3 方法
1.3.1 样本采集 鸡肛拭子的采集:使用无菌的棉拭子采集鸡泄殖腔周围粪便样本,并低温保存于含有LB肉汤培养基的15 mL离心管中。内脏样本采集:解剖后收集内脏低温保存于无菌采样袋中。空气样本采集:将密封麦康凯琼脂培养基打开,静置于室内10 min,密封后低温保存。水样采集:分别采集养殖场内鸡饮用水、水箱内水、人饮用水各10 mL于15 mL无菌离心管,密封后低温保存。土壤样本采集:分别收集养殖场内以及周围10 m、20 m、50 m处土壤,低温保存。
1.3.2 大肠杆菌的分离鉴定 采集的样本经过不同预处理后划线于麦康凯培养基,至于37 ℃恒温箱培养12~24 h。用无菌接菌环挑取砖红色、圆形凸起的单一菌落在麦康凯琼脂培养基上纯化培养。对纯化菌进行革兰染色并镜检。将挑取可疑菌落37 ℃过夜培养12~16 h,分别提取基因组DNA和质粒DNA待用。使用特异性大肠杆菌16S rDNA鉴定引物[4]进行大肠杆菌鉴定,并利用DNAMAN软件进行同源性比较。
1.3.3 耐多黏菌素大肠杆菌的筛选鉴定 将筛选出的大肠杆菌利用含有4 μg/mL 多黏菌素的麦康凯培养基37 ℃恒温培养14 h。筛选出耐多黏菌素大肠杆菌,使用mcr-1特异性引物进行鉴定[2]。并且按照2017年美国临床实验室标准化研究所(CLSI)推荐的微量肉汤稀释法检测细菌对多黏菌素的最低抑菌浓度(MIC)。以标准菌ATCC25922作为对照,多黏菌素浓度分别为256、128、64、32、16、8、4、2、1、0.5 μg/mL和0.25 μg/mL。每株菌设置3组重复,结果判读以小孔内完全抑制细菌生长的最低药物浓度为MIC。
1.3.4 质粒类型鉴定 使用 23种质粒类型的特异性引物进行鉴定[4-6],由生工生物工程(上海)股份有限公司合成。
1.3.5 药物敏感性及耐药基因检测 利用纸片扩散法测定mcr-1阳性大肠杆菌对氧氟沙星、阿米卡星、头孢他啶、亚胺培南、氟苯尼考、氯霉素、庆大霉素、阿莫西林、四环素、米诺环素、磷霉素、多西环素、环丙沙星、头孢噻肟共14种抗生素的敏感性,并以ATCC25922作为质控菌。依据CLSI发布的《抗微生物药物敏感性试验操作方法和判断标准》进行结果判定。采用PCR方法对质粒携带的多药耐药基因进行检测,具体包括:四环素类耐药基因(tetA、tetB、tetM)、磷霉素类耐药基因(fosA3)、喹诺酮类耐药基因(oqxA、oqxB、qnrA、qnrB、qepA)、广谱β-内酰胺类耐药基因(blaNDM、blaVIM、blaIMP、blaKPC、blaCTX-M-9G)进行检测。
2 结果
2.1mcr-1阳性大肠杆菌的鉴定 分离得到的406株大肠杆菌中22株mcr-1为阳性,阳性率为5.42%。其中从鸡源拭子样本分离到273株大肠杆菌,mcr-1阳性19株,阳性率6.96%;鸡舍内空气样本12个,阳性3个,阳性率25%;鸡舍周围土壤和水样本共计121个,均未检出阳性菌株。22株大肠杆菌对多黏菌素的MIC范围为1~16 μg/mL,其中16 μg/mL(14/22,63.64%)、8 μg/mL(2/22,9.09%)、4 μg/mL(1/22,4.55%)、2 μg/mL(3/22,13.64%)、1 μg/mL(2/22,9.09%)。见图1。
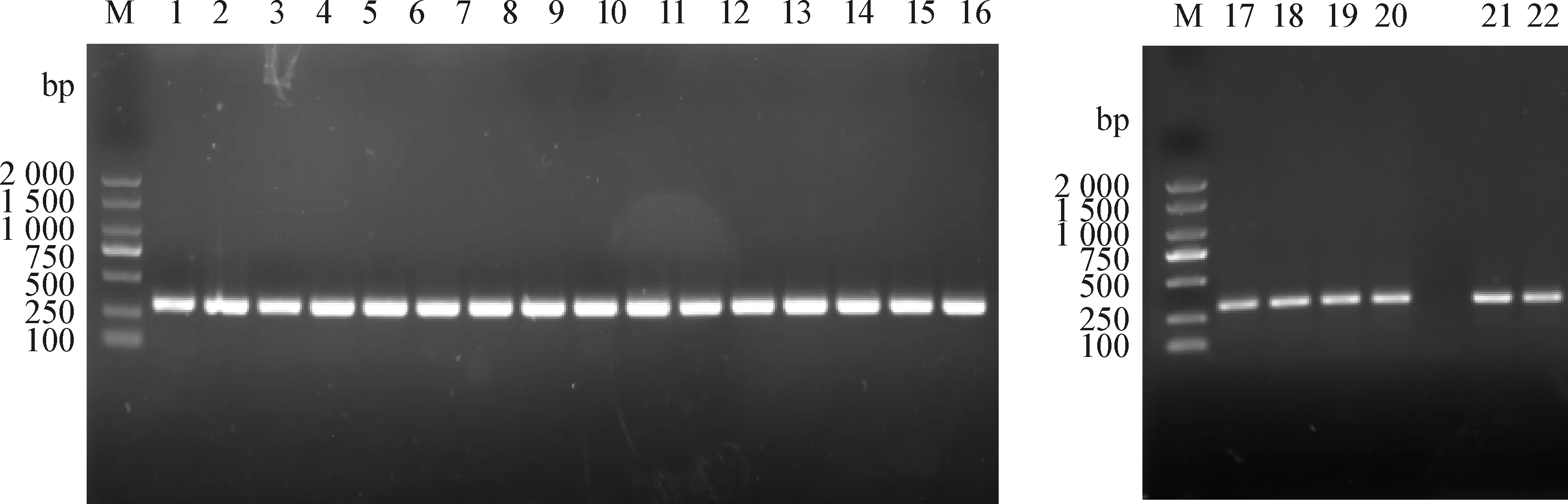
图1 多黏菌素耐药基因mcr-1电泳鉴定结果Fig.1 Electrophoretic identification of polymyxin resistance gene mcr-1M: BM2 000+ marker; 1: JZ10; 2: LT6; 3: XD1-2; 4: XD1-2; 5: LT5-2; 6: GZ15; 7: H4; 8: H3-2; 9: GZ2;10: GA3-2; 11: GA4; 12: ZLZ; 13: GA3-1; 14: ZL6-2; 15: ZL7; 16: ZL2; 17: XWJ9; 18: BCC1;19: QALAK1-2; 20: QAL1-1; 21: QALBK; 22: FTK
2.2 吉林省mcr-1阳性大肠杆菌的地区分布情况 在吉林省鸡主要养殖区内选择了14个采集点,分别位于吉林市龙潭区前阿拉、吉林市永吉县、榆树市弓棚镇、舒兰市溪河镇、蛟河市南大屯、长春市农安县、松原市长岭县、德惠市布海镇、德惠市后岫岩窝堡、扶余市新源镇、扶余市陶赖昭镇、大安市乐胜乡,其中8个采集点检测出mcr-1阳性大肠杆菌,其中长春市永吉县的阳性率最高。
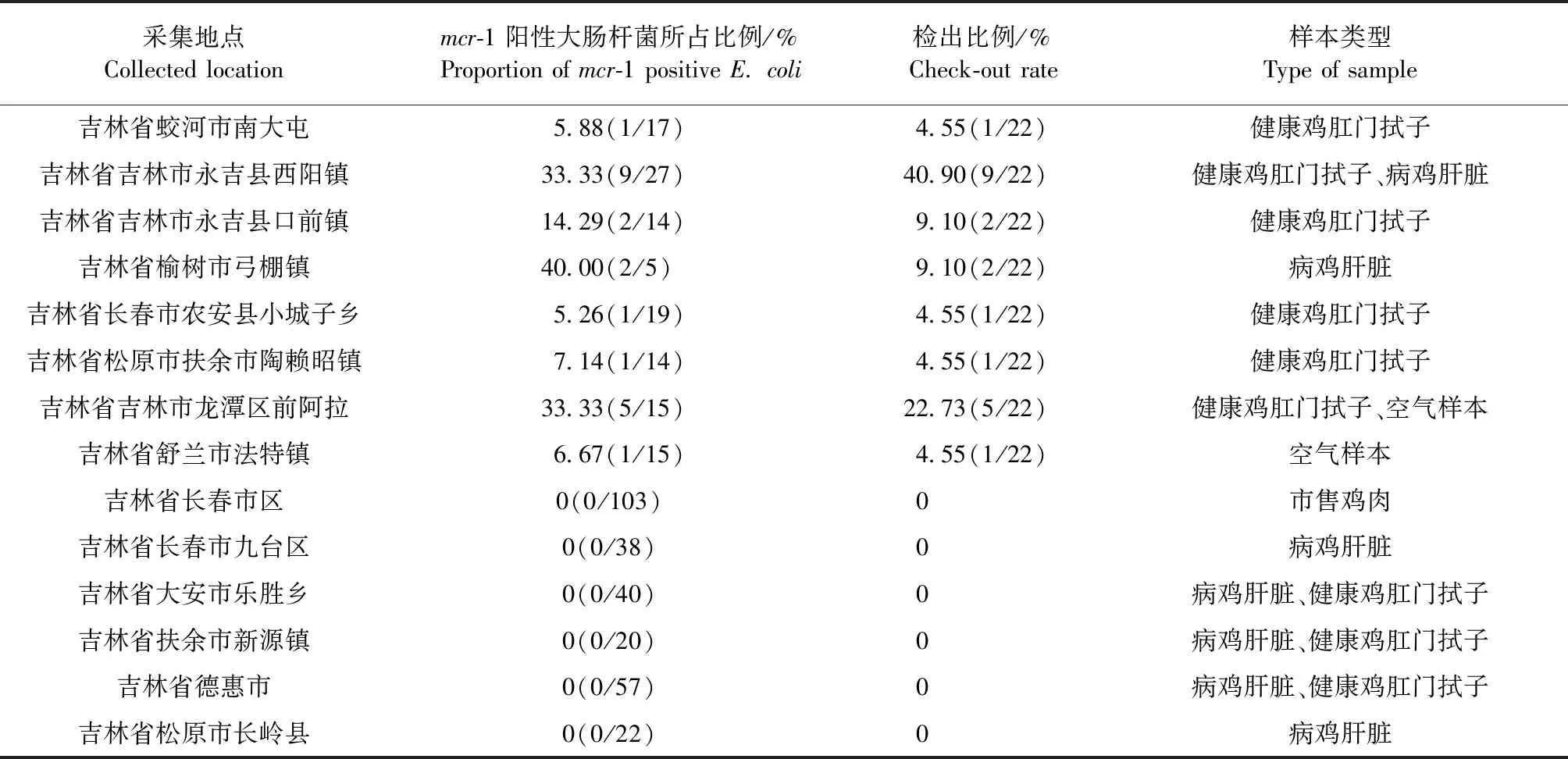
表1 吉林省mcr-1阳性大肠杆菌的地区分布情况
2.3 多重耐药分析
2.3.1 药物敏感性分析 22株mcr-1阳性大肠杆菌中,氯霉素、阿莫西林、四环素、头孢噻肟耐药率均为100.00%,氧氟沙星耐药率86.36%,阿米卡星耐药率40.91%,头孢他啶耐药率54.55%,亚胺培南耐药率18.18%,氟苯尼考耐药率95.45%,庆大霉素耐药率96.36%,磷霉素耐药率40.91%,多西环素耐药率90.90%,环丙沙星耐药率95.45%。见表2。
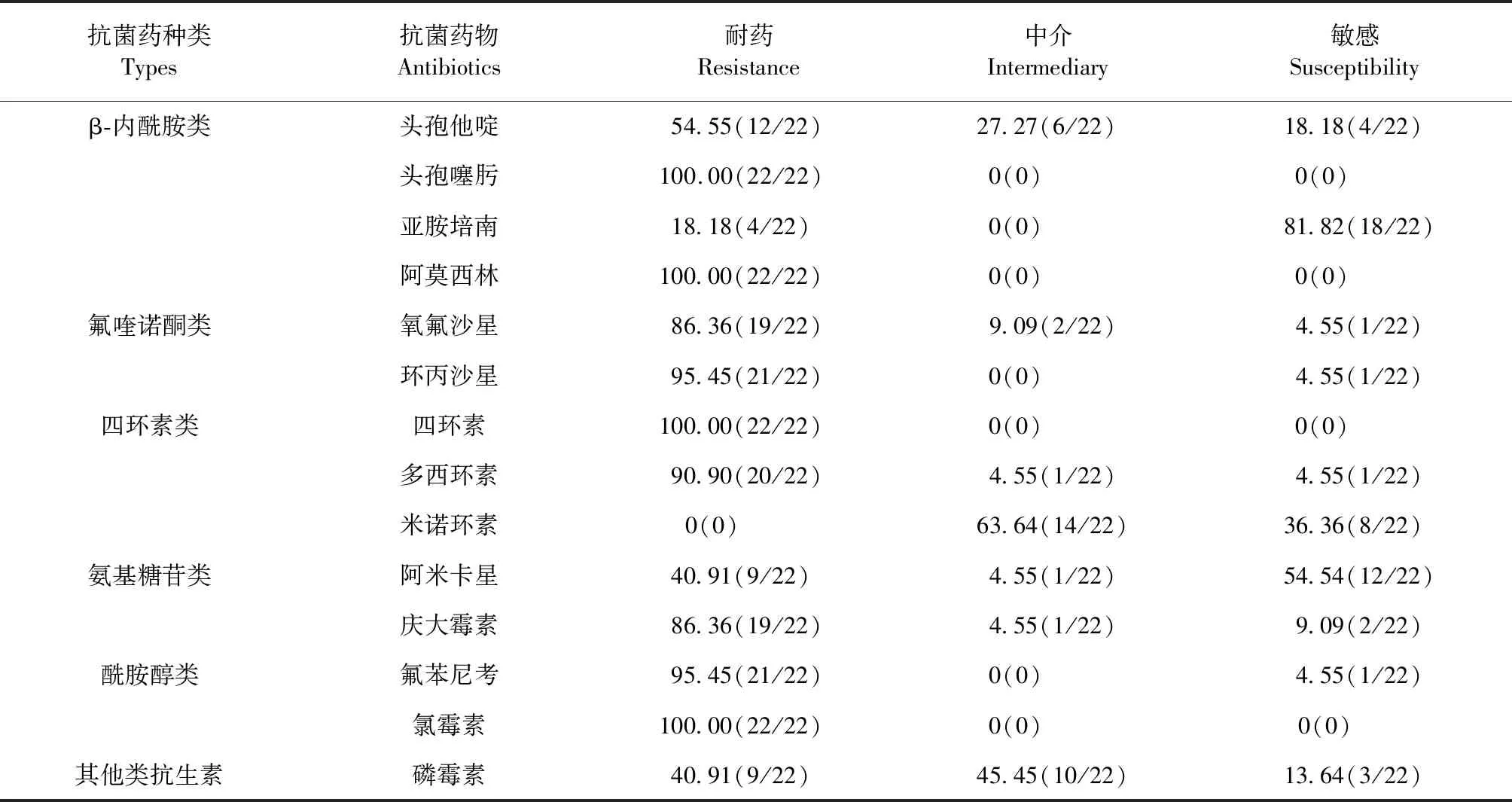
表2 22株mcr-1阳性大肠杆菌对 14种抗菌药物敏感性Table 2 Antibiotic susceptibility of 22 E.coli isolats with mcr-1 to 14 kinds of antibiotics (%)
2.3.2 多药耐药基因的检测 对相应的抗生素耐药基因进行检测发现,22株mcr-1阳性大肠杆菌,抗四环素类耐药基因tetA检出率最高,为100.00%;其次是抗氟喹诺酮类qnrA、qnrB、oqxA、oqxB、fosA3基因的检出率分别为63.64%、27.27%、54.55%、50%和63.64%;另外,有2株携带抗碳氢霉烯类抗生素的blaNDM基因,9株携带超广谱的β-内酰胺酶基因blaCTX-M-9G。见表3。
2.4 质粒类型鉴定mcr-1阳性大肠杆菌的质粒携带率为100%,从23种质粒中共鉴定出13种,分别为IncFIB、IncFIA、IncHI1、IncHI2、IncB、IncK、IncI2、IncN、IncY、IncI1、IncA/C、IncX3、IncX4。各种质粒的携带率分别为:IncHI1为4.55%(1/22),IncHI2为27.27%(6/22),IncX3为9.09%(2/22),IncX4为9.09%(2/22),IncFIA为9.09%(2/22),IncFIB为77.27%(17/22),IncY为58.33%(7/22),IncN为9.09%(2/22),IncA/C为4.55%(1/22),IncI1为22.73%(5/22)、IncK为27.27%(6/22)、IncB为13.64%(3/22),IncI2为81.82%(18/22)。见表3。
3 讨论
3.1mcr-1阳性大肠杆菌流行病学情况 本试验于2017年10月—2018年7月对吉林省14个地区的规模化养殖场采集了动物源样本以及环境样本,首先分离鉴定406株大肠杆菌,从中检测到22株mcr-1阳性大肠杆菌,鸡源mcr-1阳性检测率(5.42%),其中动物源样本mcr-1阳性菌检测的阳性率为8.65%,环境样本中水样和土样未检测到mcr-1阳性菌。虽然本试验中鸡源mcr-1阳性检测率低于Tong H等[7]报道的吉林省猪源mcr-1阳性检测率45%,但其通过直接提取猪粪便中的基因组DNA进行检测,经过培养并未分离出mcr-1阳性菌,且不能真实反映该地区养殖场中mcr-1阳性菌株的实际流行情况[8]。值得注意是,空气样本检测到了3株mcr-1阳性大肠杆菌,阳性率达到了25.00%,远远高于鸡源样本,mcr-1阳性菌可通过流动空气在养殖场内广泛传播。通过对本次试验采集的mcr-1阳性菌的采集地点进行了统计,吉林省永吉县的阳性检出率最高(50.00%),该地区的卫生防控压力较大,应当引起重视。

表3 22株mcr-1阳性大肠杆菌多药耐药基因及质粒类型
3.2mcr-1阳性大肠杆菌的多重耐药情况严重 从本试验所检出的mcr-1阳性率及耐药水平(MIC为1~16 μg/mL)来看,吉林省范围内的多黏菌素耐药尚处于中度水平,但是令人担忧的问题是本次检出的22株mcr-1阳性大肠杆菌均为多重耐药菌,且耐药谱较广。所有菌株对氯霉素、头孢噻肟、阿莫西林、四环素类抗生素的耐药率达到了100.00%,大多数菌株对氟喹诺酮类、β-内酰胺酶类抗生素耐药,有4株菌甚至对亚胺培南产生了耐药性。mcr-1常易与以下多种抗性基因共存介导多重耐药,如blacTX-M、blaTEM-1、blaNDM-5、blaNDM-1、aac(6′)-Ib、floR、fosA3、oqxAB等[9-10]。多重耐药基因的共传播大大增加了感染的危险性。本试验对mcr-1阳性菌的耐药基因检测发现,四环素类耐药基因tetA检出率最高(100%);此外,广谱的氟喹诺酮类抗生素的耐药基因检出率也较高,以oqxA、oqxB、qnrA为主。值得注意的是,有9株mcr-1阳性大肠杆菌携带超广谱β内酰胺酶blaCTX-M-9G,其中的2株mcr-1阳性菌(LT5-2和LT6)同时携带mcr-1、blaNDM和blaCTX-M-9G,这2株菌都是在同一地区的养殖场采集的健康鸡的肛门拭子分离得到的,这些多重耐药菌株一旦广泛传播,被感染的人畜将陷入“无药可用”的境地,必须引起足够的重视。
3.3 质粒类型的复杂性与多重耐药密切相关 本试验在22株mcr-1阳性大肠杆菌中共检测到13种类型质粒,其中IncI2和IncFIB阳性率较高,分别为81.82%和77.27%;IncK、IncY、IncI1、IncHI2阳性率稍低,分别为27.27%,58.33%,22.73%,27.27%;IncHI1、IncX3、IncX4、IncFIA、IncN、IncA/C、IncB阳性率最低,分别为4.55%,9.09%,9.09%,9.09%,9.09%,4.55%,13.64%。IncI2、IncHI2、IncX4是近年来报道较多的与mcr-1传播密切相关的质粒[11],IncI2和IncX4还与倍受关注的多种超广谱β-内酰胺酶及碳氢酶烯酶密切相关,如blaKPC[12],blaCTX-M[13-14],blaCMY-2[15]。IncY 质粒常携带广谱β-内酰胺酶基因blaCTX-M-15,有关于其携带mcr-1的报道较少,IncI1也常常被报道与广谱β-内酰胺酶的存在有关,并且可以与携带mcr-1的IncI2共同存在于同一株大肠杆菌中[16]。本试验中有5株mcr-1阳性菌中同时含有IncI1质粒,使菌株同时对喹诺酮类抗生素、β-内酰胺类抗生素和多黏菌素耐药,一旦感染将大大增加治疗的难度。
综上所述,吉林省鸡源大肠杆菌多重耐药情况严重,质粒类型和传播途径复杂,部分mcr-1阳性大肠杆菌对β-内酰胺类抗生素耐药,这些多黏菌素耐药菌的潜在危害性不容小觑。虽然我国已经在禽畜饲养过程中限制使用多黏菌素类抗菌药物,但是mcr-1的携带率仍然较高,这可能是由于以下原因造成:(1)在限制多黏菌素使用之前已经产生该药物的耐药菌;(2)环境中的多黏菌素耐药菌将mcr-1通过质粒转移给了养殖场中的敏感菌;(3)多黏菌素使用的监管不力,滥用情况严重。因此,应当在食源动物和人群中进行多黏菌素耐药筛查,并评估对人类健康的风险。除了加强临床监管与检测外,也同时应当重视畜牧养殖业的药物监管,定期监测,警惕多药耐药菌株的广泛传播。
——一道江苏高考题的奥秘解读和拓展

