1株牛源Mannheimia varigena的分离鉴定及病理组织学观察
ODAH Kokou Ayefounin,董文龙,ATIAH Luke Atiewin,刘 磊,王一鸣,贾博岩,孔令聪,高云航,马红霞
(吉林农业大学动物科学技术学院,吉林 长春 130118)
1999年,Angen等根据菌种的表型及其基因特性将溶血曼氏杆菌,Mannheimiaglucosida,Mannheimiaruminalis,Mannheimiagranulomatis,Mannheimiacaviae,Mannheimiavarigena共6种菌归类为新的曼氏杆菌属[1]。Mannheimiavarigena是存在于多种反刍动物的上呼吸道及肠道的正常菌群,当动物机体抵抗力低下时,也可引起牛的肺炎及乳腺炎等[2-3]。目前鲜有关于该菌致病性及耐药性的报道。本试验从吉林省某牛场病死牛的肺脏内分离到1株Mannheimiavarigena,为进一步了解这种病原特性,对其各种生物学特性、所导致的病理学变化及耐药表型进行初步研究,试验数据为该菌致病机制及耐药机制的深入研究提供科学依据,同时也为临床治疗该菌所引起的疾病提供参考。
1 材料与方法
1.1 病料来源 吉林省某牛场,1例病死牛,无菌采集肺脏送检,进行病原菌的实验室分离培养。
1.2 试剂及培养基 TSA固体培养基、TSB液体培养基,均购自青岛海博生物技术有限责任公司;氟苯尼考等10种抗生素标准品,均购自中国食品药品检定研究院。细菌基因组 DNA 快速抽提试剂盒,购自生工生物工程(上海)股份有限公司。10× Buffer、dNTP、ExTaqDNA聚合酶、切胶回收试剂盒、pMD18-T载体及E.coliDH5α感受态细胞,均购自宝生物工程(大连)有限公司。
1.3 细菌的分离与纯化 在采集的牛肺脏表面用剪刀烫出一处无菌表面,无菌手术刀沿着无菌面切入,用接种环伸入刀口沾取病灶黏液,接种于TSA平板(含5%胎牛血清)上,37 ℃需氧培养12 h后进行纯化培养,直至镜检细菌形态均一为止,将纯化获得的菌株命名为Mv-1。单一Mv-1菌落接种于TSB液体培养基(含5%胎牛血清)中增殖培养备用。
1.4 染色镜检 挑取平板上已纯化的单个菌落,生理盐水稀释,酒精灯火焰上加热固定,进行革兰染色,显微镜油镜下观察菌体形态。
1.5 生化试验 对分离纯化后的菌株进行木糖醇、甘露醇、吲哚等一系列生化试验,试验结果参照Boora等[4]所报道的试验结果进行比对分析。
1.6 动物致病性试验 在前期预试验的基础上,采用平板计数法将菌悬液浓度分别调节至2×109、2×108、 2×107、2×106CFU/mL和2×105CFU/mL。试验组中将5个不同稀释度菌悬液腹腔接种于健康昆明小鼠,0.15 mL/只;对照组腹腔接种无菌TSB液体培养基(含5%胎牛血清),0.15 mL/只,隔离饲喂。接种后每隔6 h观察1次小鼠临床表现,连续观察7 d。剖检死亡小鼠,观察各脏器的病变并分离脏器内细菌。根据每组小鼠死亡数量应用改良寇氏法计算出分离菌株的半数致死量(LD50)。
1.7 分离菌株16S rRNA PCR及序列测定 取1.5 mL增殖菌液12 000 r/min离心10 min,弃上清,保留菌体沉淀,按照细菌基因组 DNA 快速抽提试剂盒说明书提取DNA,作为16S rRNA PCR扩增模版。
参照Moreno等[5]报道由生物公司合成16S rRNA细菌鉴定通用引物。上游引物:5′-AGAGTTTGATCCTGGCTCAG-3′;下游引物:5′-GGTTACCTTGTTACGACTT-3′。按照反应体系进行16S rRNA PCR加样,总体系25 μL,其中DNA模板、上游与下游引物各加1 μL, 10×ExTaqBuffer和dNTP Mixture各加 2 μL,ExTaq0.3 μL,最后加16.7 μL ddH2O。16S rRNA基因扩增反应条件:94 ℃ 5 min;94 ℃ 1 min,50 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 延伸10 min,取PCR产物进行琼脂糖凝胶电泳检测。
根据胶回收试剂盒说明书指导方法,对目的条带切胶回收,与pMD18-T克隆载体16 ℃连接3 h,转入E.coliDH5α感受态细胞中,取100 μL均匀涂布于LB平板(含100 μg/mL氨苄青霉素)37 ℃培养12 h,挑取阳性菌落接种于LB液体培养基中(含100 μg/mL氨苄青霉素)37 ℃摇床增殖培养,参照质粒提取试剂盒说明书提取质粒,进行PCR检测。阳性克隆质粒送生工生物工程(长春)股份有限公司测序。登录GenBank数据库,将测序结果与已知的相关核酸序列进行Blast比对分析。
1.8 药敏试验 本试验选用氟苯尼考、强力霉素、环丙沙星、恩诺沙星、大观霉素、链霉素、新霉素、克林霉素、红霉素及头孢曲松临床常用的10种药物,采用平板稀释法对分离株Mv-1进行最低抑菌浓度(MIC)的测定。
1.9 病理组织学观察 将存在明显病理变化的肺脏组织浸泡于10%福尔马林溶液中进行固定,制作石蜡切片,采用苏木精-伊红染色法进行染色,显微镜下观察病理组织学变化。
2 结果
2.1 细菌的分离培养 病变肺脏采集细菌接种于TSA(含5%胎牛血清)平板,37 ℃需氧恒温培养12 h,纯化培养后菌落形态较均一,菌落表面光滑,呈圆形,略凸起(图1)。染色镜检为革兰阴性,形态均一的短杆菌(图2)。

图1 Mv-1菌落形态Fig.1 Colony morphology of Mv-1
图2 Mv-1革兰阴性染色结果Fig.2 Gram negative staining results of Mv-1
2.2 生理生化试验 记录生理生化试验结果,参照Boora等[4]所报道的试验结果进行比对分析,Mv-1生理生化特性与Mannheimiavarigena生理生化特性基本一致(表1)。

表1 Mv-1生理生化特性Table 1 The physiological and biochemical characteristics of Mv-1
2.3 动物致病性试验 试验组小鼠在注射病原菌24 h后,小鼠陆续出现病症,表现为精神沉郁、蜷缩成团、被毛凌乱,剖检死亡小鼠,肺脏病变明显,局部伴有坏死灶;心外膜有少量出血点;肠道未见明显病变。对照组小鼠健活,无任何异常。无菌采集病死小鼠的肺脏,分离培养肺脏中的细菌,纯化后镜检结果与供试菌株极为相似,对小鼠肺脏分离株进行16S rRNA基因测序,Blast比对分析,结果表明,试验组死亡小鼠肺脏中分离到细菌与供试菌株一致,证明分离菌株为一种致病菌。根据每组小鼠死亡数量,计算该菌株对小鼠的LD50为1×108CFU/只(表2)。

表2 Mv-1对小鼠的致病性Table 2 Pathogenictiy of Mv-1 in mice (只)
2.4 分离菌株16S rRNA PCR及测序 按照16S rRNA基因扩增反应体系及条件进行PCR扩增,16S rRNA PCR产物经琼脂糖凝胶电泳进行检测,成功扩增出1 500 bp左右的目的条带(图3)。测序结果在GenBank数据库中进行Blast分析比对,与已上传的Mannheimiavarigena(GenBank:CP006943.1)同源性为98%。
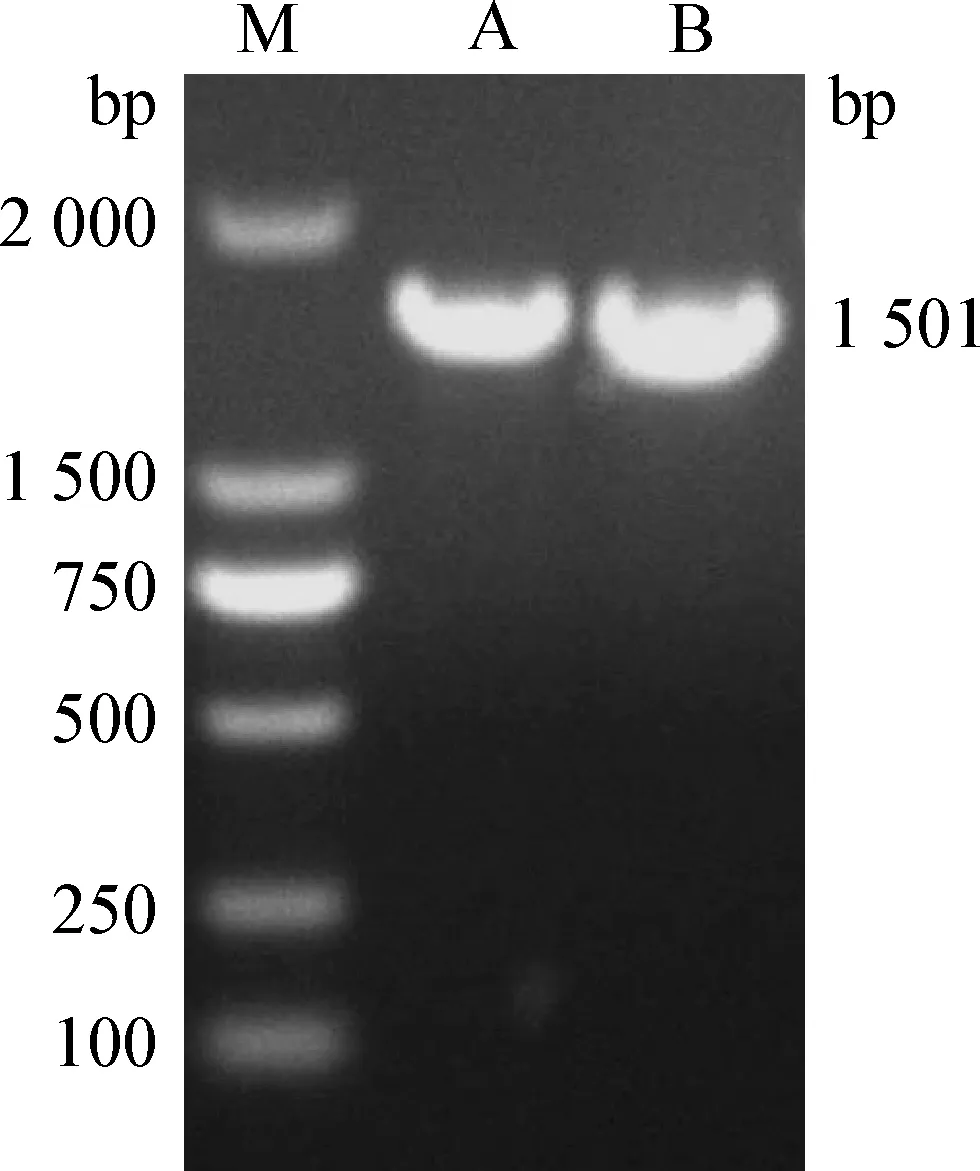
图3 16S rRNA PCR扩增结果Fig.3 Amplification results of 16S rRNA PCRM:DL-2 000 maker; A,B:Mv-1 16S rRNA PCR产物M:DL-2 000 maker; A,B:16S rRNA PCR production of Mv-1
2.5 药敏试验 分离菌株对氟苯尼考、克林霉素及头孢曲松敏感,对强力霉素、环丙沙星、恩诺沙星、大观霉素、链霉素、新霉素及红霉素耐药(表3)。

表3 分离株药敏试验Table 3 Durg sensitivity test results of isolates
2.6 病理组织学观察 取新鲜的病变肺脏组织,浸泡于10%福尔马林溶液中固定,制作石蜡切片,显微镜下观察病理组织学变化,可见大量中性炎性细胞(见封二彩版图4箭头A),肺泡壁毛细血管扩张充血,肺泡壁增宽(见封二彩版图5箭头B),呈支气管肺炎症状。

图4 病变牛肺脏 (100×)Fig.4 Diseased bovine lungs (100×)

图5 病变牛肺脏 (400×)Fig.5 Diseased bovine lungs(400×)
3 讨论
巴斯德菌科菌株能够引起多种重要经济动物的多样疾病,曼氏杆菌属作为巴斯德菌科的重要组成部分,关于曼氏杆菌属疾病的病例报告逐年增多。国内兽医临床上关于曼氏杆菌属的病例报告主要集中于溶血曼氏杆菌感染所引发的疾病,而关于Mannheimiavarigena的相关研究甚少。
牛呼吸道疾病综合征(Bovine respiratory disease complex,BRDC),由感染呼吸道的支原体、甲型流感病毒、牛巴氏杆菌、溶血曼氏杆菌、牛疱疹病毒I型等其中单独一种病原或者几种病原混合而引起,对养牛业的健康发展具有严重的危害[6-8]。本试验在死亡牛肺脏中分离到1株革兰阴性短杆菌,通过对分离菌株16S rRNA基因的序列测定并结合菌株的形态特征和生化特性综合分析后,鉴定分离菌株为Mannheimiavarigena。该菌能够引起反刍动物和猪的多种疾病,主要包括肺炎、乳腺炎、肠炎和败血症[9-10]。虽然鲜有关于Mannheimiavarigena引起牛呼吸道疾病的病例,但是不可忽视其在兽医临床上的潜在危害。小鼠致病性试验结果显示,Mv-1对小鼠有较强的致病性,但是关于Mannheimiavarigena毒力的研究尚未起步,其致病机制还有待进一步的研究。
抗生素的发现及应用造福于全人类,各种抗生素的出现大幅降低了细菌性疾病的发病率和死亡率。但是,抗生素在医疗、农业及食品等领域的不合理使用,导致细菌对抗生素产生的耐药水平也不断提高[11-12]。Mv-1的MIC药敏试验结果表明:其对四环素类、喹诺酮类、氨基糖苷类及大环内酯类抗生素具有较强耐药性,分离株表现为多重耐药可能与其携带的耐药性基因等其他耐药机制有关。Mv-1 对氟苯尼考、克林霉素及头孢曲松敏感,因此,临床可根据实际情况科学的选用敏感药物治疗该菌株引起的疾病。

