干酪乳杆菌对雏鸡盲肠上皮内淋巴细胞数量及炎性细胞因子表达的影响
王誉颖,韩德平 , 闫 雪 , 刘雪连,吴 栋 , 王 佳 , 马云飞
(1.中国农业大学动物医学院,北京 海淀 100193;2.北京大北农科技集团股份有限公司 饲用微生物工程国家重点实验室,北京 海淀 100192)
鸡白痢沙门菌是一种常见的肠道致病菌,在家禽之间广泛传播,严重影响家禽养殖业的发展,对人类健康也造成一定的威胁。沙门菌感染肠上皮细胞后,促使上皮细胞及穿插的淋巴细胞分泌趋化因子,趋化因子吸引炎性细胞聚集到感染部位,导致炎性细胞因子的释放,使炎症进一步加重[1]。益生菌对肠道黏膜具有保护作用,研究表明,益生菌能够有效促进消化道内的菌群平衡,拮抗致病菌,增强机体的免疫功能,提高畜禽生产性能和饲料的利用率等[2-4]。本实验室前期的研究表明[5],饲喂干酪乳杆菌能维护断奶仔猪肠黏膜结构,减轻大肠杆菌的侵害。另有研究表明[6],干酪乳杆菌能诱导肠道中T淋巴细胞的分化,调节细胞因子的表达,增强肠道黏膜免疫。雏鸡的盲肠具有肠绒毛,在组织结构上不同于其他动物。同时盲肠是大肠的起始端,在雏鸡肠道免疫中起重要的作用。肠绒毛的上皮内淋巴细胞数量一定程度上反映肠道对抗外来刺激能力[7]。本研究采用组织学及免疫学的方法,探究经口饲喂干酪乳杆菌对雏鸡盲肠上皮内淋巴细胞数量及炎性细胞因子表达的影响,旨为干酪乳杆菌作为一种预防雏鸡鸡白痢的新型饲料添加剂的应用提供理论依据。
1 材料与方法
1.1 试验设计及样品采集 干酪乳杆菌LactobacilluscaseiDBN023和鸡白痢沙门菌SalmonellapullorumCMCC-533分别作为益生菌和致病菌模式菌株。干酪乳杆菌由大北农饲用微生物国家重点实验室提供,通过发酵冻干,制成菌粉添加到基础日粮中,添加剂量为108CFU/g。鸡白痢沙门菌CMCC-533由中国医学微生物菌种保藏中心提供,在第7日龄,需要攻毒的4个组口腔灌服半致死剂量鸡白痢沙门菌,空白对照组和干酪乳杆菌组口服等量PBS 作为对照。选用450只1日龄SPF 健康雏鸡,随机分为6个处理组,每个处理5个重复,每个重复15只鸡,分组如下:(1)空白对照A组:饲喂无抗生素基础日粮,不进行沙门菌感染;(2)沙 门菌攻毒B组:饲喂无抗生素基础日粮,进行沙门菌感染;(3)干酪乳杆菌C组:饲喂添加干酪乳杆菌的无抗生素基础日粮,添加剂量为108CFU/g, 不进行沙门菌感染;(4)预防D组:前期饲喂添加植物乳杆菌的无抗生素基础日粮,添加剂量为108CFU/g,进行沙门菌感染后,饲喂无抗生素基础日粮;(5)治疗E组:前期饲喂无抗生素基础日粮,进行沙门菌感染后,饲喂添加干酪乳杆菌的基础日粮,添加剂量为108CFU/g;(6)预防治疗F组:全期饲喂添加干酪乳杆菌的无抗生素基础日粮,添加剂量均为108CFU/g,并进行沙门菌感染。在28日龄时,每组每个重复随机选取1只雏鸡,颈动脉放血致死,剖开腹腔,取2段盲肠中段2 cm 肠段,用PBS冲洗以除去肠内容物。一段在4%多聚甲醛中固定48 h,期间换1次固定液,用于苏木精和伊红(H.E.)染色;另一段放入装有RNA store[DP408,天根生化科技(北京)有限公司]液体的小管里,置于-80 ℃冰箱保存,用于进一步分析细胞因子水平。
1.2 石蜡切片的制作及H.E.染色 将固定好的组织块进行常规脱水、透明、浸蜡和石蜡包埋,准备4 μm厚的连续切片。切片常规脱蜡,苏木精染色15 min,1%盐酸-酒精溶液分色后,自来水蓝化15 min; 常规脱水,二甲苯透明,中性树胶封片。Nikon Ni-U显微镜观察。
1.3 肠道细胞因子水平的测定 取出置于-80 ℃冰箱保存的盲肠肠段,根据制造商的协议使用鸡ELISA测定试剂盒(上海江莱生物科技有限公司)测定盲肠中的细胞因子水平。肠道中的细胞因子分别使用鸡白细胞介素-4(IL-4)ELISA检测试剂盒、鸡白细胞介素-10(IL-10)ELISA检测试剂盒、鸡白细胞介素-17(IL-17)ELISA检测试剂盒和鸡肿瘤坏死因子-α(TNF-α)ELISA测定试剂盒进行测定。在450 nm波长依序测量各孔的吸光度(OD值),根据标准曲线计算样品浓度。
1.4 数据统计及分析 利用IPP 6.0软件统计每100个柱状上皮细胞间的淋巴细胞数量。采用SPSS 17.0 One-Way ANOVA模板进行统计分析,结果用“平均数±标准误(Mean±SEM)”表示。P<0.05表示有统计学意义。
2 结果
2.1 不同处理后雏鸡盲肠黏膜组织形态的变化 空白对照组的绒毛结构完整,肠绒毛黏膜固有层无炎性细胞和红细胞浸润(见封二彩版图1A);沙门菌攻毒组绒毛黏膜固有层有炎性细胞和红细胞浸润(见封二彩版图1B);其他组与空白对照组相似,肠绒毛结构较完整,无明显病理变化(见封二彩版图1C,1D,1E,1F)。表明干酪乳杆菌可以维持盲肠正常的黏膜组织形态,缓解沙门菌的损害作用。

图1 干酪乳杆菌对雏鸡盲肠黏膜组织形态的影响Fig. 1 Effect of Lactobacillus casei on the morphology of chickling caecum mucosaA:空白对照组; B:沙门菌攻毒组; C:干酪乳杆菌组; D:预防组; E:治疗组; F:预防治疗组A:Blank control group; B:Salmonella challenge group; C:Lactobacillus casei group;D:Prevention group; E:Treatment group; F:Preventive plus treatment group
2.2 不同处理后雏鸡盲肠上皮内淋巴细胞数量的变化 与空白对照组相比,沙门菌攻毒组盲肠上皮内淋巴细胞的数量显著降低了30.31%(P=0.020);与沙门菌攻毒组相比,预防治疗组盲肠上皮内淋巴细胞的数量增加了42.11%,差异显著(P=0.027)。表明干酪乳杆菌可以增加盲肠上皮内淋巴细胞数量,增强肠道免疫功能。见图2。
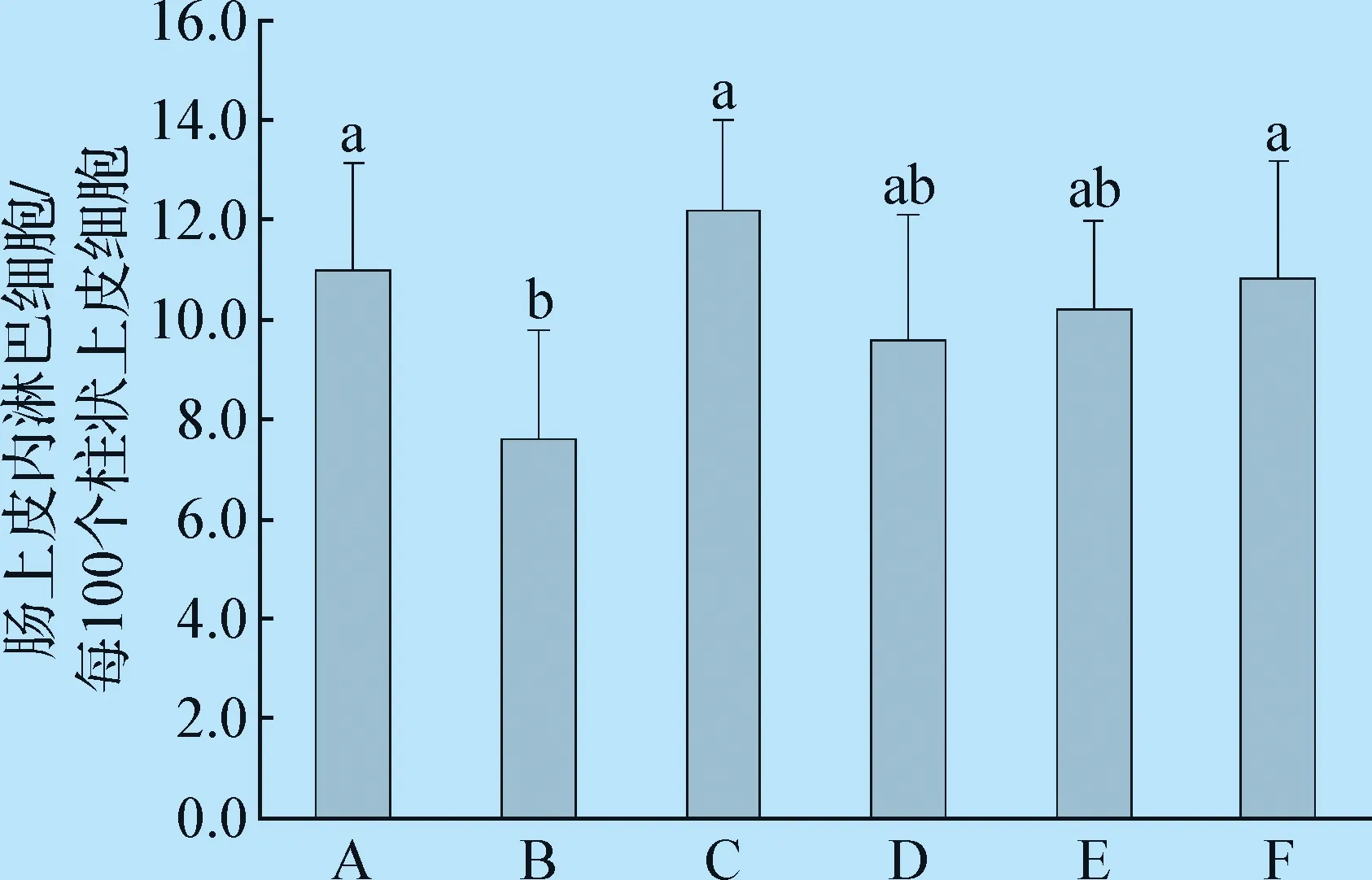
图2 干酪乳杆菌对雏鸡盲肠上皮内淋巴细胞数量的影响Fig. 2 Effects of Lactobacillus casei on the number of lymphocytes in the cecum of chicksA:空白对照组; B:沙门菌攻毒组; C:干酪乳杆菌组;D:预防组; E:治疗组; F:预防治疗组注:柱上不同字母表示组间差异显著(P<0.05);下图同A:Blank control group; B:Salmonella challenge group;C:Lactobacillus casei group; D:Prevention group;E:Treatment group; F:Preventive plus treatment groupNote: Different letters on the column indicate significant differences between groups (P<0.05).The same as below
2.3 不同处理后雏鸡盲肠抗炎性因子表达量的变化 与空白对照组相比,沙门菌攻毒组的表达量下降了42.39%,差异极显著(P=0.000);与沙门菌攻毒组相比,预防组、治疗组、预防治疗组IL-4的表达量分别增加了33.11%、57.23%、64.35%,差异极显著(P=0.000,P=0.000,P=0.000)。与空白对照组相比,沙门氏菌攻毒组IL-10的表达量下降了44.67%,差异极显著(P=0.000);与沙门菌攻毒组相比,预防组、治疗组、预防治疗组IL-10的表达量分别增加了49.09%、85.02%、102.7%,差异极显著(P=0.001,P=0.000,P=0.000)。表明干酪乳杆菌促进抗炎性因子的表达,增强肠道的抗炎能力。见图3。
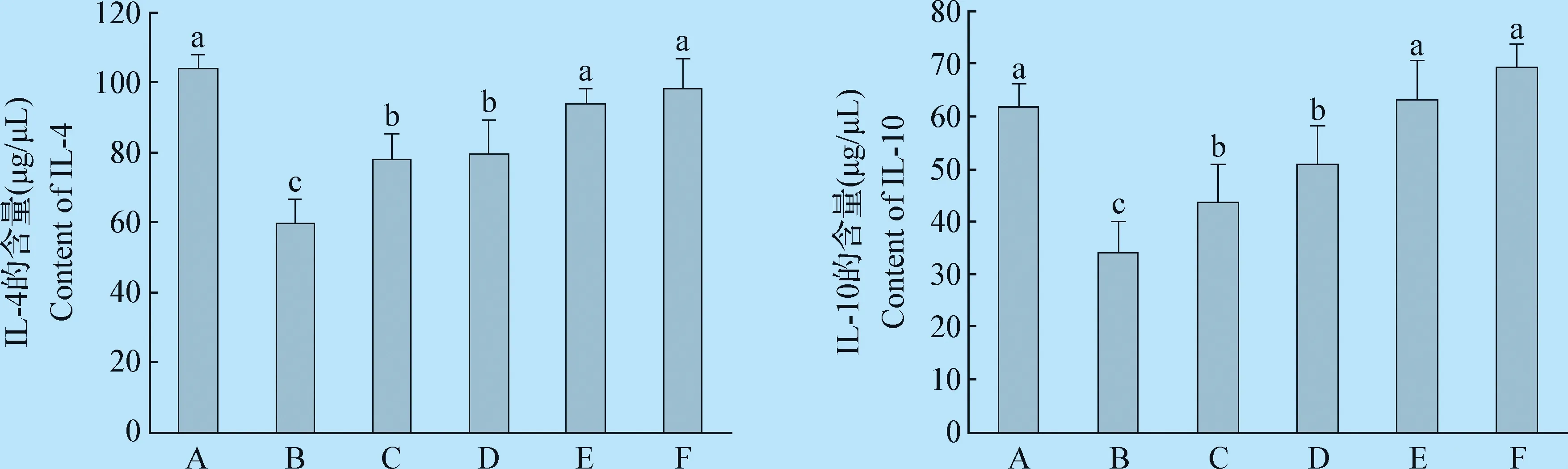
图3 干酪乳杆菌对雏鸡盲肠抗炎性因子表达的影响Fig. 3 Effects of Lactobacillus casei on the expression of anti-inflammatory factors in the cecum of chicksA:空白对照组; B:沙门菌攻毒组; C:干酪乳杆菌组; D:预防组; E:治疗组; F:预防治疗组A:Blank control group; B:Salmonella challenge group; C:Lactobacillus casei group;D:Prevention group; E:Treatment group; F:Preventive plus treatment group
2.4 不同处理后雏鸡盲肠致炎性因子表达量的变化 与空白对照组相比,沙门菌攻毒组IL-17的表达量增加了53.47%,差异极显著(P=0.000);与沙门菌攻毒组相比,预防组、治疗组、预防治疗组IL-17的表达量分别下降了18.71%、25.21%、43.57%,差异极显著(P=0.001,P=0.002,P=0.000)。与空白对照组相比,沙门菌攻毒组TNF-α的表达量分别增加了67.29%,差异极显著(P=0.000);与沙门菌攻毒组相比,预防组、治疗组、预防治疗组TNF-α的表达量分别下降了23,34%、22.17%、40.29%,差异极显著(P=0.000,P=0.000,P=0.000)。表明干酪乳杆菌抑制致炎性因子的表达,避免过度的炎症反应。见图4。
3 讨论
3.1 干酪乳杆菌对雏鸡盲肠黏膜组织形态的影响 肠黏膜屏障能够防止肠内的有害物质如细菌和毒素的侵入,完整的肠黏膜上皮细胞是肠道黏膜屏障的结构基础,肠黏膜上皮细胞的受损可能导致肠道黏膜屏障的损害[8]。肉鸡补充益生菌,其绒毛高度增加,促进肠上皮细胞的更新[9]。本研究结果显示,在沙门菌攻毒后肠上皮细胞排列紊乱、脱落,而饲喂干酪乳杆菌进行预防或治疗的雏鸡盲肠上皮细胞可以保持相对完整,说明干酪乳杆菌能有效抵御沙门菌对肠道黏膜组织结构的破坏,维护肠道黏膜屏障的完整性。
3.2 干酪乳杆菌对雏鸡盲肠上皮内淋巴细胞数量的影响 肠上皮内淋巴细胞(IEL)是大量且多样化的淋巴样细胞群,其位于形成肠黏膜屏障的肠上皮细胞之间。IEL子集彼此之间以及与上皮外的免疫细胞相互通信,可促进其屏障功能[10]。肠绒毛的上皮内淋巴细胞数量在一定程度上反映肠道对抗外来刺激能力[7]。本研究结果中,沙门菌攻毒组上皮内淋巴细胞数量显著下降,显示肠道对抗外来刺激能力下降,免疫屏障受到破坏。有研究表明,枯草芽孢杆菌和地衣芽孢杆菌能增加肠上皮内淋巴细胞的数量,改善LPS诱导的大鼠损伤,维护肠道功能[11]。本研究结果显示,饲喂干酪乳杆菌预防治疗组IEL数量显著高于沙门菌攻毒组。说明饲喂干酪乳杆菌能提高肠道的免疫功能,抵抗致病菌的入侵。
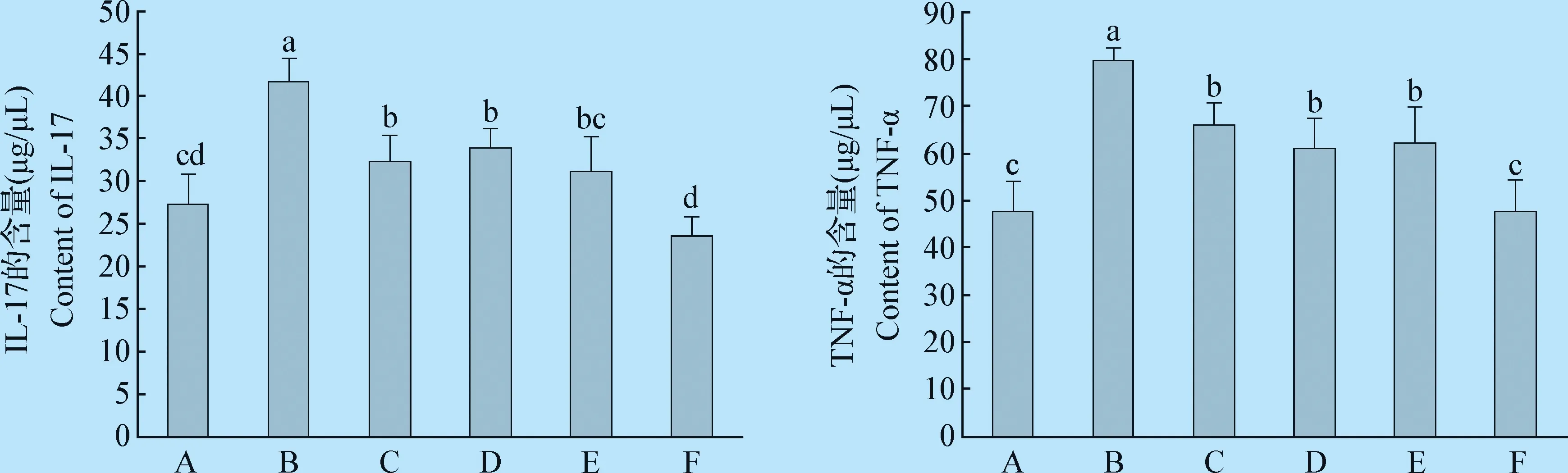
图4 干酪乳杆菌对雏鸡盲肠致炎性因子表达的影响Fig. 4 Effects of Lactobacillus casei on the expression of inflammatory factors in cecum of chicksA:空白对照组; B:沙门菌攻毒组;C:干酪乳杆菌组; D:预防组; E:治疗组;F:预防治疗组A:Blank control group; B:Salmonella challenge group; C:Lactobacillus casei group; D:Prevention group;E:Treatment group; F:Preventive plus treatment group
3.3 干酪乳杆菌对雏鸡盲肠细胞因子的影响 IEL在免疫监视和细胞介导的黏膜免疫中具有重要的作用。病原菌侵入机体后,IEL可产生与多种细胞因子,调节其他淋巴细胞和上皮细胞的功能。根据细胞因子在炎性反应中的作用不同分为2类:致炎细胞因子(IL-17、TNF-α等)和抗炎细胞因子(IL-4、IL-10等)。IL-4对巨噬细胞所产生的IL-1、TNF和PGE2起负调节作用,提示它具有抗炎作用。IL-10是主要由单核巨噬细胞、T淋巴细胞分泌的一种抑制免疫的细胞因子,它的主要作用是抑制炎症反应,防止炎症扩大化,在维持肠道免疫稳态和抗感染中起关键作用[12-13]。IL-17由Th17细胞产生,它可促进中性粒细胞的发育成熟,并且刺激上皮细胞、内皮细胞及纤维母细胞表面细胞间粘附分子-1的表达。IL-17可刺激巨噬细胞产生IL-1β、TNF-α、IL-6和PGE2等,诱导炎症反应,IL-17在炎症发生过程中起重要的调控作用[14]。TNF-α是由活化的单核巨噬细胞产生的一种具有多种生物活性的细胞因子,它可使中性粒细胞在炎症局部聚集并使其活化,能够促进单核细胞、内皮细胞等产生细胞因子,改变肠上皮细胞的形态结构和屏障功能,扩大炎症连锁反应,造成肠道组织的损害[15]。益生菌能够通过调节机体肠道致炎细胞因子和抗炎细胞因子的平衡,维持免疫稳态,在提高机体免疫的同时,避免炎症的发生[16]。有研究表明,干酪乳杆菌能够诱导小鼠肠道中T淋巴细胞的分化,调节细胞因子的表达[6]。本研究表明,沙门菌攻毒后,致炎细胞因子IL-17、TNF-α的含量显著增加,抗炎细胞因子IL-4、IL-10的含量显著降低,显示动物机体诱发炎症反应。使用干酪乳杆菌预防或治疗后抗炎因子IL-4、IL-10的含量显著增加,致炎细胞因子IL-17、TNF-α含量显著下降,说明干酪乳杆菌通过调节致炎细胞因子和抗炎细胞因子含量的变化来减轻沙门菌诱导的炎症反应。此外,本研究结果显示,干酪乳杆菌组致炎细胞因子IL-17、TNF-α的含量显著高于空白对照组。根据已有研究结果IL-17A抑制或IL-17 RA型受体抑制可诱导或加重小鼠结肠炎模型[17],以及乳杆菌诱导早期使细胞因子TNF-α表达上调[18],推测IL-17、TNF-α除对机体有促进炎症反应外,可能存在其他影响,还需进一步探讨。
综上所述,饲喂干酪乳杆菌进行预防治疗能维护雏鸡盲肠上皮细胞的完整性,保护肠道黏膜屏障,降低沙门菌的侵害。同时饲喂干酪乳杆菌能够一定程度上提高雏鸡肠道上皮内淋巴细胞的数量,调节炎性细胞因子的平衡,增强肠道的免疫能力,缓解沙门菌诱导的炎症反应。本研究为干酪乳杆菌应用于生产实践提供一定的理论基础和实验依据。

