不对称PCR 技术结合免疫层析法快速检测产志贺毒素大肠埃希氏菌
山 珊,黄昭鸿,黄艳梅,刘道峰,刘成伟,黄运红,龙中儿,*
(1.江西师范大学生命科学学院,南昌市鄱阳湖湿地微生物资源开发与利用重点实验室,江西 南昌 330022;2.江西业力医疗器械有限公司,江西 南昌 330008;
3.江西省疾病预防控制中心,江西省食源性疾病诊断溯源重点实验室,江西 南昌 330029)
产志贺毒素大肠埃希氏菌(Shiga toxin-producingEscherichia coli,STEC),亦称肠道出血性大肠埃希氏菌,是一种分泌志贺毒素并引起宿主肠黏膜上皮细胞形成黏附及擦拭性损伤的致泻性大肠埃希氏菌[1-2],其致病能力极强,100 个STEC即可引起感染,造成出血性结肠炎或血性腹泻,严重者可进一步发展为溶血性尿毒综合征[3-5]。STEC主要的致病因子志贺毒素(Shiga toxin,Stx)包括2 种[6]:Stx1和Stx2,其中Stx2更易引起出血性结肠炎和溶血性尿毒综合征[7-8]。Stx能与肾细胞上的Gb3或Gb4受体特异性结合,阻断宿主细胞的蛋白质合成。由于一些反刍动物(如牛、羊等)体内细胞缺少这类受体,被感染后出现临床症状的几率低,因此成为了STEC感染的最大宿主[9],人往往通过食用了携带STEC的肉制品或饮用了被牛、羊粪便污染的水或绿叶蔬菜而被感染[10-11]。由于STEC拥有多样化的感染宿主与传播途径,全球每年有280万 人感染STEC,其中3 890 例发展为溶血性尿毒综合征,导致230 人死亡[12]。2017年4月,在美国有25 人因食用了被STEC污染的蔬菜而生病,事件最终导致9 人入院治疗,2 人病情恶化为溶血性尿毒综合征,1 人肾衰竭,1 人死亡,范围波及12 个州。2018年7月美国又发生了一起食用被STEC污染的牛肉中毒事件,此次事件总共造成18 人感染,6 人住院,其中一位来自佛罗里达州的病人因引起了溶血性尿毒综合症而死亡。迅速确定STEC的污染来源可有效缩小疫情的范围,而建立简便高效的检测方法是STEC溯源的关键[13]。
目前针对于STEC的检测方法主要包括免疫学检测法[14-15]和分子生物学法[16-18]。酶联免疫吸附技术[19-20]和免疫层析技术[21]是免疫学检测法的2 个主要检测手段。免疫学检测法是基于STEC菌体表面特异性抗原(O、H抗原)的不同,通过抗原抗体间特异性识别而达到鉴定的目的,操作简单快速,但其检测范围狭窄,只能检测特定血清型的STEC,抗体制备成本高,且容易存在一定的假阳性。分子生物学法主要依靠聚合酶链式反应(polymerase chain reaction,PCR)技术对STEC的标志性毒力基因stx1与stx2进行识别。基于PCR技术的分子生物学法检测手段众多[22-24],可满足不同的实验需求。陆芸等[25]针对stx1和stx2基因序列设计PCR引物以及Taqman探针,建立了一种双重荧光定量PCR技术检测志贺毒素stx1和stx2基因的方法,结果显示对非产志贺毒素肠道菌均无特异性扩增,且阳性检出率优于传统培养法。Singh等[26]建立了一种基于高分辨熔解曲线的双重荧光PCR技术检测stx1与stx2,成功地从人工接种的碎牛肉样品中检出STEC,该方法需要利用特殊的饱和荧光染料与双链DNA分子进行结合,在缓慢升温解链的过程中饱和荧光染料与双链DNA分子解离,不同DNA序列解链温度亦不同,从而产生不同的荧光信号值变化,形成相应的熔解曲线。分子生物学法[27-28]检测技术效果好,特异性强,检出阳性率高,但大多数方法的检测结果判读依赖于荧光定量PCR仪,成本较高,不能直观地对结果进行判定;其他一些依赖于核酸电泳进行结果判定的检测技术虽然成本不高,但有些基因片段大小相近,导致无法准确辨别目的条带,同时电泳过程中的所添加的核酸染料对人体也有一定的危害。
不对称PCR技术是向PCR体系中加入不等量的一对引物进行目标基因的扩增,在扩增后期中生成大量目标基因单链DNA(single-strained DNA,ssDNA)[29]。利用不对称PCR技术产生带有标记物的单链DNA,通过结合其他技术如光学SPR生物传感器[30]、纳米金比色法[31]、电化学DNA生物传感器[32]等实现快速灵敏检测目标基因片段的目的。本实验使用生物素标记的毒力基因stx1与stx2的下游引物对目标基因进行不对称PCR扩增,生物素化的目标单链DNA与聚苯乙烯微球标记的目标基因的上游引物特异性结合形成结合物,结合物上的生物素与试纸条检测线上链霉亲和素结合而使检测线显色。此方法具有选择性高且快速、准确和安全的优点,结果判定便利、直观,可实现现场快速检测的目的,适用于基层实验室使用。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种来源
菌种来源及编号见表1。
表1 菌种来源及编号Table 1 Sources and codes of strains used in this study
1.1.2 试剂
吗啉乙磺酸 上海麦克林生化科技有限公司;磷酸盐缓冲液、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、肉汤培养基、链霉亲和素 北京索莱宝科技有限公司;表面羧基化的红色聚苯乙烯微球DC100R 上海辉质生物科技有限公司;牛血清白蛋白(bovine serum albumin,BSA) 美国Sigma公司;聚乙二醇20000、甘氨酸、葡聚糖、卵清蛋白(ovalbumin,OVA)、脱脂乳、明胶 上海阿拉丁生化科技股份有限公司;TAKARA细菌基因组提取试剂盒;鱼血浆阻断剂 上海怡恒生物科技有限公司;11342-025N硝酸纤维膜(NC膜,流速为570 mL/(min·cm²)) 德国Sartorius公司;聚酯膜(滤纸)、样本垫、结合垫、吸水纸、PVC底板 上海金标生物技术有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
EPS PCR仪 德国Eppendorf公司;HZ100R高速离心机 湖南湘仪实验室仪器开发有限公司;BE-1200旋转混合仪 其林贝尔仪器制造有限公司;Tu-10恒温金属浴 上海一恒仪器设备有限公司;CORNING LSE小型高速离心机 美国Corning公司;HGS510划膜喷金机、HGS-201可编程切条机和试纸条灰度检测仪 杭州峰航科学仪器有限公司;SPX-150BIII生化培养箱天津市汞斯特仪器有限公司;LZDM压力蒸汽灭菌锅上海申安医疗器械厂;Airstream®生物安全柜 新加坡ESCO公司;QIAxcel Advanced全自动实时毛细管电泳仪德国QIAGEN公司;Synergy超纯水系统 德国Merker Millipore公司。
1.3 方法
1.3.1 引物的设计
根据GB 4789.6—2016《食品微生物学检验 致泻大肠埃希氏菌检验》[33]中STEC标志性毒力基因stx1与stx2的序列进行引物及探针的设计,由生工生物工程(上海)股份有限公司合成并测序,如表2所示。
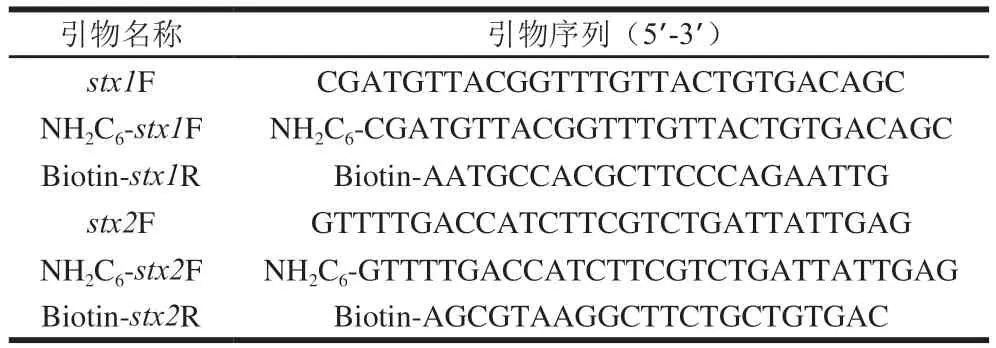
表2 引物及探针序列Table 2 Sequences of primers and probes used in this study
1.3.2 菌株的培养和DNA提取
细菌菌株在5 m L L B 肉汤培养基中3 7 ℃振荡(150 r/min)过夜培养12 h。采用TAKARA公司细菌基因组提取试剂盒,对细菌菌株进行DNA抽取,具体操作按说明书进行。
1.3.3 免疫层析试纸条的制备
利用HGS510划膜喷金机在NC膜上喷涂一定质量浓度的链霉亲和素(1 mg/mL,0.74 μL/cm)作为检测线;将滤纸、结合垫、NC膜、吸水纸按顺序贴于PVC底板上,切成3.9 mm宽的免疫层析试纸条。制备好的试纸条置于密封袋中,干燥阴凉条件下保存。
1.3.4 聚苯乙烯微球的标记
取4 μL表面羧基化的红色聚苯乙烯微球(40 mg/mL)至1 mL吗啉乙磺酸缓冲液中(0.1 mol/L,pH 6.0),25 ℃超声5 min;加入4 μL 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(10 mg/mL,0.1 mol/L吗啉乙磺酸缓冲液)溶液,25 ℃超声5 min后将其放置混合仪上混合反应15 min;加入4 μL氨基标记的上游引物(NH2C6-stx1F或NH2C6-stx2F,100 μmol/L),25 ℃振荡孵育6 h后离心(4 ℃、15 000 r/min、30 min),弃上清液,加入900 μL的0.01 mol/L磷酸盐缓冲液复溶;加入一定量的封闭剂混合反应30 min;再加入100 μL PEG20000溶液(1%,超纯水)混合反应30 min;最后离心30 min后弃上清液(4 ℃、15 000 r/min),加入100 μL 0.01 mol/L磷酸盐缓冲液复溶,置于4 ℃冰箱待用。
1.3.5 不对称PCR体系的建立
以STEC基因组DNA作为模板,分别对stx1和stx2进行不对称PCR条件的优化,以获取相应的生物素标记的目标单链DNA。在普通PCR条件的基础上,加入稀释后的上游引物与正常浓度的下游引物(浓度2 μmol/L);反应体系为:5×PrimeSTAR Buffer(Mg2+Plus),5 μL;dNTP Mixture(2.5 mmol/L),2 μL;PrimeSTAR HS DNA聚合酶(2.5 U/μL),0.25 μL;模板,1 μL;稀释后的stx1F和stx2F上游引物2.5 μL,同时加入等量的生物素标记的下游引物Biotin-stx1R、Biotin-stx2R(浓度均为2 μmol/L),补充超纯水至25 μL。PCR反应条件为98 ℃预变性5 min;变性、退火、延伸(98 ℃,10 s;60 ℃、5 s,72 ℃,30 s)×45 个循环;最后72 ℃,延伸5 min。PCR产物经毛细管电泳仪进行观察。实验对不对称PCR上、下游引物浓度添加比例进行优化,上游引物与相应的下游引物浓度比例为1∶1、1∶2、1∶3、1∶4、1∶5、1∶6、1∶7、1∶8、1∶9、1∶10;对不对称PCR循环数进行优化,循环数梯度设置为n=35、45、55、65;对不对称PCR退火温度进行优化,退火温度梯度设置为55~65 ℃;上、下游引物加入量梯度设置为2.5、3.0、3.5、4.0、4.5 μL,stx1和stx2生物素化的下游浓度均为2 μmol/L,PCR产物经毛细管电泳仪进行观察。
1.3.6 免疫层析实验
用超纯水将不对称PCR产物稀释100 倍,取稀释后的PCR产物92 μL,加入NH2C6-stx1F和NH2C6-stx2F分别标记的聚苯乙烯微球各4 μL混匀,室温静置10 min后加入10 μL PVP溶液(10%,超纯水),混匀后加入免疫层析试纸条样本垫,反应20 min,使用灰度分析仪读取检测线灰度值。
1.3.6.1 封闭剂添加种类的优化
评价7 种不同封闭剂对聚苯乙烯微球的封闭效果,包括BSA、甘氨酸、葡聚糖、OVA、脱脂乳、明胶和鱼血浆阻断剂,添加质量分数为1%,添加量为50 μL。选取stx1不对称PCR产物作为实验组,对照组以超纯水代替不对称PCR产物。
1.3.6.2 封闭剂添加量的优化
在BSA为最优封闭剂的基础上,继续考察BSA添加量对聚苯乙烯微球封闭效果的影响,添加质量分数为1%,添加量分别为10、20、50、70、100 μL。选取stx1不对称PCR产物作为实验组,对照组以超纯水代替不对称PCR产物。
1.3.7 免疫层析试纸条检测stx基因
选取编号为CICC10668(stx1阳性)、CICC10669(stx2阳性)、CICC10670(stx1/stx2阳性)3 株不同的STEC菌株以及1 株肠道聚集性大肠埃希氏菌CICC24186(不含stx基因)菌株于LB固体培养基进行划线培养18 h,挑取单菌落提取基因组DNA作为待检测模板,在优化的条件下进行stx基因检测实验。
1.3.8 特异性实验
以江西省疾控中心菌种库中23 株菌株的基因组DNA为模板进行特异性实验,评价该检测方法的特异性。
1.4 数据处理
每次实验至少重复3 次,所得数据均用Excel软件进行记录与处理,使用Origin 9.0软件进行标准偏差分析并作图。
2 结果与分析
2.1 不对称PCR上、下游引物添加比例的优化

图1 stx1和stx2不同引物浓度添加比的免疫层析检测灰度值Fig. 1 Gray values of immunochromatography at different concentration ratios between stx1 and stx2 primers

图2 stx1(A)和stx2(B)不同引物浓度添加比的不对称PCR产物毛细管电泳图Fig. 2 Capillary electrophoresis profiles of aPCR products at different concentration ratios between stx1 (A) and stx2 (B) primers
在利用不对称PCR技术制备目标单链DNA的过程中,当限制性引物(上游引物)耗尽时,剩余过量的下游引物则以扩增前期所产生的双链DNA为模板,扩增出所对应的目标单链DNA,因此上、下游引物的添加比例是影响单链DNA产量的关键因素。考察stx1与stx2的最佳引物浓度添加比,结果如图1、2所示。随着下游引物添加量的增加,stx1相应单链PCR的产量随之升高(图2A),stx1在stx1F∶Biotin-stx1R浓度比为1∶7时,其制备的目标单链DNA进行免疫层析时的灰度值最高结果(图1),灰度平均值为464.6。当stx2F∶Biotin-stx2R添加浓度比为1∶4时,制备的stx2的目标单链DNA进行免疫层析时的灰度值最高,灰度平均值为383.3。继续提高stx2基因下游引物的添加量,相应目标单链DNA的随之减少,并出现了其他副产物(图2B)。导致免疫层析效果下降。
2.2 不对称PCR循环数的优化
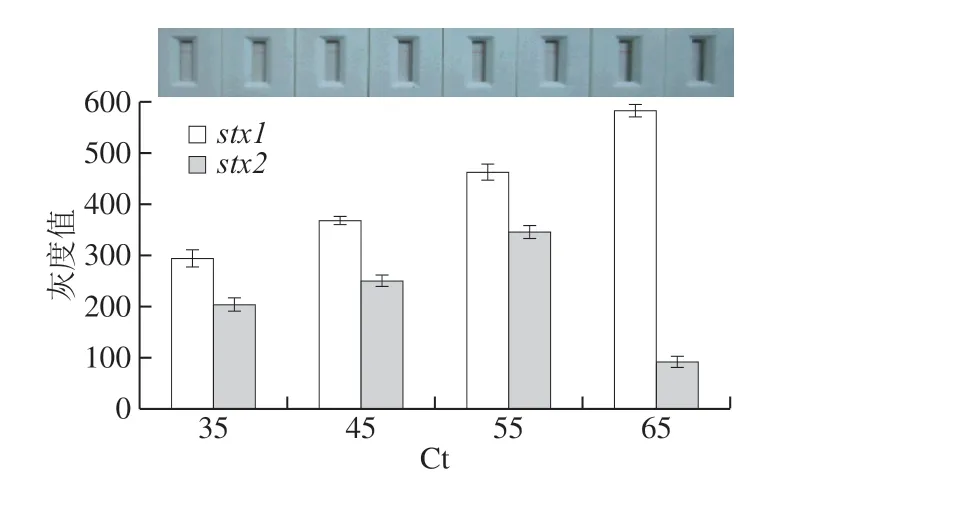
图3 stx1和stx2不对称PCR不同循环数的免疫层析检测灰度值Fig. 3 Gray values of immunochromatography at different aPCR cycles for stx1 and stx2
在不对称PCR过程中,循环扩增末期会产生大量的单链DNA产物,对不对称PCR反应循环数进行优化,结果如图3、4所示。实验结果显示随着循环数的增加,stx1目标单链DNA产物含量越多(图4),同时免疫层析法检测stx1的结果(图3)显示当循环数为65,检测线的灰度平均值最高为582.4;对于stx2组,当循环数为55时,检测线的灰度平均值最高为344.3,当循环数为65时,stx2的目标单链DNA产物免疫层析灰度值下降(图3),可能由于不对称PCR循环数增加导致单链扩增效率不高,因此目标单链DNA产物浓度下降,故选取循环数为55。

图4 stx1、stx2不同循环数的不对称PCR产物毛细管电泳图Fig. 4 Capillary electrophoresis profiles of stx1 and stx2 aPCR products at different PCR cycles
2.3 不对称PCR退火温度的优化
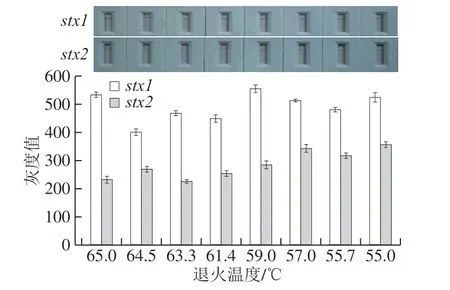
图5 stx1、stx2不对称PCR不同退火温度的免疫层析检测灰度值Fig. 5 Gray values of immunochromatography of stx1 and stx2 aPCR products at different annealing temperatures

图6 stx1(A)和stx2(B)不同退火温度的不对称PCR产物毛细管电泳图Fig. 6 Capillary electrophoresis profiles of aPCR products of stx1 (A)and stx2 (B) at different annealing temperatures
如图5、6所示,stx2的最优退火温度为55 ℃,检测线灰度值为362,stx1组在退火温度55~65 ℃期间,其检测线的平均灰度值均高于stx2组,当退火温度为59 ℃时所测得检测线的平均灰度值最大为557。结果显示较低的退火温度对stx2制备的目标单链DNA进行检测更有利。最终选取55 ℃作为不对称PCR反应的退火温度。
2.4 不对称PCR引物加入量的优化
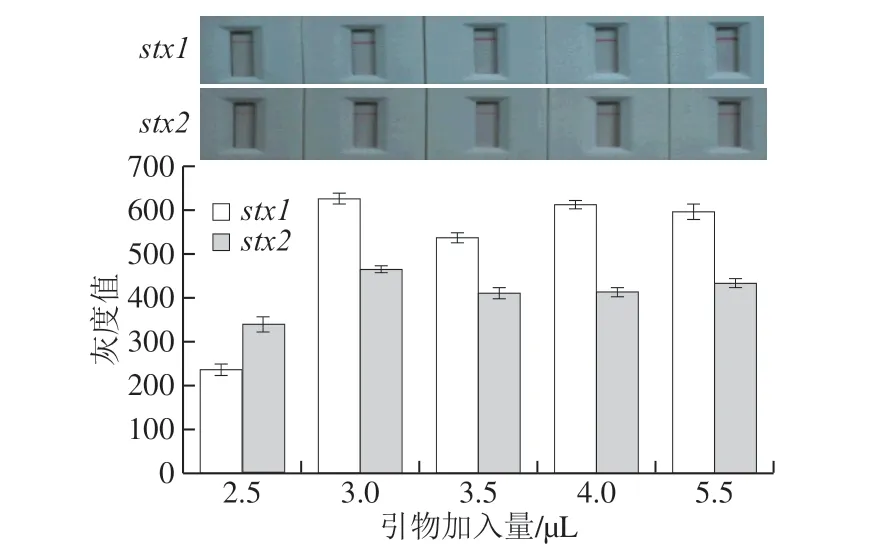
图7 stx1和stx2不对称PCR不同引物加入量的免疫层析检测灰度值Fig. 7 Gay values of immunochromatography of stx1 and stx2 aPCR products at different amounts of primers

图8 stx1和stx2不同引物加入量的不对称PCR产物毛细管电泳图Fig. 8 Capillary electrophoresis of aPCR products at different primer ratios between stx1 and stx2
不对称PCR体系中引物的添加量影响整个扩增过程中目标单链DNA产物的生成量,适当提升引物加入量能够增加扩增末期时所产生目标单链DNA。因此,对不对称PCR体系中引物加入量进行优化,结果如图7、8所示。随着体系中引物浓度的增加,目标单链DNA产物的生成量也随之增加,当stx1与stx2引物(上游引物浓度为2 μmol/L)加入量为3 μL时,stx1的检测线灰度值最高为600(图7),stx2的检测线灰度值最高为440,继续提高引物的浓度,对免疫层析效果没有显著影响。
2.5 封闭剂对检测结果的影响
聚苯乙烯微球具有较强的物理吸附作用,合适的封闭剂可最大程度地减小实验过程中的非特异性吸附作用。如图9、10所示,在7 种封闭剂中,当以甘氨酸和葡聚糖作为封闭剂时,阴性组中会出现微弱的非特异性条带。以OVA和鱼血浆阻断剂作为封闭剂的实验组20 min后检测线灰度值较高,但在有效显色时间内(20 min之内)显色速率慢于BSA实验组(图10)。明胶作为封闭剂会严重影响聚苯乙烯微球上DNA探针与目标单链DNA的特异性结合,进而导致实验组无法显色,因此选用BSA作为最终封闭剂。
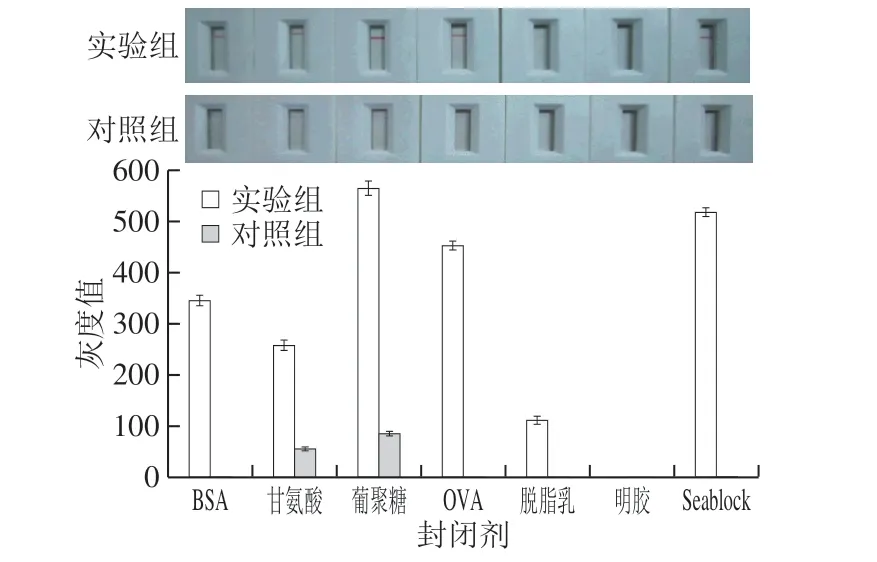
图9 不同封闭剂作用下的stx1聚苯乙烯微球免疫层析检测灰度值Fig. 9 Gray values of immunochromatography with different blocking agents for stx1 polystyrene microspheres
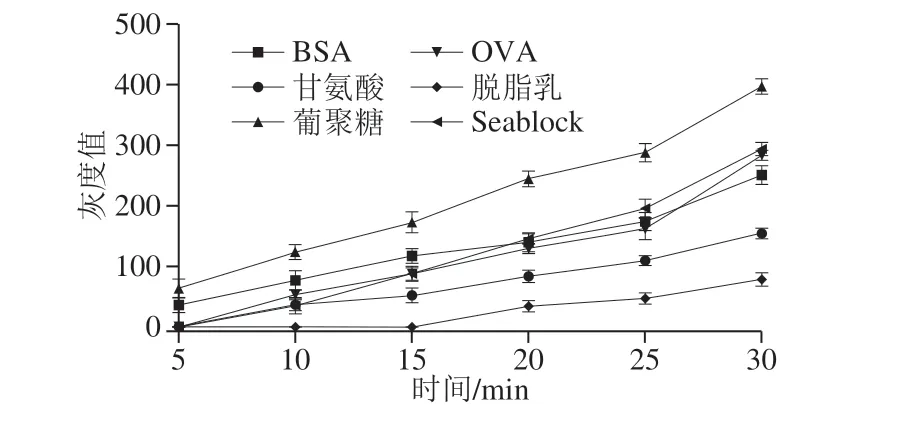
图10 不同封闭剂作用下的stx1聚苯乙烯微球免疫层析动力学曲线Fig. 10 Kinetic curves for immunochromatography with different blocking agents for stx1 polystyrene microspheres
2.6 BSA添加量对检测结果的影响
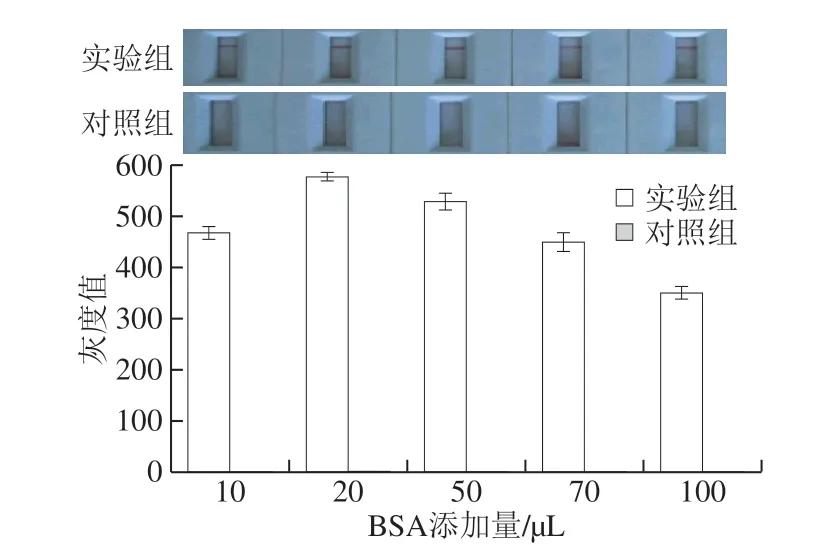
图11 不同量的BSA封闭聚苯乙烯微球免疫层析检测灰度值Fig. 11 Gray values of immunochromatography with different amounts of BSA as a blocking agent for polystyrene microspheres
少量的封闭剂导致聚苯乙烯微球表面封闭面积不足,进而产生非特异性吸附,过多的封闭剂会影响聚苯乙烯微球上DNA探针与目标单链DNA的特异性结合。如图11所示,当BSA添加量为20 μL时,检测线的灰度值达到最大,为577,同时阴性对照组未出现条带,随着BSA添加量的增加,阳性组检测线灰度值有不同程度地下降。
2.7 免疫层析试纸条检测stx基因

图12 免疫层析法检测stx基因灰度值Fig. 12 Gray values of immunochromatography for detection of stx gene
利用所建立的方法对4 株菌株进行stx基因检测,结果如图12所示,利用该方法可快速分型检测到STEC。
2.8 特异性实验
为验证本实验建立并优化的快速分型STEC法的特异性,选取23 株菌株进行stx基因的检测,结果如表3所示。23 株菌中STEC CICC10670、CICC10668和CICC0669呈现stx阳性,其他非携带stx基因的菌株为阴性;结果显示该方法可准确检测到含有STEC标志性毒力基因stx的菌株,且具有良好的特异性。

表3 免疫层析技术特异性实验检测结果Table 3 Specificity evaluation of the immunochromatographic test
3 结 论
通过建立一种基于不对称PCR结合免疫层析技术快速检测STEC标志性毒力基因stx的方法,可实现快速、准确分型STEC的目的。该方法操作简便、检测成本低、检测结果准确以及特异性良好等特点,适用于基层实验室使用。

