Galectin-1 和PAX-2 在子宫内膜癌前病变中的表达及其与病情进展的相关性
张勇峰,陈岚,王希
(河南科技大学第一附属医院病理科,河南 洛阳 471000)
子宫内膜癌为原发于子宫内膜的上皮性恶性肿瘤,具有发病因素多、机制尚不明确特点,据报道其死亡率已达恶性肿瘤死亡率前10 位[1]。及早发现、早期治疗对疾病预后和生存质量至关重要,子宫内膜活检作为常规诊断手段对前期病变误诊率高[2];且相关病房资料显示目前提供给病理医师的子宫内膜材料较常规刮宫术更少,增加了诊断难度[3]。近年一些学者探讨子宫内膜癌前病变与子宫内膜癌的关系发现,相关蛋白分子与疾病密切相关,考虑通过评估相关分子标志物的表达水平,可有效防治子宫内膜癌前病变的恶性发展。半乳凝素1(Galectin-1) 作为Galectin 家族中的一员具有高度蛋白亲和力,多项研究显示其可在多种肿瘤细胞中异常上调[4]。近年一项研究表明,随着子宫内膜病变恶性程度增强或向恶性转化,Galectin-1 和Galectin-9 表达水平均增强,提示Galectin 家族相关因子可能与子宫内膜癌前病变病情进展与预后密切相关[5]。除此之外,近年发现与子宫内膜癌发生相关分子标志物还有配对盒基因2 (Pairing box gene 2, PAX-2)、磷酸酶基因(Phosphatase gene, PT EN)、雌激素受体(estrogen receptor, ER)、蛋白激酶(protein kinase, PKD1)、肿瘤增殖抗原(Ki-67)等,均有可能参与子宫内膜的癌变进展,给临床提供了一定依据[6,7]。但综合国内外文献和临床资料发现,关于Galectin-1、PAX-2 在子宫内膜癌前病变中的表达及其意义的报道较少, 因此本研究就此展开讨论,以期明确子宫内膜癌前病变恶性发展的预测因子,现报告如下。
1 资料与方法
1.1 一般资料 经本院医学伦理会讨论并通过和患者及家属均签署知情同意书后,于病理档案室收集 2013 年 1 月-2015 年 2 月我院切除的 109 例子宫内膜标本,分别有28 例子宫内膜息肉、40 例子宫内膜增生症(单纯性增生12 例、复杂性增生9 例、非典型增生19 例)、41 例子宫内膜癌 (Ⅰ型子宫内膜样腺癌22 例、Ⅱ型子宫内膜浆液性癌19 例)。子宫内膜息肉患者年龄 26~43 岁、 平均 31.65±3.06岁,平均身体质量指数(Body mass index, BMI)(22.96±2.78)kg/m2; 子宫内膜增生症患者年龄 28~68 岁、平均 40.22±3.34 岁,平均 BMI 23.52±3.11kg/m2;子宫内膜癌患者年龄 31~75 岁、平均 46.68±3.47 岁、<30 岁 17 例、≥30 岁 24 例, 平均 BMI23.52±3.11 kg/m2、<18.5 kg/m226 例、≥18.5 kg/m215 例, 平均卡氏(Karnofsky, KPS)评分(82.02±2.36)分、70~80 分23 例、>80 分 18 例, 病理学分级 G1~G2 级 29 例、G3 级 12 例,I~Ⅱ期 30 例、Ⅲ~Ⅳ期 11 例,有淋巴结转移7 例,无淋巴结转移34 例。入选标准:⑴疾病诊断最终经病理学检查确诊; ⑵子宫发育正常的女性; ⑶年龄18~45 岁; ⑷入院前均未接受放疗、 化疗或靶向治疗; ⑸未发生全身其他部位转移;⑹ KPS 评分≥70 分;⑺预计生存期超过1 年。排除标准:⑴合并其他恶性肿瘤;⑵依从性不好,不能定期随访;⑶子宫内膜癌既往史;⑷过敏体质或凝血功能异常; ⑸沟通障碍或严重精神系统疾病;⑹临床资料不完整,相关检查不完善。剔除标准:⑴依从性特别差或中途要求退出的受试者;⑵未完成治疗; ⑶因疾病恶化或出现严重并发症需进行其他治疗;⑷不能获取完整随访资料。
1.2 方法 采用RM2235 组织切片机(德国徕卡)将所有包蜡组织切成4 μm 连续切片,依次采用二甲苯(南通新能源物资有限公司)、柠檬酸钠缓冲液(北京泰泽瑞达科技有限公司)及3%过氧化氢溶液(北京百欧博伟生物技术有限公司)进行脱蜡、抗原修复、梯度酒精水化、PBS 缓冲液(上海颖心实验室设备有限公司)漂洗、内源性过氧化物酶活性消除;滴加小鼠抗人PAX-2、Galectin-1 多克隆抗体 (浓度1:100, 购自 Santa Cruz 公司)4℃孵育过夜;PBS 漂洗, 滴加即用型生物素化二抗37℃孵育30 min;PBS 漂洗,滴加辣根酶标记链霉卵白素工作液,37℃孵育20 min;PBS 漂洗,经 DAB 显色试剂盒(Solarlaio)显色、苏木精(湖南汇百侍生物科技有限公司)复染、梯度酒精脱水,透明,中性树脂(南京森贝伽生物科技有限公司) 封片,DMM-440 倒置显微镜(上海蔡康光学仪器有限公司) 下观察PAX-2、Galectin-1 表达。
1.3 染色判定标准 由两名具有执业资格的病理科医生采用双盲法对结果进行判断和分析, 染色强度:0 分为不着色,1 分为淡黄色,2 分为深黄色,3 分为棕黄色; 阳性细胞百分率:0 分为阳性细胞百分率 0~5%,1 分为阳性细胞率 5~25%,2 分为阳性细胞率 26~50%,3 分为阳性细胞率 51~75%,4分为阳性细胞百分率>75%。两项之和进行综合判定:≤ 3 分为阴性,>3 分为阳性。
1.4 统计学方法 采用EpiData3.1 软件校正所有数据,spss22.0 软件进行统计分析,计数资料比较采用卡方(χ2)或Fisher 确切概率法检验,组间有序分类资料比较采用Ridit 分析; 采用Kendall’s tau-b法检验等级资料相关性。P<0.05 为差异具有统计学意义。
2 结果
2.1 PAX-2 表达情况 PAX-2 主要定位于细胞核中,呈黄色或棕黄色颗粒;PAX-2 阳性表达率在Ⅰ型子宫内膜样腺癌组织、 Ⅱ型子宫内膜浆液性癌组织、子宫内膜增生症组织、子宫内膜息肉组织中依次升高(P<0.05),见表 1、图 1。

表1 PAX-2 阳性表达率[n(%)]

图1 PAX-2 阳性表达图
2.2 Galectin-1 表达情况 Galectin-1 主要定位于细胞浆中,部分可于细胞核中表达,呈黄色或棕黄色颗粒;Galectin-1 阳性表达率在Ⅰ型子宫内膜样腺癌组织、Ⅱ型子宫内膜浆液性癌组织、子宫内膜增生症组织、 子宫内膜息肉组织中依次下降 (P<0.05),见表 2、图 2。
2.3 PAX-2、Galectin-1 表达与子宫内膜癌前病变病情进展的关系 等级相关分析结果显示,PAX-2阳性表达与子宫内膜增生症呈负相关(r=-0.360,P<0.05),Galectin-1 阳性表达与子宫内膜增生症呈正相关(r=0.553,P<0.05)。
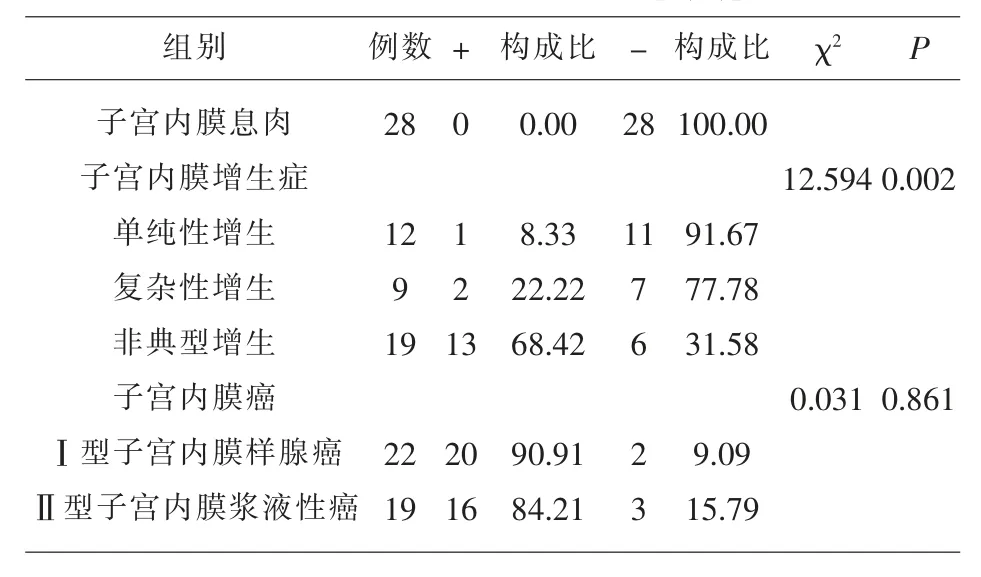
表2 Galectin-1 阳性表达率[n(%)]

图2 Galectin-1 阳性表达图
2.4 PAX-2、Galectin-1 表达与子宫内膜癌临床病理特征关系 PAX-2 在 BMI≥18.5 kg/m2、 病理学G3 级、 分期I~Ⅱ期组织中阳性表达率高于BMI<18.5kg/m2、病理学 G1~2 级、分期Ⅲ~Ⅳ期组织中阳性表达率 (P<0.05),Galectin-1 在病理学 G3 级、分期I~Ⅱ期组织中阳性表达率低于病理学G1~2 级、分期Ⅲ~Ⅳ期组织中阳性表达率(P<0.05,表3)。
3 讨论
Galectin 家族有 15 个成员, 包括 Galectin-1~Galectin-15, 均由一组与β-半乳糖苷具有高度亲和力的动物凝集素蛋白组成,决定其具有影响细胞黏附、生长、凋亡、增殖、炎症反应、免疫调节、抗肿瘤作用等多种生物学功能。张广云等[8]文献指出,Galectin-3 在膀胱癌组织切片中阳性表达率高于正常组织;Van 等[9]发现 Galectin-1 在胶质母细胞瘤细胞质或细胞质基质中表达上调,该患者五年生存率更低;Wang 等[10]敲除Galectin-1 基因后发现,子宫内膜癌耐药性提高,提示Galectin-1 可诱导癌细胞耐药性;综合上述研究可得Galectin-1 可促进肿瘤细胞发展。这早在既往研究中已得到证实,Galectin-1 可在卵巢癌、卵巢上皮癌、子宫颈癌等多种恶性肿瘤组织呈高表达,促进癌细胞转移、侵袭与生长。本研究结果显示,Galectin-1 在Ⅰ型子宫内膜样腺癌组织、Ⅱ型子宫内膜浆液性癌组织、子宫内膜增生症组织、子宫内膜息肉组织中阳性表达率依次为 90.91%、84.21%、32.99%、0.00%,可看出子宫内膜的恶化程度与Galectin-1 表达水平有正相关关系,且在正常子宫内膜中Galectin-1 完全不表达。该表达率较低于Noda 等[11]理论,考虑与本研究样本量较少有关,另可能与选取的均为回顾病例有关。结合既往报道,提示Galectin-1 可参与肿瘤细胞发生和进展,其高表达提示子宫内膜癌前病变可向恶性发展或呈恶性程度增高趋势。盒子基因家族成员之一PAX-2 对促进中枢神经系统、眼、肾等胚胎和器官发育具有重要价值,也可参与多种肿瘤细胞发生与发展。PAX-2 具有保守的DNA 序列基序,包含128 个氨基酸结构域在蛋白质的氨基末端部分,决定其的转录调控作用。陆春燕等[12]文献表明,PAX-2 在成熟组织中多不表达,而在成人子宫内膜中呈持续表达,提示其参与子宫内膜增生和自我更新。祁晓莉等[13]探讨PAX-2 在子宫内膜癌中的表达发现, 子宫内膜癌组织中PAX-2 表达水平低于正常子宫内膜组织, 提示PAX-2 在恶性肿瘤细胞中可呈表达缺失状态。该机制主要与其对基因的调控转录作用有关,对细胞有丝分裂产生抑制,从而促进细胞凋亡、转移及分化。本研究中PAX-2 阳性表达率与Galectin-1 表达率相反,其表达缺失提示预后不良。吴银霞等[14]的一项膀胱癌大样本随访资料显示,Galectin-1 阳性患者术后五年生存率显著低于Galectin-1 阴性患者,且当并存远处淋巴转移时,Galectin-1 阴性患者术后五年生存率也和无转移患者无显著差异,这一研究结果证实了Galectin-1 对癌细胞进展和预后的预测。本研究中子宫内膜恶性程度越高而Galectin-1 表达越强,参考吴银霞的结果,提示Galectin-1 可作为预测子宫内膜癌前病变疾病进展的分子标志物。

表3 PAX-2、Galectin-1 表达与子宫内膜癌临床病理特征关系
为进一步明确Galectin-1、PAX-2 表达水平对子宫内膜癌发生的预测价值, 我们将Galectin-1、PAX-2 表达水平与不同组织类型子宫内膜病变及子宫内膜癌临床病理特征进行相关性分析, 结果Galectin-1 表达与疾病恶性发展呈正相关关系,而PAX-2 表达与疾病恶性发展呈负相关关系。且Ⅰ型子宫内膜样腺癌PAX-2 表达阳性率显著低于Ⅱ型子宫内膜浆液性癌, 说明PAX-2 与Ⅰ型子宫内膜癌发病相关性更大。在子宫内膜病变早期、无淋巴转移时,Galectin-1 表达率低而PAX-2 表达率高, 说明PAX-2 缺失和Galectin-1 强表达可能发生在子宫内膜癌发病早期阶段,这对于早期相关分子的检测和控制有较高价值。分析其作用机制可得,PAX-2 和抑癌基因具有相似结构,共同参与正常子宫内膜生长,其水平下降或缺失直接影响子宫内膜正常生长和功能。而Liu 等[15]报道指出,子宫正常生长功能被破坏后,原癌基因和抑癌基因发生变化, 诱发癌症可能性大。相关报道均对Galectin-1表达水平作出证实,其在正常组织中几乎不表达,而一旦组织发生病变,其敏感性高于其他特异性指标[16,17]。
综上,PAX-2、Galectin-1 表达水平与子宫内膜癌前病变及子宫内膜癌发生和发展密切相关,检测该指标可简单、方便判断子宫内膜癌前病变严重程度,对子宫内膜癌及其癌变病变早期诊断、指导临床治疗及评估预具有重要价值。

