猪苓菌丝体化学成分在运动性水肿中的作用*
庞兵武
(铁道警察学院,河南 郑州 450003)
猪苓(Polyporus umbellatus) 又名猪茯苓、猪灵芝、野猪粪、朱苓等,是多孔菌科(Polyporaceae)多孔菌属(Polyporus) 真菌[1]。猪苓多为野生,寄生在桦树、枫树和橡树等树木的根部,前期生长于地下土壤中,猪苓菌核拱出地面生长,可人工栽培[2]。若子实体幼嫩时可以作为食用菌食用,营养丰富、味道鲜美。猪苓也是一味常见的中药,自古就被记载有利尿治水肿之功效[3]。《神农本草经》列为中品、中医认为其“性甘平,入肾、膀胱经”,主治肾炎,小便不利,水肿等疾病[4]。现在猪苓已经成为一种常用的药用真菌,“五苓散”“猪苓汤”等中药方中均大量使用。
已有人在猪苓中提取到无晶形多糖、麦角甾醇等多种活性物质和微量元素[5]。陈晓梅等[6]从猪苓中分离得到猪苓多糖、28个甾体类化合物、三萜类、蒽醌类和腺嘌呤核苷等12种其它化合物;曾星等[7]研究了猪苓多糖对膀胱癌的治疗;戴如琴等[8]研究了猪苓菌丝体的抗肿瘤功效,这些研究都表明,猪苓子实体和菌丝中均含有抗癌、抗肿瘤成分。
现代人重视健身运动,一些人在做完运动之后时常会出现水肿现象,而且多是下肢水肿,严重的躯体也会浮肿[9]。主要是运动负荷过大或发力不对,对下肢造成压力过大,局部乳酸堆积或细胞壁破损造成运动型水肿[10]。在排除自身器官问题后,可以采用冷敷、热疗的方法,同时,也需要通过药物和饮食调节来加快水肿的消退。
1 材料和试验方法
1.1 材料
1.1.1 猪苓菌株
猪苓菌株购自标准品信息网,菌丝白色,生长缓慢,20 d菌丝生长约1 cm。
1.1.2 培养基
综合PDA琼脂培养基:马铃薯提取液1.0 L,葡萄糖 20.0 g;磷酸二氢钾 3.0 g、七水硫酸镁 2.0 g、VB10.5 g;琼脂 15.0 g。
1.1.3 药品与试剂
95%乙醇,无水乙醇,正丁醇,三氯乙酸,盐酸、氢氧化钠等均为分析纯;戊巴比妥钠,红霉素软膏均为医用。
1.1.4 试验仪器
JZ-BS恒温培养箱,北京九州晟欣科技有限公司;101型电热鼓风干燥箱,泰安市宇成矿用设备有限公司;WACS-1045型全自动微电脑高压灭菌锅,成都浩宇驰仪器仪表有限公司;YP102N精密电子天平秤,北京佳航博创科技有限公司;VD-650桌上式垂直送风净化工作台,上海坤诚科学仪器有限公司;YG600型恒温水浴振荡器,南通三思机电科技有限公司;GT10-2高速台式离心机,北京金洋万达科技有限公司;XPM-120*3实验室三头研磨机,江西龙中机械设备有限公司;DZF-6090D真空干燥箱,常州金坛良友仪器有限公司,SY-1000E型恒温聚能式超声波提取机,上海仙象仪器仪表有限公司;TJSM-2000-Ⅱ型高频电刀,天津市赛盟医疗科技有限公司;faith-4060型全自动生化分析仪,南京劳拉电子有限公司。
1.1.5 试验动物
试验采用雌雄各半的白兔,体重 (2.4±0.4) kg,购自天津裕达实验动物繁育有限公司,生产许可证号SCXK(津) 2016-0001。
1.2 猪苓菌丝体培养
1.2.1 PDA 培养基制备方法
马铃薯提取液制备:采用去皮马铃薯200 g,切成2 cm左右的小块,加纯净水1.0 L煮30 min,期间不停搅拌防止糊底;煮成糊状后自然冷却至室温,用3层纱布包裹,用力挤压过滤;取滤液,加入葡萄糖、磷酸二氢钾、七水硫酸镁、维生素和琼脂,搅拌均匀并加水定容至1.0 L即可,pH自然。
1.2.2 猪苓菌丝活化培养方法
购买的猪苓菌种在冰箱2℃~4℃冷藏24 h后取出,在固体斜面培养基上进行接种;接种后放入恒温培养箱中27℃避光培养7 d,之后再进行1次筛选,选出适合生长的培养基再进行1次转接;继续观察,当斜面上菌丝体覆盖满时即可。好的猪苓菌丝呈白色、生长均匀稠密。
在500 mL三角瓶中装入200 mL的PDA培养基,灭菌处理后接入斜面培养的猪苓菌丝块3片~5片,每片菌丝块约5 mm,分散放置,调节pH至5.0。然后将三角瓶放入 恒温水浴振荡器,27℃、140 r·min-1发酵 7 d。
1.3 猪苓菌丝体化学成分提取
采用“乙醇+超声波”联合提取法提取猪苓菌丝体化学成分。将活化培养好的猪苓菌丝装入试管,加等量的PDA培养基,置于恒温水浴振荡器中,27℃、140 r·min-1振荡培养4 d。得到的发酵液在5 000 r·min-1离心15 min,取下部的菌丝体,用纯净水洗涤后,放入真空干燥箱,60℃下烘干至恒重,研磨机200 r·min-1研磨10 min得到猪苓菌丝体粉末。
将猪苓菌丝体干粉末中按1∶40的料液比加纯净水进行超声波提取,超声功率为120 W、60℃提取15 min,连续提取2次,合并2次提取液,得到猪苓菌浸提液。
将正丁醇与三氯乙酸按5∶1的比例混合配制成混合液,并按1∶1的比例加入猪苓浸提液混匀。置于恒温水浴振荡器中140 r·min-1、27℃振荡20 min,取出后静置30 min。再加入2倍体积的95%乙醇溶液洗涤后,放入4℃冰箱静置48 h;取出后将下层沉淀物上离心机,5 000 r·min-1离心15 min,再将离心后的沉淀物用无水乙醇洗涤3次;最后放入真空干燥箱,60℃真空干燥至恒重即得猪苓菌丝体提取物。该提取物中含有多糖、蛋白质、甾体类和酮类等多种化学成分,是猪苓药效的主要来源。用该提取物按1∶1制备成猪苓菌丝体提取液供动物试验使用。
1.4 运动水肿试验方法
将20只兔子单笼适应性饲养3 d后,随机分成高剂量组、中剂量组、低剂量组,1个对照组,每组5只,继续单笼饲养。
用1.5%的戊巴比妥钠,按3 mL·kg-1剂量在兔耳边缘静脉注射麻醉兔子,约5 min~10 min兔子安静后固定在超净工作台上;从一侧后肢小腿关节上3 cm位置,剔除上下3 cm的毛发后进行皮下环切;切除约3 cm宽的皮肤、注意不要伤及肌肉和肌腱、神经组织。用电刀灼烧裸露皮肤,再用红霉素软膏涂抹1层灼烧后的皮肤,防止感染。将切除皮肤的后肢环切区用铯137辐射,采用一次性辐射10 GY剂量的照射。1 d~3 d后观察兔子环切处出现水肿并不断增大,3 d左右水肿体积基本稳定时即表明水肿模型建立成功。
兔子水肿模型建立后,每天固定给高剂量组、中剂量组、低剂量组兔子分别灌胃90 mL、60 mL和30 mL配制好的猪苓菌丝体提取液,对照组灌胃同等剂量的生理盐水,连续30 d。
采用排水法测量水肿情况,将兔子水肿的后肢浸入装满生理盐水量杯中,浸水深度与大腿关节齐平。拿出后计算排出的生理盐水的排出量即为水肿腿体积;同样测量出另外一侧未环切后肢的体积,每3天测量1次,每次3个重复,连续30 d。
收集灌胃后2 h内的兔子尿液,用量筒测量比较各组的总尿量。并采用全自动生化分析仪测定各组混合尿液中的铵根阳离子和钠离子含量。
2 试验结果
2.1 水肿体积变化
由于受到了辐射,在术后兔子均很快产生了水肿,3 d左右基本稳定。各组兔子水肿包直径的变化情况如图1所示。
由图1可知,术后1周内各试验组和对照组的水肿程度基本相同,从第5天起出现变化,与对照组相比,中剂量组、高剂量组水肿体积显著减小(P<0.05);后续2周内,低剂量组的水肿体积无明显变化,中剂量组、高剂量组显著减小(P<0.05);最后1周,低剂量组的水肿程度下降较大,但差异不明显,中剂量组、高剂量组水肿体积持续减少,具有显著差异(P<0.05)。
2.2 尿量和尿液中电解质水平
尿量和尿液中电解质水平检测结果如表1所示。
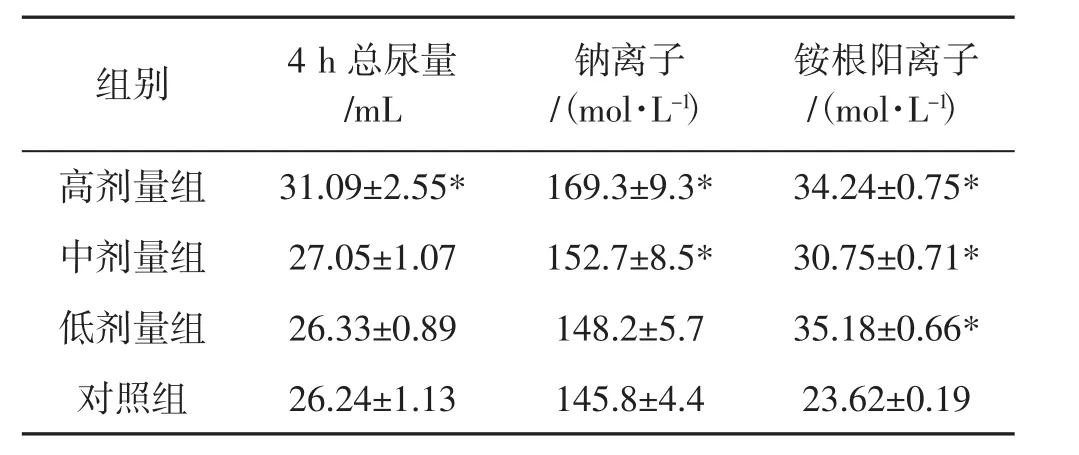
表1 兔子尿量和尿液中电解质水平Tab.1 Comparison of urine volume and electrolyte levels in rabbit urine
由表1可知,与对照组相比,高剂量组的4 h尿量显著增加(P<0.05);高剂量组、中剂量组的钠离子排出量显著增加(P<0.05);3个试验组的铵根阳离子的排出量均显著增加(P<0.05)。
3 讨论
用电刀灼烧会造成兔子皮肤细胞严重受损,产生水肿,这与运动受伤产生水肿的机理一致[11]。用排水法测量对比水肿的体积试验结果表明,灌胃高、中剂量猪苓菌丝体提取液的兔子,其水肿体积在术后1周即出现明显缩小,后续试验中也持续变小,说明猪苓菌丝体中的有效化学成分起到了很好的作用。机理可能是猪苓中的多糖、麦角甾醇、甘露聚糖等均具有较强抗菌性和抗氧化性,能够抑制水肿液中的细菌滋生,修复机体受损细胞,从而减轻水肿症状。
对参与运动的机体来说,尿液是排出毒素和身体废弃物的重要途径,通过尿液来调节机体的酸碱平衡和组织内外压,是减轻水肿症状的重要方式[12]。试验结果显示,灌胃了中剂量、高剂量的猪苓菌丝体提取液,可以提高尿液中钠离子和铵离子的含量。表明猪苓具有加速体内钠离子和铵离子排出的功效,间接降低了血压,调节了组织液的电解质平衡,改善了因组织液压力差而产生的水肿现象。但这种利尿的功效需要灌胃高剂量的猪苓菌丝体提取液。
4 总结
试验结果表明,高剂量的猪苓菌丝体提取液消肿、利尿的效果更好。猪苓菌丝体中的化学成分,对运动水肿有较好的治疗作用,能够缓解运动造成的水肿,减少运动乳酸及代谢废物的产生,缓解水肿症状。

