甘蔗梢腐病菌FusariumsacchariCYP51基因克隆及遗传转化
周宇明 黄振 段真珍 李慧雪 暴怡雪 张木清 姚伟




摘 要:甾醇14α-去甲基化酶(CYP51)是生物细胞膜合成所需的一个非常重要的酶,在病原菌的耐药性、致病性和生长繁殖等方面发挥着非常重要的作用。研究表明干扰真菌的CYP51基因表达导致其无法正常生长,显著降低其致病性。本研究以甘蔗梢腐病菌甘蔗镰刀菌(Fusarium sacchari)为试验材料,根据基因组测序数据设计特异性引物克隆得到了FsCYP51基因全长和CDS全长。生物信息学分析表明,该基因序列全长1947 bp,编码区由2个内含子和3个外显子组成,CDS全长1554 bp,编码517个氨基酸,编码蛋白理论相对分子量为58.61 kDa。其编码蛋白的二级结构主要由α-螺旋和无规卷曲构成,具有典型的CYP51保守结构域。预测其亚细胞定位于细胞膜,且存在2个跨膜区域。系统进化分析表明,FsCYP51基因属于CYP51C这一类,与串珠镰刀菌(F. verticillioides)的CYP51C基因亲缘关系最近。同时,根据克隆到的基因全长和CDS全长构建了多价HIGS植物表达载体,并利用基因枪介导的遗传转化方法将干扰片段成功转化至甘蔗受体材料,为研究FsCYP51基因功能和创制抗梢腐病甘蔗种质奠定基础。
关键词:甘蔗镰刀菌;CYP51;基因克隆;HIGS;遗传转化
中图分类号:S432.1 文献标识码:A
Abstract: CYP51 is a very important enzyme for the biosynthesis of biological cell membrane, and plays a very impor-tant role in drug resistance, pathogenicity, growth and reproduction of pathogens. The interference with expression of CYP51 gene in fungi can prevent its normal growth and significantly reduce its pathogenicity. In this study, the full length of FsCYP51 gene and CDS were cloned by designing specific primers based on the genome sequencing data of Fusarium sacchari. Bioinformatics analysis showed that the total length of the gene was 1947 bp, and the coding region consisted of two introns and three exons. The total length of CDS was 1554 bp, encoding 517 amino acids. The theoretical relative molecular weight of the coding protein was 58.61 kDa. The secondary structure of the encoded protein was mainly composed of α-helix and random coils, and it had a typical conserved domain CYP51. Its subcellular localization was predicted in the cell membrane and there were two transmembrane regions. Phylogenetic analysis showed that the FsCYP51 gene belonged to the CYP51C class, and was closely related to the CYP51C gene of F. verticillioides. At the same time, according to the full length of the gene and CDS, the polyvalent HIGS plant expression vector was constructed, and transformed into sugarcane by particle bombardment,which would lay a foundation for the study of function of FsCYP51 gene and the creation of transgenic sugarcane resistant to Pokkah boeng disease.
Keywords: Fusarium sacchari; CYP51; gene cloning; HIGS; genetic transformation
DOI: 10.3969/j.issn.1000-2561.2021.12.011
甘蔗(Saccharum officinarum L.)屬禾本科甘蔗属植物,是我国最主要的糖料作物[1]。甘蔗梢腐病(pokkah boeng disease)是一种世界分布广泛的真菌性病害[2]。甘蔗镰刀菌(Fusarium sacchari)是中国甘蔗梢腐病的主要病原菌菌之一[3]。近几年由于甘蔗的连年种植以及新台糖系列等易感病品种的大面积推广[4],我国的甘蔗梢腐病呈现爆发的趋势,严重影响了甘蔗的生产和种植区经济的发展,已逐渐成为我国甘蔗的主要病害之一[5-6]。因此对甘蔗梢腐病的防控将是甘蔗产业急需解决的问题。
甾醇14α-去甲基化酶(sterol 14α-demethy¬lase,P45014DM, CYP51)属于细胞色素P450超家族成员,是生物细胞膜形成所需的一个非常重要的酶[7]。CYP51的缺乏将导致细胞膜无法正常形成,最终导致真菌无法正常生长[8]。目前研究人员已在多种病原真菌中发现了CYP51的同源基因,不同真菌的CYP51基因数目是不尽相同的,有的真菌仅含有CYP51A一种,某些真菌如烟曲霉(Aspergillus fumigatus)、构巢曲霉(Aspergillus nidµLans)、稻瘟菌(Magnaporthe oryzae)等有CYP51A和CYP51B两种[9],指状青霉(Penicillium digitatum)[10]、禾谷镰刀菌(Fusarium gramin¬earum)[11]等有CYP51A、CYP51B 和CYP51C三种。通过对CYP51同源基因的功能研究发现CYP51基因的功能非常丰富,在病原菌的抗药性、致病性、孢子产生等方面起着重要作用。例如在引起柑橘腐烂的指状青霉中,PdCYP51A和PdCYP51B基因会影响它的抗药性[10]。在一些丝状真菌如烟曲霉菌[12]、禾谷镰刀菌[13]中发现的同源CYP51基因被证实与病原菌对DMI杀菌剂的敏感性有关,这可能是真菌抗DMI的一种新机制。在禾谷镰刀菌中,FgCYP51A和FgCYP51B都能编码14α-去甲基化酶,FgCYP51B同时对病原菌的子囊孢子形成起重要作用,FgCYP51C不编码14α-脱甲基化酶但对病原菌的毒力至关重要[11]。
寄主诱导的基因沉默(host-induced gene si-lencing, HIGS)是基于RNAi的一种新型抗病育种技术,通过在寄主植物中表达病原菌基因的dsRNA来沉默病原菌中靶标基因的表达达到抗病的效果。HIGS技术不仅可以用来研究病原菌重要致病基因功能,而且也是创制抗病转基因作物的一种新方法,在小麦条锈病[14]、小麦赤霉病[15]、水稻稻瘟病[16]、香蕉枯萎病[17]等的研究中有着充分的运用,但目前HIGS技术在甘蔗上的应用较少,因此建立适用于甘蔗梢腐病菌基因功能研究的HIGS体系是研究甘蔗梢腐病菌致病机制所必需的,也是创制抗病甘蔗新种质的一种快速有效的方法。
利用HIGS技术沉默病原菌CYP51基因表达可以提高转基因作物的抗病性。Koch等[18]利用HIGS技术在拟南芥和大麦中表达了禾谷镰刀菌(F. graminearum)FgCYP51A、FgCYP51B和FgCYP51C基因串联片段的dsRNA,得到的转基因大麦和拟南芥对禾谷镰刀菌的抗性显著提高。目前关于甘蔗镰刀菌CYP51基因的研究尚未见报道,本研究基于课题组分离到的甘蔗梢腐病甘蔗镰刀菌(Fusarium sacchari)野生型菌株CNO-1及其基因组数据,从甘蔗镰刀菌中成功克隆其CYP51基因全长和CDS全长,采用生物信息学方法对其理化性质、基因结构、保守结构域、二级结构、进化关系等进行了分析,同时,基于克隆到的基因全长和CDS全长,选取了保守且特异3个区段作为靶标片段并构建了HIGS多价干扰载体,并成功转化至甘蔗,为研究甘蔗镰刀菌CYP51基因功能和创制抗梢腐病转基因甘蔗的打下基础。
1 材料与方法
1.1 材料
材料:甘蔗梢腐病主要致病菌甘蔗镰刀菌(Fusarium sacchari)菌野生型菌株CNO-1由课题组分离获得,并对其进行了精细基因组测序与序列分析(待发表),获得了FsCYP51基因全长和CDS全长序列。易感梢腐病甘蔗品种‘中蔗1号’由课题组提供。
试剂:反转录试剂盒、各类限制性核酸内切酶、T4-DNA连接酶、DNA Marker购自Takara(大连)公司;琼脂糖凝胶DNA回收试剂盒、质粒提取试剂盒购买自北京天根生化科技有限公司;引物合成、序列测序由生工生物工程(上海)股份有限公司完成;HIGS植物干扰表达载体pBWA(V)BU载体由课题组保存;用于RNA提取用的Trizol试剂购于生工生物工程(上海)股份有限公司;各类PCR Mix购自南京诺唯赞生物科技股份有限公司;平端克隆pEASY®-Blunt Cloning Kit购自北京全式金生物技术有限公司;基因枪(Bio-Rad PDS-1000/He)及其耗材均购自Bio- Rad公司;其他试剂和耗材购自生工生物工程(上海)股份有限公司或國产分析纯试剂。
1.2 方法
1.2.1 基因组DNA和总RNA的提取及cDNA合成 用课题组改良的SDS法提取甘蔗镰刀菌基因组DNA。使用Trizol法提取甘蔗镰刀菌总RNA。用1%琼脂糖凝胶电泳和超微量紫外分光光度计(nanodrop)检测所提取的DNA和RNA的纯度和浓度。使用HiScript II 1st Strand cDNA Synthesis Kit(+gDNA wiper)反转录试剂盒(南京诺唯赞生物科技股份有限公司)进行cDNA合成,反应体系与程序参照试剂盒说明书进行。提取的基因组DNA用于基因全长克隆,逆转录得到的cDNA用于CDS全长克隆。
1.2.2 甘蔗镰刀菌FsCYP51基因全长和CDS全长克隆 根据课题组前期基因组测序的结果,用软件Primer Premier 5分别设计扩增基因全长的特异引物FsCYP51QC-F/R和扩增基因CDS的特异引物FsCYP51CDS-F/R(表1)。用引物FsCYP51QC-F/R和引物FsCYP51CDS-F/R分别以基因组DNA和cDNA为模板进行PCR,将PCR产物进行1%琼脂糖凝胶电泳检测,切胶回收长度符合预期的条带,连接到克隆载体pEASY®-Blunt上,转化大肠杆菌(E. coli)Top10感受态细胞,PCR鉴定阳性克隆后提取质粒送生工生物工程(上海)股份有限公司测序。
1.2.3 FsCYP51基因的生物信息学分析 利用在线分析工具ProtParam(https://web.expasy.org/ protparam/)对FsCYP51蛋白序列进行分析;利用在线软件GSDS2.0[19](http://gsds.gao-lab.org/)对FsCYP51的基因结构进行分析;利用NCBI CDD数据库分析FsCYP51蛋白的保守功能结构域;利用在线软件SignalP-5.0 Server分析FsCYP51蛋白的信号肽;用在线分析软件NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)对FsCYP51蛋白潜在的磷酸化修饰位点进行预测;通过在线软件SOPMA(https://npsa-prabi.ibcp. fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)分析FsCYP51蛋白二级结构;利用在线软件Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/ html/page.cgi?id=index)预测FsCYP51蛋白三级结构;利用在线工具TMHMM Server v2.0(http:// www. cbs.dtu.dk/services/TMHMM/)分析FsCYP51蛋白可能的跨膜结构;运用在线工具CELLO(http://cello.life.nctu.edu.tw/)预测FsCYP51蛋白亚细胞定位;用FsCYP51蛋白序列在NCBI数据库中Blast并下载搜索到的常见镰刀菌CYP51蛋白序列,用MEGA 6软件釆用邻近法(neighbor-joining,bootstrap replications=1000)构建系统进化树。
1.2.4 FsCYP51基因HIGS植物表达载体的构建
根据克隆到的FsCYP51的CDS序列和基因全长序列,选取FsCYP51基因CDS的2个特异区段和UTR区的1个区段,并将这3个区段串联成一个片段作为HIGS靶标片段,串联片段由生工生物工程(上海)股份有限公司进行合成。结合RNAi植物表达载体上的酶切位点,利用Primer Premier 5设计了分别用于扩增正向靶标序列tgtf、反向靶标序列tgtr和连接它们的loop片段的引物tgtf-F/R、tgtr-F/R和loop-F/R(表1),以合成的靶標片段为模板进行PCR,1.5%琼脂糖凝胶电泳后用胶回收试剂盒回收相应的目的片段。将载体pBWA(V)BU用限制性内切酶Eco31 I酶切线性化,3个扩增回收目的的片段用Aar I进行酶切,回收酶切产物。将3个酶切目的片段和线性化载体在同一反应中进行连接,连接体系:T4 DNA Ligase 1 μL,10×Buffer 1 μL,线性化pBWA(V)BU载体1 μL,tgtF片段1 μL,tgtR片段1 μL,loop片段0.5 μL,16 ℃连接过夜,转化Top10感受态细胞后,在含50 mg/L Kan的培养基平板上培养12~14 h,随机挑取单克隆进行菌液PCR鉴定,然后将阳性克隆扩大培养后提取质粒进行测序。
1.2.5 基因枪介导HIGS表达载体遗传转化甘蔗
将测序验证正确的阳性克隆扩大培养,提取大量质粒。参考吴杨[20]的方法转化甘蔗,利用基因枪在71.12 cm汞柱真空度,1100 psi轰击压力和6 cm轰击距离的条件下轰击甘蔗胚性愈伤组织,在含有G418的培养基经过筛选、分化和生根等一系列培养后得到抗性植株,用CTAB法提取抗性植株的基因组DNA,稀释基因组DNA浓度至50 ng/μL,以此为模板,同时以构建好的干扰重组载体质粒为阳性对照,未转化的甘蔗植株基因组DNA为阴性对照,用于溶解DNA的ddH2O作为空白对照,为了提高PCR检测的准确性,根据干扰表达载体序列和靶标基因序列设计如表1中的tgtf-F/R和G418-F/R这2对引物进行PCR检测转基因植株,这2对引物扩增到的预期片段大小分别为645 bp和1660 bp。
2 结果与分析
2.1 FsCYP51的基因全长和CDS克隆
将提取的甘蔗镰刀菌总RNA和基因组DNA用nanadrop测量浓度和纯度,结果显示提取的RNA的浓度在300 ng/µL左右,A260/A280比值在1.9~2.1的范围内,DNA的浓度在700 ng/µL左右,A260/A280比值在1.8~2.0的范围内,1%琼脂糖凝胶电泳显示提取的DNA和RNA的完整
性较好,可以进行下一步实验。用引物FsCYP51 QC-F/R以基因组DNA为模板进行基因全长扩增;用南京诺唯赞反转录试剂盒以RNA为模板进行cDNA合成,然后用引物FsCYP51CDS-F/R以得到的cDNA为模板进行CDS全长扩增。PCR产物经琼脂糖凝胶(图1),可以得到长度分别为2000 bp左右的基因全长片段和1500 bp左右的CDS全长片段,回收相应的片段连接到克隆载体,用M13通用引物对阳性重组质粒进行测序,结果显示克隆到的FsCYP51的基因全长和CDS全长与基因组的数据是一致的,FsCYP51基因全长1947 bp,CDS全长1554 bp,编码517个氨基酸。
2.2 FsCYP51基因的生物信息学分析
2.2.1 FsCYP51基因结构分析及其编码蛋白的理化性质分析 将克隆到的FsCYP51基因全长和CDS全长通过在线软件GSDS2.0进行基因结构分析(图2),结果显示FsCYP51基因编码区由3个外显子和2个内含子组成。利用ProtParam在线分析软件对FsCYP51蛋白氨基酸进行理化性质分析。FsCYP51蛋白由517个氨基酸组成,理论分子量为58.61 kDa,理论等电点pI=6.61。不稳定指数为42.87,说明该蛋白的稳定性较差。此外,脂肪族氨基酸指数达83.52,总平均亲水指数为–0.239,说明该蛋白为亲水性蛋白。利用程序ProtScale对FsCYP51蛋白氨基酸的亲水性进行在线分析,组成FsCYP51蛋白的氨基酸多为亲性氨基酸,表明该蛋白有较强的亲水性。
2.2.2 FsCYP51蛋白信号肽、跨膜结构及亚细胞定位预测 用在线工具TMHMM Server v. 2.0对FsCYP51蛋白的跨膜结构进行了预测(图3),发现在FsCYP51蛋白第26位至第45位氨基酸和第57位至第77位氨基酸可能是2个跨膜螺旋,由此推测FsCYP51蛋白为跨膜蛋白。通过SignalP-5.0对FsCYP51蛋白进行分析,发现其不含有信号肽,表明FsCYP51蛋白不是分泌型蛋白。通过在线工具CELLO v.2.5预测FsCYP51蛋白的亚细胞定位,预测结果显示FsCYP51蛋白定位在细胞质膜、溶酶体、细胞质、线粒体、叶绿体的可能性分别为1.953、0543、0.489、0.374、0.369,预测FsCYP51蛋白定位在细胞膜。
2.2.3 FsCYP51基因编码氨基酸磷酸化修饰的预测和分析 通过在线分析软件NetPhos 3.1 Server将FsCYP51蛋白的氨基酸序列进行磷酸化修饰预测。结果显示,FsCYP51蛋白质的多个氨基酸位点可以发生潜在的磷酸化修饰,预测FsCYP51蛋白质中有20个Ser(丝氨酸)位点可发生磷酸化修饰,有17个Thr(苏氨酸)位点可发生磷酸化修饰,9个Tyr(酪氨酸)位点可发生磷酸化修饰(图4)。此外发现FsCYP51蛋白可能存在cdc2蛋白激酶的4个Ser和3个Thr磷酸化位点,而且可能存在蛋白激酶C(PKC)的4个Ser和7个Thr磷酸化位点,推测FsCYP51蛋白可能需要进行磷酸化修饰来激发其活性。
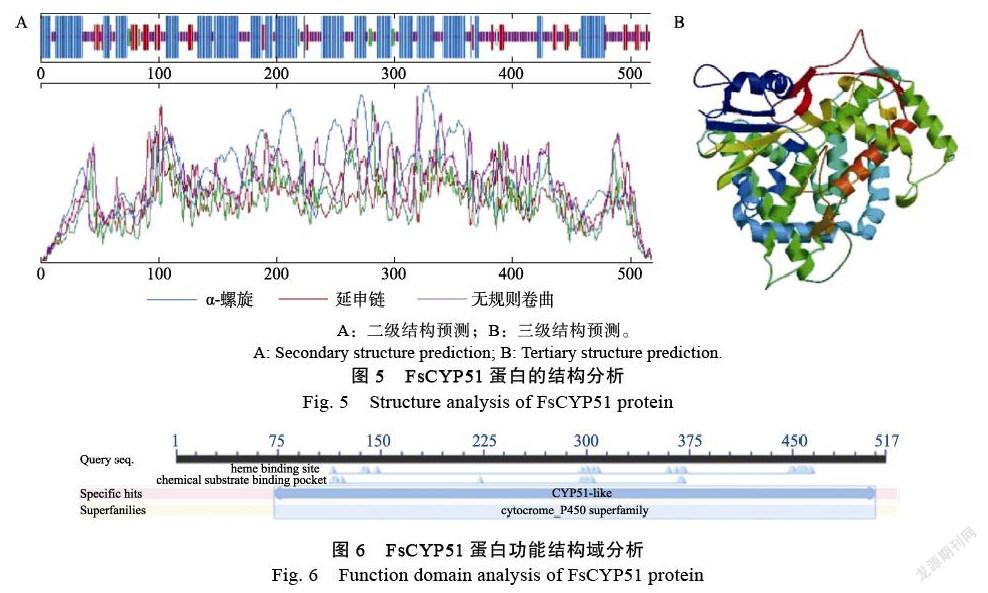
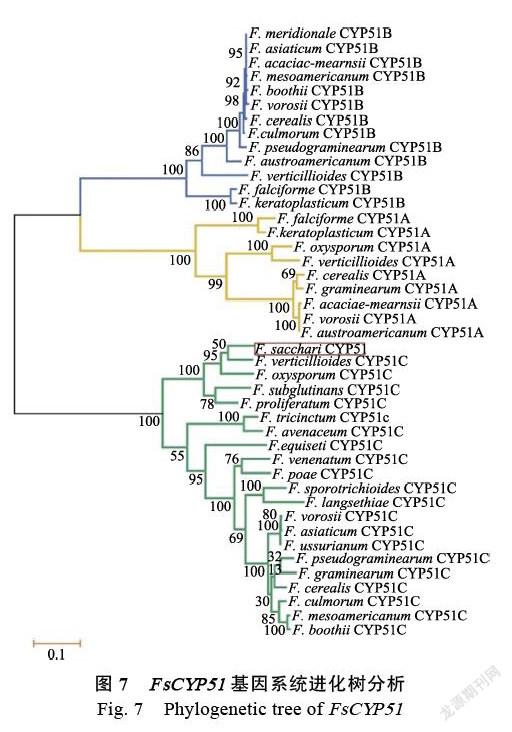
2.2.4 FsCYP51蛋白二级结构、三级结构和功能结构域分析 将甘蔗梢腐病菌FsCYP51蛋白通过SOPM和Phyre2进行二级结构(图5A)和三级结构分析(图5B),结果表明FsCYP51蛋白的二级结构有α-螺旋、延伸链、β-转角和无规则卷曲,分别占比47.97%、11.61%、3.09%和37.33%。因此FsCYP51蛋白的二级结构主要以α-螺旋和无规卷曲的结构形式存在。利用NCBI的CDD功能分析FsCYP51蛋白的保守结构域(图6),发现在其第72位至第510位氨基酸序列之具有CYP51- like保守结构域,说明该蛋白属于p450家族中的CYP51蛋白。
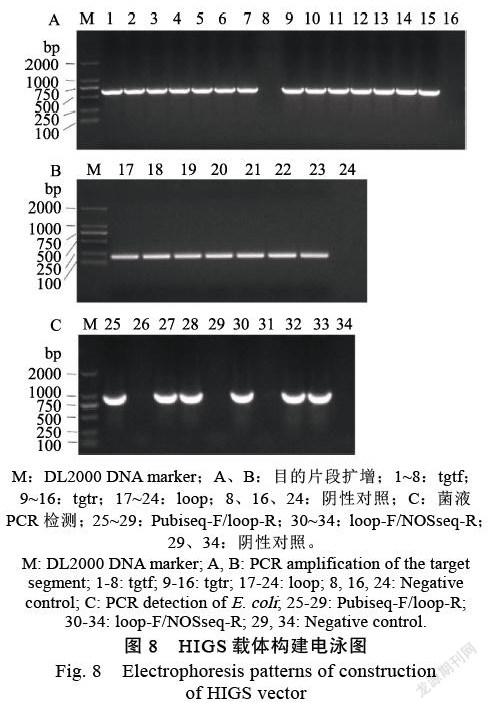
2.2.5 FsCYP51基因系统进化树构建分析 为了解FsCYP51基因在镰刀菌中的进化情况,用FsCYP51蛋白序列在NCBI数据庫中进行BLAST,下载了常见镰刀菌的CYP51蛋白。利用MEGA 6选择邻近法构建系统进化树(图7)。可以明显地看出系统进化树按照CYP51A、CYP51B和CYP51C这三类分为3个分支,FsCYP51基因属于CYP51C这一类基因。其中F. sacchari CYP51(FsCYP51)与串珠镰刀菌F. verticillioides CYP51C、尖孢镰刀菌F. oxysporum CYP51C、顶腐病菌F. subglutinans CYP51C和层出镰刀菌F. proliferatum CYP51C基因在CYP51C类的同一小簇中,说明它们的同源性更高,表明这5个基因在进化关系上更为接近,物种进化关系较为密切。其中FvCYP51与FsCYP51的同源性最高,表明这2个真菌在物种进化过程中亲缘关系更近。
2.3 FsCYP51基因HIGS植物表达载体的构建
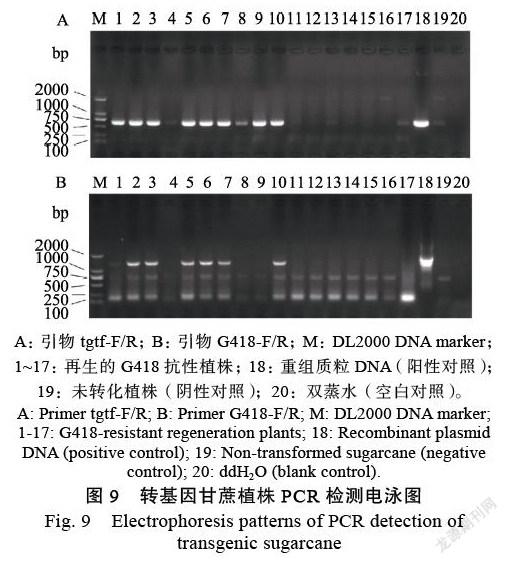
根据干扰载体pBWA(V)BU和多价靶标片段的序列,设计了3对带有酶切位点的引物(表1)。以含有多价靶标序列的克隆载体为模板进行PCR扩增正向靶标序列(tgtF)和反向靶标序列(tgtR)(图8A),以含有loop序列的干扰载体pBWA(V) BU为模板扩增loop序列(图8B)。将上述PCR产物进行1.5%琼脂糖凝胶电泳,分别切胶纯化回收大小符合的条带,可获得带有相应酶切位点的大小分别为645 bp、645 bp和200 bp的正向靶标片段、反向靶标片段和loop片段。测量纯度和浓度后,将载体pBWA(V)BU用限制性内切酶Eco31 I酶切线性化,3个扩增回收目的的片段用Aar I进行酶切,回收酶切产物。将3个酶切目的片段和线性化载体在同一反应中进行连接,然后转化Top10感受态细胞。根据载体序列和loop序列设计分别设计了用来检测正向靶标序列(Pubiseq-F/ loop-R)和反向靶标序列的两组引物(表1)。随机选取若干个转化后在抗性平板上长出的单菌落进行菌液PCR鉴定,预期扩增的片段大小分别为929 bp和960 bp,电泳结果(图8C)与预期的大小一致。提取阳性菌液质粒,用限制性内切酶酶Eco32I进行酶切验证,酶切产物电泳结果与预期结果一致。提交阳性质粒至生工生物工程(上海)股份有限公司测序,测序结果与预期一致,FsCYP51基因HIGS植物表达载体构建成功,可用于遗传转化甘蔗研究。
2.4 转基因植株的PCR鉴定
用改良CTAB法提取的抗性植株基因组DNA,以其为模板,同时分别以重组干扰载体作为阳性对照,以未转基因甘蔗为阴性对照,以用于溶解基因组DNA的ddH2O为空白对照,用引物tgtf-F/R和G418-F/R进行PCR检测。引物tgtf-F/R和引物G418-F/R的PCR产物电泳结果显示分别有8株(图9A)和7株(图9B)抗性植株的基因组DNA扩增到了相应预期大小的条带,而阴性对照和空白对照没有对应的电泳条带,综合2对引物的PCR鉴定均为阳性的结果,表明HIGS载体上的外源DNA片段已整合到甘蔗基因组中。
3 讨论
CYP51首次是从酿酒酵母(Saccharomyces cerevisiae)中分离获得[21],并且在动物(大鼠)[22]、植物(高粱)[23]、细菌(结核分枝杆菌)[24]中相继被发现,是分布最广的P450家族成员。目前研究者已在多种病原镰刀菌如禾谷镰刀菌(F. gra-minearum)、串珠镰刀菌(F. verticillioides)和尖胞镰刀菌(F. oxysporum)等中发现了CYP51A、CYP51B、CYP51C这3个同源基因[25]。研究表明CYP51C基因是镰刀菌属物种特有的,可以作为鉴定镰刀菌属的一个特殊标记基因[11]。本研究根据课题组对分离得到的甘蔗梢腐病菌(Fusarium sac-chari)野生型菌株CNO-1的基因组测序结果,成功克隆到甘蔗梢腐病菌FsCYP51基因全长和CDS全长,对其序列进行了相关的生物信息学分析。
本研究对FsCYP51蛋白的亲水性、蛋白理化性质、氨基酸磷酸化修饰、蛋白二级结构、蛋白跨膜结构、亚细胞定位预测以及系统进化树等进行预测或分析。氨基酸的亲疏水性可以反映蛋白质的折叠情况,在潜在的跨膜区域会出现疏水区,在保持蛋白质的三级结构上起重要作用,而且蛋白的亲疏水性图谱可为蛋白跨膜区域的鉴定提供参考。蛋白跨膜结构域为膜蛋白与膜脂相结合的主要部位。FsCYP51蛋白氨基酸多为亲水性氨基酸,结构上最主要是α-螺旋。通过结合蛋白亲水性分析和跨膜结构预测结果,说明FsCYP51蛋白可能为跨膜蛋白,这与禾谷镰刀菌中的研究是一致的[26]。亚细胞定位预测结果显示FsCYP51蛋白可能定位在细胞膜中,这也符合其为膜结合蛋白的特征[27]。
研究表明禾谷镰刀菌(F. graminearum)中的3个CYP51基因有着不同的功能,FgCYP51A和FgCYP51B编码14α-脱甲基酶,FgCYP51B同时对病原菌的子囊孢子形成起重要作用,FgCYP51C不编码14α-脱甲基酶但对病原菌的毒力至关重要[11]。而在甘蔗镰刀菌(F. sacchari)中只鉴定到1个CYP51基因,经过序列比对和系统进化树分析,可以看出FsCYP51属于CYP51C这一类基因,这与其为镰刀菌的鉴定结果是一致的。FsCYP51与FvCYP51C的同源性最高,达到了84.53%,这也符合这2个物种更为接近的亲缘关系。甘蔗镰刀菌中没有CYP51A和CYP51B这2个基因,推测FsCYP51这个基因的功能可能会更加丰富,不仅仅编码14α-脱甲基酶,可能还与病原菌致病性、毒力、子囊孢子形成等密切相关,这将是下一步研究的重点,所以构建了HIGS植物表达载体,并成功转化甘蔗,为进一步探究甘蔗镰刀菌中CYP51基因的功能和创制抗梢腐病的转基因甘蔗打下基础。同时HIGS技术在甘蔗抗梢腐病研究中的应用还未见报道,本研究是在甘蔗中转入甘蔗梢腐病菌重要基因干扰片段来进行HIGS试验,具有重要的理论意义与应用价值。
参考文献
[1] Chen R K, Yuan Z N. Sugarcane production and research in China[J]. International Sugar Journal, 2010, 112(1340): 452-457.
[2] Leslie J F. Mating populations in Gibberella fujikuroi (Fusarium section Liseola)[J]. Phytopathology, 1991, 81(9): 1058-1060.
[3] Meng J R, Huang H J, Li Y X, et al. First report of Fusarium sacchari causing sugarcane pokkah boeng in China[J]. Plant Disease, 2020, 104(5): 1553-1554.
[4] 古幸灵, 杨欣欣, 黄 治, 等. 甘蔗梢腐病流行原因及综合防治对策[J]. 乡村科技, 2020(11): 82-83.
[5] 王泽平, 陈 奕, 孙海军, 等. 广西甘蔗主栽品种梢腐病田间抗性初步评价[J]. 熱带作物学报, 2016, 37(5): 952-957.
[6] 卢文洁. 甘蔗梢腐病的发生及综合防治措施[J]. 作物杂志, 2007(2): 92.
[7] Yoshida Y, Aoyama Y, Noshiro M, et al. Sterol 14-demethylase P450 (CYP51) provides a breakthrough for the discussion on the evolution of cytochrome P450 gene superfamily[J]. Biochemical and biophysical research com-munications, 2000, 273(3): 799-804.
[8] Lepesheva G I, Waterman M R. CYP51—the omnipotent P450[J]. Molecular and cellular endocrinology, 2004, 215 (1-2): 165-170.
[9] Lepesheva G I, Waterman M R. Sterol 14α-demethylase cytochrome P450 (CYP51), a P450 in all biological king-doms[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2007, 1770(3): 467-477.
[10] Sun X, Wang J, Feng D, et al. PdCYP51B, a new putative sterol 14α-demethylase gene of Penicillium digitatum in-volved in resistance to imazalil and other fungicides inhibit-ing ergosterol synthesis[J]. Applied microbiology and bio-technology, 2011, 91(4): 1107-1119.
[11] Fan J, Urban M, Parker J E, et al. Characterization of the sterol 14α‐demethylases of Fusarium graminearum identi-fies a novel genus‐specific CYP51 function[J]. New Phy-tologist, 2013, 198(3): 821-835.
[12] Martel C M, Parker J E, Warrilow A G, et al. Complementa-tion of a Saccharomyces cerevisiae ERG11/CYP51 (sterol 14α-demethylase) doxycycline-regulated mutant and screening of the azole sensitivity of Aspergillus fumigatus isoenzymes CYP51A and CYP51B[J]. Antimicrobial agents and chemotherapy, 2010, 54(11): 4920-4923.
[13] Liu X, Yu F, Schnabel G, et al. Paralogous cyp51 genes in Fusarium graminearum mediate differential sensitivity to sterol demethylation inhibitors[J]. Fungal Genetics and Bi-ology, 2011, 48(2): 113-123.
[14] Qi T, Zhu X, Tan C, et al. Host‐induced gene silencing of an important pathogenicity factor PsCPK1 in Puccinia striiformis f. sp. tritici enhances resistance of wheat to stripe rust[J]. Plant biotechnology journal, 2018, 16(3): 797-807.
[15] Cheng W, Song X S, Li H P, et al. Host‐induced gene si-lencing of an essential chitin synthase gene confers durable resistance to Fusarium head blight and seedling blight in wheat[J]. Plant biotechnology journal, 2015, 13(9): 1335- 1345.
[16] 王梦颖, 刘 敬, 瞿绍洪, 等. 水稻抗稻瘟菌HIGS表达载体的构建及遗传转化[J]. 植物保护, 2015, 41(3): 73-78+ 114.
[17] Ghag S B, Shekhawat U K, Ganapathi T R. Host‐induced post‐transcriptional hairpin RNA‐mediated gene silencing of vital fungal genes confers efficient resistance against Fusarium wilt in banana[J]. Plant biotechnology journal, 2014, 12(5): 541-553.
[18] Koch A, Kumar N, Weber L, et al. Host-induced gene si-lencing of cytochrome P450 lanosterol C14α-demethylase– encoding genes confers strong resistance to Fusarium spe-cies[J]. Proceedings of the National Academy of Sciences, 2013, 110(48): 19324-19329.
[19] Hu B, Jin J, Guo A-Y, et al. GSDS 2.0: an upgraded gene feature visualization server[J]. Bioinformatics, 2014, 31(8): 1296-1297.
[20] 吳 杨. 斑茅DREB2B基因遗传转化甘蔗的抗旱性研究[D]. 福州: 福建农林大学, 2009.
[21] Yoshida Y, Aoyama Y. Yeast cytochrome P-450 catalyzing lanosterol 14α-demethylation I. Purification and spectral properties[J]. Journal of Biological Chemistry, 1984, 259(3): 1655-1660.
[22] Trzaskos J M, Kawata S, Gaylor J L. Microsomal enzymes of cholesterol biosynthesis. Purification of lanosterol 14 α-methyl demethylase cytochrome P-450 from hepatic microsomes[J]. Journal of Biological Chemistry, 1986, 261(31): 14651-14657.
[23] Kahn R A, Bak S, Olsen C E, et al. Isolation and reconstitution of the heme-thiolate protein obtusifoliol 14α-demethylase from Sorghum bicolor (L.) moench[J]. Journal of Biological Chemistry, 1996, 271(51): 32944-32950.
[24] Bellamine A, Mangla A T, Nes W D, et al. Characterization and catalytic properties of the sterol 14α-demethylase from Mycobacterium tuberculosis[J]. Proceedings of the National Academy of Sciences, 1999, 96(16): 8937-8942.
[25] Ma L-J, Van Der Does H C, Borkovich K A, et al. Comparative genomics reveals mobile pathogenicity chromosomes in Fusarium[J]. Nature, 2010, 464(7287): 367-373.
[26] 孙晓梅, 黄金光. 禾谷镰刀菌致病性蛋白CYP51C cDNA克隆及生物信息学分析[J]. 山东农业科学, 2015, 47(09): 1-6.
[27] 杨娇艳, 廖明军, 杨 劭. 甾醇14α-去甲基化酶(CYP51)的研究进展[J]. 生物工程学报, 2008(10): 1681-1688.
责任编辑:沈德发

