海南青枯病抗、感桑品种根际土壤真菌群落多样性分析
涂娜娜 武华周 娄德钊 卢芙萍 耿涛 王树昌



摘 要:通过比较青枯病抗、感桑品种根际土壤真菌群落结构与多样性差异,分析根际真菌群落与桑树青枯病抗性的相关性。采用Illumina Miseq高通量测序技术,对青枯病抗性桑品种‘抗青283’ב抗青10’和易感桑品种‘强桑1号’根际土壤真菌群落ITS1-ITS2区域进行扩增、测序,分析了2种桑品种根际真菌群落结构与多样性。(1)‘抗青283’ב抗青10’根际优势菌门主要为囊菌门(54.86%)、担子菌门(24.67%)、接合菌门(3.17%),优势菌属主要为淡紫拟青霉属(5.71%)、镰孢菌属(5.43%)、旋孢腔菌属(1.29%);‘强桑1号’根际优势菌门主要为囊菌门(68.04%)、担子菌门(15.12%)、接合菌门(1.90%),优势菌属主要为腐质霉属(8.46%)、镰孢菌属(5.44%)、旋孢腔菌属(2.22%)。(2)抗性品种根际土壤中起重要作用的真菌群落为:海壳科、小皮伞科、球囊霉目_f_uncultured,而易感品种根际土壤中起重要作用的真菌群落为:毛孢壳目、赤壳科、干朽菌科、Cantharellales-fam-incertae-sedis。(3)抗性品种根际检测到淡紫拟青霉属和丛枝菌根真菌球霉菌目均为广泛应用的生防菌,推测与其抗性有直接关系。虽然2种桑品种根际土壤优势真菌群落丰度无显著差异,但抗性品种根际检测到丰度更高的淡紫拟青霉属和丛枝菌根球霉菌目,可能与其抗性有关。该研究结果为海南桑青枯病拮抗真菌的筛选与防控技术的研究奠定了基础。
关键词:桑树;根际土壤;真菌群落;多样性;生物防治
中圖分类号:S154.3;S888.71 文献标识码:A
Abstract: The structure and diversity of fungi communities in mulberry rhizosphere soil were analyzed to indicate the correlation with resistance and susceptibility to bacterial wilt. The ITS1-ITS2 region of fungi were amplified and se-quenced to analyze the structure and diversity of fungi communities in resistant mulberry variety ‘Kangqing 283’ × ‘Kangqing 10’ and susceptible mulberry variety Qiangsang 1 by Illumina miseq high-throughput sequencing technology. The dominant phylum of ‘Kangqing 283’ × ‘Kangqing 10’ were Cystophyta (54.86%), Basidiomycota (24.67%) and Zygomycota (3.17%), while the dominant genus Paecilomyces (5.71%), Fusarium (5.43%) and Cochilobolus (1.29%). The dominant phylum in ‘Qiangsang 1’ were Cystophyta (68.04%), Basidiomycota (15.12%) and Zygomycota (1.90%), while the dominant genus Pythium (8.46%), Fusarium (5.44%) and Cochilobolus (2.22%). The most important fungi communities in the rhizosphere soil of resistant varieties were Conchochaetales, Crustaceaceae and uncultured families of Angiosporaceae, while Coniochaetales, Crustaceaceae, Serpulaceae and Cantharellales-fam-incertae-sedis in the sensitive varieties. Paecilomyces and arbuscular mycorrhizal fungi Coccidiales are widely used as the biocontrol fungi, which were found as the dominant fungi in the rhizosphere soil of resistant varieties and might be directly related to the resistance. Although there were no significant differences in the fungi communities abundance of the two mulberry varieties, the dominant fungi such as Penicillium and arbuscular mycorrhizal Angiocystidea detected in the resistant varieties were closely related with its resistance. The results yield insights to screen antagonistic fungi and effective control methods against mulberry bacterial wilt in Hainan province.
Keywords: mulberry; rhizosphere soil; fungi community; diversity; biological control
DOI: 10.3969/j.issn.1000-2561.2021.12.038
土壤为植物的生长提供必需的营养元素和水分,是植物健康生长生存的基础,植物在生长过程中通过根系分泌物也向土壤中释放各种有机和无机物质,对土壤微生物种群多样性、数量和分布有很大的影响[1]。土壤微生物组成的多样性和种群功能是衡量植物健康生长与否的重要指标[2],土壤微生物可通过与病原菌进行竞争、拮抗等作用抑制病原菌的生长防止作物病害的发生,微生物群落结构丰富度及多样性越高,在对抗病原菌时发挥的作用就越明显[3]。但是,土壤微生物也可通过积累大量的病原菌导致植株染病死亡[4],许多土传病害的发生与微生物有非常密切的关系。王茹华等[5]研究表明,植物对土传病害表现出的抗性与根际真菌有密切关系;刘先良[6]、董朝霞等[7]研究发现接种丛枝菌根真菌能提高植株对青枯病的抗性并能促进植株生长;龚云丽等[8]研究发现丛枝菌根真菌对青枯雷尔氏菌(Ralstonia solanacearum)有抑制作用;张深[9]通过平板拮抗实验筛选出的15株对烟草青枯病有抑制作用的菌株中,分泌抗菌活性物质最强的2株均为真菌菌株;董夏伟[10]用滤纸法从59株真菌中分离出2种对烟草青枯病菌有较好抑制作用的拮抗真菌烟曲霉(Aspergillus fumigatus)和浅黄新萨托菌(Neosartorya aureola),抑菌圈直径分别为10 mm和9.5 mm,經过反复拮抗试验表明抑菌圈直径无明显差异;黎起秦等[11]筛选到5株经鉴定对西瓜枯萎病、番茄青枯病有抑制活性的康氏木霉菌,且在人工接种条件下仍有防效。
桑青枯病是华南地区桑园的毁灭性土传病害[12-13],在海南连作桑园的发病率高达85%以上,严重影响蚕桑生产,造成巨大损失,已成为海南桑产业发展的主要制约因素,亟待研究解决热区桑青枯病绿色高效防控技术。本研究以海南省琼中县主载桑树抗性品种‘抗青283’ב抗青10’(QZ1K)和易感桑品种‘强桑1号’(QZ1Q)为研究对象,从桑树根际土壤微生态角度出发,通过高通量测序技术对抗、感桑树根际土壤真菌群落多样性及分布规律等进行分析,旨在探究不同抗性桑树品种根际土壤真菌的物种组成和差异,分析真菌群落多样性与桑树抗、感青枯病之间的关系,为今后海南省桑青枯病拮抗真菌的筛选与有效利用奠定基础。
1 材料与方法
1.1 材料
2019年7月在琼中红毛镇牙挽农场采集桑树土壤样品,土质为砂砾土。采样点信息:19°00′10″ N,109°38′46″ E,海拔368 m,pH 5.93,有机质0.4279 g/kg,土壤有机质58.12 g/kg、电导率205 uS/cm、盐分115 g/kg、总悬浮物(TSS)100 mg/L,全钾865.34 g/kg,全磷19 496.83 g/kg。采用五点取样法,随机选取‘抗青283’ב抗青10’(QZ1K)和易感桑品种‘强桑1号’(QZ1Q)各5株,挖取植株地下10~20 cm根系,抖落较大块土壤后,用软毛刷刷取根表面0~5 mm的土壤于样品袋中,混合均匀后分装进4个5 mL冻存管中分别编号为QZ1K1~QZ1K4和QZ1Q1~ QZ1Q4,置于冰盒,–80 ℃冰箱保存备用。
1.2 方法
1.2.1 土壤根际样品微生物DNA的提取 取充分混合后的土壤根际样品0.5 g,采用QIAamp 96 PowerFecal QIAcube HTkit(13)试剂盒按照说明书提取根际土壤DNA,之后用琼脂糖凝胶电泳检测DNA的纯度和浓度。
1.2.2 基因扩增与测序 TaKaRa公司的Takara Ex Taq高保真酶进行PCR,利用ITS1-ITS2区域(引物ITS1F 5¢-CTTGGTCATTTAGAGGAAGTA A-3¢和ITS2 5¢-GCTGCGTTCTTCATCGATGC-3¢)进行扩增[6]。PCR扩增体系:25 µL 2×Premix Taq(TakaraBiotechnology),引物各1 µL(10 mmol/L),DNA模板3 µL(20 ng/µL),加ddH2O溶解定容至50 µL。PCR反应程序:预变性94 ℃ 5 min;变性94 ℃ 30 s,退火52 ℃ 30 s,延伸72 ℃ 30 s,30个循环;延伸72 ℃ 10 min。采样琼脂糖电泳检测,利用Qubit 2.0 DNA检测试剂盒精确定量回收产物并进行测序。
1.3 数据处理
使用Trimmomatic(Version 0.35)软件首先把原始数据(raw data)质量部分进行剪切,拼接继而得到整条的paried end序列。使用QIIME的split-libraries(version1.8.0)软件得到clean tags序列。去除非特异性序列和嵌合体,得到valid tags序列。对质控得到的质量较高的序列valid tags使用vsearch(version 2.4.2)软件按照97%的相似度进行OTU(操作分类单元)分类,并选取每个OTU种丰度最大序列作为该OTU的代表序列,采用RDP classifier Native Bayesian分类算法对代表序列与数据进行对比注释,得到OTU的注释信息。使用BioVenn在线软件进行Flower图绘制;对2个样本测序数据各取平均值后,使用Excel 2013和SPSS19.0软件对相对丰度数据进行统计分析,绘制相对丰度柱状图;使用Qiime软件观测物种数、Chao1指数、Shannon指数、Simpson指数、PDwhole指数、Goods_coverage指数等多样性指数,稀释曲线图用R软件绘制。通过LDA对根际细菌群落进行LEFSE分析(LDA Score2.5)寻找不同样地桑树根际土壤真菌群落差异。用FUNGuild软件对测序得到的2个样本的OTU进行营养型类别分析。
2 结果与分析
2.1 OTU聚类分析
原始数据经过优化处理后共得到266 777条高质量序列,单一样本序列数在24 264~40 473条之间。在97%的相似度水平上对2种桑树的OTU进行聚类分析,得到2604个OTU,共分析鉴定出9个门、33个纲、96个目、184个科、319个属、592个种。由图1 QZ1K和QZ1Q根际土壤真菌群落OTU flower图可知,QZ1K和QZ1Q根际土壤
真菌共有OTUs 107个,QZ1K根际土壤真菌特有OTUs分别为371、307、483、530个,分别占其总数的77.62%、74.15%、81.86%、83.2%;QZ1Q根际土壤真菌特有OTUs分别为382、550、342、455个,占其总数的78.12%、83.71%、76.17%、80.96%。
2.2 Alpha多样性分析
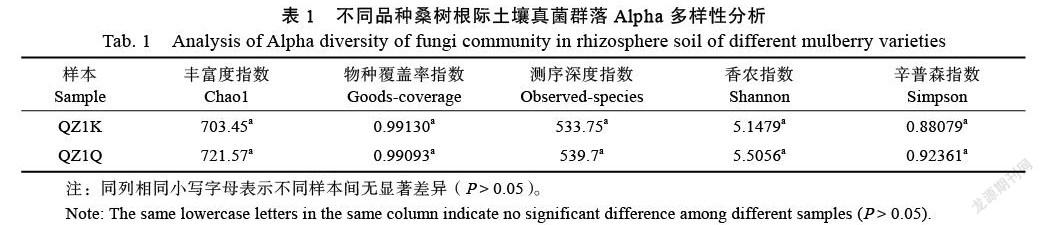
Chao1指数和Observed-species指数反映样本中物种的丰富度,其值越高代表群落物种越丰富。由图2 Chao1指数和Observed-species指数稀释曲线可知,真菌群落丰富度与测序的深度呈正相关,随着测序深度的增加而增加,最后逐渐趋于平稳,说明测序深度已覆盖样品中的所有物种,测序合理。对QZ1K和QZ1Q样本的Alpha多样性进行统计分析(表1),各样本间除Good-coverage指数外其余各指数均无显著差异。
2.3 不同品种根际土壤真菌群落结构分析
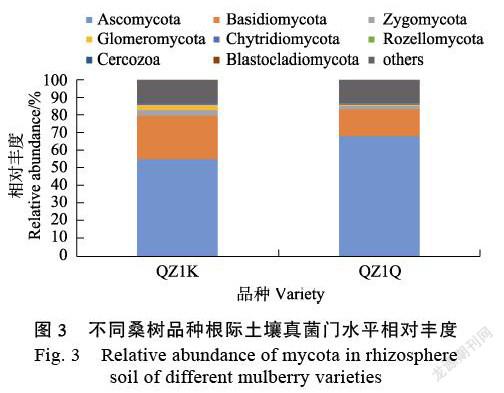
2.3.1 门水平根际土壤真菌群落结构分析 由图3可知,在门水平分类上,QZ1K和QZ1Q桑树品种根际土壤中的真菌群落Others-Top30优势菌门为:子囊菌门(Ascomycota)分别为54.86%和68.04%,担子菌门(Basidiomycota)分别为24.67%和15.12%,接合菌门(Zygomycota)分别为3.17%和1.90%,球囊菌门(Glomeromycota)分别为2.92%和0.80%,壶菌门(Chytridiomycota)分别为1.12%和0.81%,其他类群分别为13.25%和13.30%。其中,根际土壤中担子菌门(Basidiomycota)、接合菌门(Zygomycota)、球囊菌门(Glomeromycota)、壶菌门(Chytridiomycota)相对丰度QZ1K高于QZ1Q。
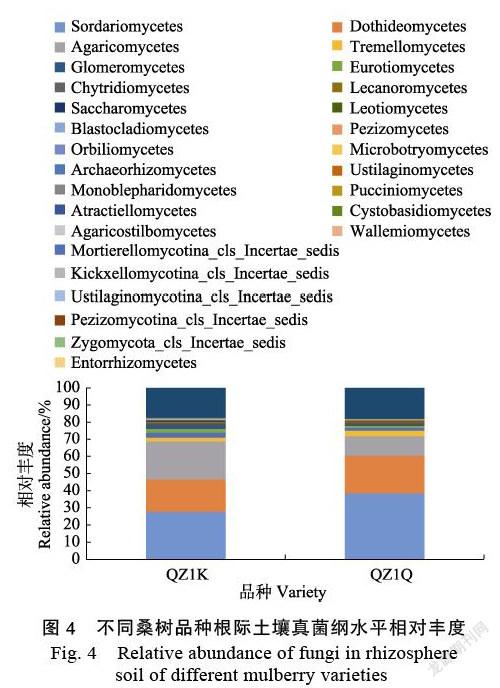
2.3.2 纲水平根际土壤真菌群落结构分析 由图4可知,在纲水平分类上,QZ1K和QZ1Q桑树品种根际土壤中的真菌群落组成Others-Top30优势菌纲为:粪壳菌纲(Sordariomycetes)分别为27.68%和38.49%,座囊菌纲(Dothideomycetes)分别为18.95%和21.93%,伞菌纲(Agaricomy¬cetes)分别为22.04%和11.35%,银耳纲(Tremello¬mycetes)分别为2.28%和3.29%,Mortierello¬mycotina分别为2.90%和1.63%,散囊菌纲(Eurotiomycetes)分别为2.30%和1.24%,球囊菌纲(Glomeromycetes)分别为2.43%和0.75%,其他类群分别为18.08%和18.70%。其中根际土壤中银耳纲(Tremellomycetes)、Mortierellomycotina、散囊菌纲(Eurotiomycetes)、球囊菌纲(Glomeromycetes)的相对丰度QZ1K高于QZ1Q。
2.3.3 属水平根际土壤真菌群落结构分析 由图5可知,在属水平分类上,QZ1K和QZ1Q桑树品种根际土壤中真菌群落组成Others-Top30主要为:镰孢菌属(Fusarium)分别5.43%和5.84%,腐质霉属(Humicola)分别为0.46%和8.46%,淡紫拟青霉属(Purpureocillium)分别为5.71%和0.01%,旋孢腔菌属(Cochilobolus)分别为1.79%和2.22%,拟盘多毛孢属(Pestalotiopsis)分别为1.72%和2.09%,Galerella分别为0.01%和3.21%,木霉属(Trichoderma)分别为0.51%和1.39%,斜盖伞属(Clitopilus)分别为1.54%和0.32%,被孢霉属(Mortierella)分别为0.78%和1.01%,漆斑菌属(Myrothecium)分别为1.21%和0.36%,其他属分别为76.92%和72.98%。其中,根际土壤中淡紫拟青霉属(Purpureocillium)、斜盖伞属(Clitopilus)、被孢霉属(Mortierella)的相对丰度QZ1K高于QZ1Q。
2.4 桑树根际土壤优势真菌差异分析
使用LEfSe分析抗性品种QZ1K和易感品种QZ1Q根际土壤中真菌群落的主要差异物种(LDA Score的预设值为2.5,小于2.5视为没有差异)发现,抗性品种QZ1K根际土壤中小皮伞属(Marasmius)、小皮伞科(Marasmiaceae)、海壳科(Halosphaeriaceae)、球囊霉目_f_uncultured、瓶霉属(Phialophora)、球囊霉目_f_uncultured_g_ uncultured的相对丰度显著高于易感品种QZ1Q,而赤壳科(Nectriaceae)、赤壳科_g_uncultured、Cantharellales-fam-incertae-sedis、Minimedusa、被孢霉科_g_uncultured、干朽菌科(Serpulaceae)、干腐菌属(Serpula)、毛孢壳目(Coniochaetales)这几类真菌群落在易感品种QZ1Q根际土壤中的相对丰度显著高于抗性品种QZ1K(图6A)。抗性品種QZ1K根际赤壳科LDA值最大,易感品种QZ1Q根际小皮伞属LDA值最大,可见这2个真菌群落在抗性品种QZ1K和易感品种QZ1Q根际土壤中的差异最大。抗性品种QZ1K根际土壤中起重要作用的真菌群落为:海壳科、小皮伞科、球囊霉目_f_uncultured_,而易感品种QZ1Q根际土壤中起重要作用的真菌群落为:毛孢壳目(Coniochaetales)、赤壳科(Nectriaceae)、干朽菌科(Serpulaceae)、Cantharellales-fam-incertae- sedis(图6B)。
2.5 真菌营养型分类
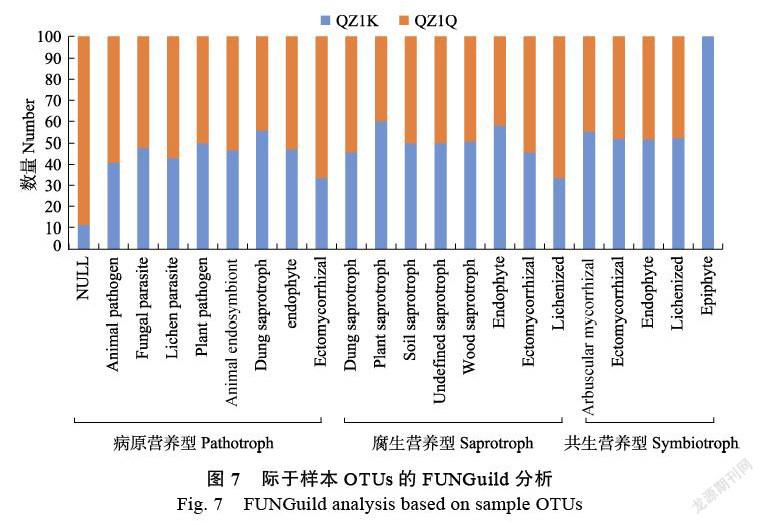
用FUNGuild软件对抗性品种QZ1K和易感品种QZ1Q的OTU进行营养型类别分析,主要划分为3类:病原营养型、腐生营养型和共生营养型。其中Highly Probable(1个)和Probable(98个)为病原营养型真菌共有99个,属于植物病原菌的有74个,属于动物病原菌的有8个;Highly Probable(19个)和Probable(227个)为腐生营养型共246个;Highly Probable(129个)和Probable(19个)为共生营养型共148个,属于外生菌根真菌的有41个,属于外生菌根真菌的有11个。进一步分类得到22个Guild(图7),抗性品种‘抗青283’ב抗青10’根际真菌病原营养型真菌数量相对较多,而易感品种‘强桑1号’根际聚集了相对较多的腐生营养型和共生营养型真菌。
3 讨论
根际真菌作为根际微生物的主要成员,其多样性、活性、相互间的复杂性对植物的生长和抗性起决定性作用[14-15]。因此,对根际真菌群落的结构和多样性分析在生产中具有重要意义。
本研究以海南省琼中县主栽桑树抗性品种‘抗青283’ב抗青10’(QZ1K)和易感桑品种‘强桑1号’(QZ1Q)为研究对象,对其根际土壤真菌群落多样性研究发现根际真菌群落多样性差异未达到显著水平,这可能与相近植被和气候以及土壤条件下,真菌群落的组成具有较高的相似性有关[16]。在门水平,子囊菌门、担子菌门、接合菌门、球囊菌门和壶菌门等为2个样本根际土壤真菌的优势菌门,分别占‘抗青283’ב抗青10’和‘强桑1号’根际真菌门整体的86.74%和86.67%,与王艳云等[17-20]的研究结果相似。在土壤根际真菌群落属水平,优势菌属主要分布在镰孢菌属、腐质霉属、淡紫拟青霉属、旋孢腔菌属、拟盘多毛孢属等,但抗性和易感品种在各个属丰度上存在不同,抗性品种‘抗青283’ב抗青10’根际真菌淡紫拟青霉属、斜盖伞属、被孢霉属的相对丰度均高于易感品种‘强桑1号’。淡紫拟青霉是被广泛应用的一种生防菌,单独或者结合药剂使用都能增强植物的抗逆性[21-23],张雅静等[24]研究表明,淡紫拟青霉菌株对黄瓜根腐病和根结线虫病的防效高于同类商品菌株,张菁等[25]研究表明淡紫拟青霉属可诱导番茄植物防御酶活性的提高进而抑制番茄霉灰病的发生。木霉能产生多种拮抗物质及水解酶能对很多病原因子产生抑制作用,是目前研究较多、应用广泛的一种生防菌[26-28],‘抗青283’ב抗青10’和易感桑品种‘强桑1号’的根际土壤中均检测到木霉菌,但抗性品种的木霉菌含量低于易感品种,具体原因将进一步探索。
进一步通过LDA Score进行LEfSe分析,发现抗、感青枯病桑树品种的根际真菌群落的重要作用类群存在差异。海壳科、小皮伞科、球囊霉目_f_uncultured_是‘抗青283’ב抗青10’的重要真菌群落,研究表明球囊霉目属于从枝菌根真菌[29],丛枝菌根真菌对多种作物病害具有防控作用[30-32],因此球囊菌目可能与桑树对青枯病抗性有关。对于‘抗青283’ב抗青10’根际聚集的小皮伞科、海壳科、瓶霉属是否与其抗性有关有待进一步探索。
对抗、感品种土壤根际真菌群落进行营养型分类结果发现,抗性品种‘抗青283’ב抗青10’根际真菌病原营养型真菌数量相对较多,而易感品种‘强桑1号’根际聚集了相对较多的腐生营养型和共生营养型真菌,这与李朋发等[33]研究镰刀根腐病发病与未发病植株根际真菌的营养型组成有所不同。周峰等[34-35]在研究植物病原菌效应蛋白时发现,宿主植物的抗性基因产物若能与病原菌的无毒基因的效应产物产生不相容性,则植物不会发生病害,本研究中抗性品种‘抗青283’ב抗青10’基因产物与其根际病原菌是否存在这种互作关系,将是未来研究的方向之一。
本研究结果表明,2种抗桑青枯病桑树根际土壤真菌群落优势菌群丰度和多样性无显著差异,抗性品种根际检测到可能与其抗性有关的淡紫尼青霉属和丛枝菌根球霉菌目。研究结果将为海南桑青枯病拮抗真菌的筛选与有效利用奠定基础。
参考文献
[1] 杨统一, 曲静怡, 赵卫国, 等. 不同抗病性桑树品种根际土壤微生态环境特征分析[J]. 蚕业科学, 2015, 41(2): 211-217.
[2] 高 东, 何霞红. 生物多样性与生态系统稳定性研究进展[J]. 生态学杂志, 2010, 29(12): 2507-2513.
[3] Bonilla N, Gutiérrezharranquero J A, Vicente A D, et al. Enhancing soil quality and plant health through suppressive organic amendments[J]. Diversity, 2012, 4(4): 475-491.
[4] Santhanam R, Weinhold A, Goldberg J, et al. Native root-associated bacteria rescue a plant from a sudden-wilt disease that emerged during continuous cropping[J]. Pro-ceedings of the National Academy of Sciences, 2015, 112(36): 5013-5020.
[5] 王茹華, 张启发, 周宝利, 等. 浅析植物根分泌物与根际微生物的相互作用关系[J]. 土壤通报, 2007, 38(1): 167- 172.
[6] 刘先良. 接种丛枝菌根真菌对烟草生长及烟草青枯病的影响[D]. 重庆: 西南大学, 2014.
[7] 董朝霞, 于 翠, 邓 文, 等. 桑树青枯病的发生与防治研究进展[J]. 北方蚕业, 2019, 40(4): 1-7.
[8] 龚云丽, 毕银丽, 胡晶晶, 等. 接种AM真菌对玉米生长的影响及叶片全氮含量的高光谱估测[J]. 环境工程, 2020, 38(5): 210-214.
[9] 张 深. 烟草青枯病拮抗菌的篩选及抗菌物质的研究[D]. 重庆: 西南大学, 2007.
[10] 董夏伟. 烟草青枯病拮抗真菌的筛选、鉴定及活性产物研究[D]. 扬州: 扬州大学, 2011.
[11] 黎起秦, 林 纬, 陈永宁, 等. 植物土传病害拮抗真菌的筛选[J]. 西南农业学报, 1999, 12(3): 81-84.
[12] 韦广锋, 韦应科. 桑树青枯病发生规律及防治对策[J]. 广西蚕业, 2010, 47(2): 27-30.
[13] Mukherjee P K, Chandra J, Retuerto M, et al. Oral mycobi-ome analysis of HIV-infected patients: identification of pi-chia as an antagonist of opportunistic fungi[J]. PLoS Patho-gens, 2014, 10(3): e1003996.
[14] 陆雅海, 张福锁. 根际微生物研究进展[J]. 土壤, 2006, 38(2): 113-121.
[15] 王 芳, 图力古尔. 土壤真菌多样性研究进展[J]. 菌物研究, 2014, 12(3): 178-186.
[16] 郑 钰, 高 博, 孙立夫, 等. 银叶杜鹃和繁花杜鹃根部真菌的多样性[J]. 生物多样性, 2010, 18(1): 76-82.
[17] 王艳云, 郭笃发. 黄河三角洲盐碱地土壤真菌多样性[J]. 北方园艺, 2016(18): 185-189.
[18] 李越鲲, 孙燕飞, 雷勇辉, 等. 枸杞根际土壤真菌群落多样性的高通量测序[J]. 微生物学报, 2017, 57(7): 1049-1059.
[19] 付亚娟, 张江丽, 侯晓强. 大花杓兰根际与非根际土壤真菌多样性的高通量测序分析[J]. 西北农业学报, 2019, 28(2): 253-259.
[20] 杜 璨, 杜 璇, 范学科, 等. 云杉林和红桦林土壤真菌群落的多样性及其与环境因子的相关性[J]. 贵州农业科学, 2020, 48(9): 74-80.
[21] 范瑞琦, 罗学曾, 杨雪婷, 等. 线虫生防真菌淡紫紫孢菌PLHN鉴定及其生物学特性[J]. 中国植保导刊, 2019, 39(12): 5-13.
[22] 叶田会, 闫芳芳, 张瑞平, 等. 永卫-168与淡紫拟青霉联合防治烟草根结线虫病的效果评价[J]. 安徽农业科学, 2020, 48(4): 132-133, 145.
[23] 王永霞, 王娇娇, 黄燕妮, 等. 海南红树林淡紫拟青霉胞外多糖抗HSV-1作用研究[J]. 解放军医药杂志, 2020, 32(8): 1-5.
[24] 张雅静, 宋美燕, 张怡静, 等. 从京北蔬菜根际土壤中筛选同时防治黄瓜根腐病和根结线虫病的淡紫拟青霉和哈茨木霉[J]. 生物技术通报, 2021, 37(2): 1-11.
[25] 张 菁, 连清贵, 陈 婧, 等. 淡紫拟青霉QLP12对感染灰霉病后番茄植株的促生作用及抗病相关酶活性变化[J]. 植物保护学报, 2018, 45(5): 1088-1095.
[26] 朱萍萍, 凌 健, 席亚东, 等. 蔬菜土传病害生防木霉菌株资源的筛选及其防治效果评价[J]. 中国蔬菜, 2015, 1(8): 28-33.
[27] Rojo F G, Reynoso M M, Ferez M, et al. Biological control by Trichoderma species of Fusarium solani causing peanut brown root rot under field conditions[J]. Crop Protection, 2006, 26(4): 549-555.
[28] Mukherjee Mala, Mukherjee P K Horwitz B A, et al. Tri-choderma-plant-pathogen interactions: advances in genetics of biological control[J]. Indian Journal of Microbiology, 2012, 52(4): 522-529.
[29] 刘永俊, 冯虎元. 丛枝菌根真菌系统分类及群落研究技术进展[J]. 应用生态学报, 2010, 21(6): 1573-1580.
[30] 丁锦平. 丛植菌根提高棉花产量及抗黄萎病的研究[D]. 商丘: 商丘师范学院, 2016.
[31] 刘起丽. 共生丛植菌根减轻番茄黄化卷叶撒丁岛病毒症状和降低病毒浓度[J]. 农业生物技术学报, 2014, 22(2):149.
[32] 姜 磊, 李焕勇, 张 芹, 等. AM真菌对盐碱胁迫下杜梨幼苗生长与生理代谢的影响[J]. 南京林业大学学报(自然科学版), 2020, 44(6): 152-160.
[33] 李朋发, 杨 龙, 李桂龙, 等. 基于FUNGuild的镰刀菌根腐病发病烟株根际真菌群落研究[J]. 中国烟草学报, 2019, 25(2): 63-68.
[34] 周 峰. 植物病原真菌效应蛋白研究进展[J]. 江苏农业科学, 2016, 44(10): 31-34.
[35] 林树文. 基于模式物种的草坪草与病原真菌蛋白互作预测与分析[D]. 福州: 福建农林大学, 2016.
责任编辑:谢龙莲

